Файл: 2 Происходит при участии кислорода окисление органических веществ.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 16
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
32.Схожие черты, отличия горения и биологического окисления. Биологическая роль кислорода. Пути использования. Проявления токсичности.
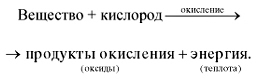 Горение – реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света
Горение – реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и светаПри горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро.
Сходство:
1) происходит окисление органических веществ до конечных продуктов углекислого газа и воды
2) Происходит при участии кислорода – окисление органических веществ
Различие:
-
биологическое окисление происходит медленно, последовательно в процессе нескольких реакций, а горение – быстрый процесс в виде одной реакции; -
БО протекает при температуре человеческого тела, а для горения необходимо нагревание -
при горении вся энергия выделяется в виде тепла, а при биологическом окислении часть энергии аккумулируется в молекулах АТФ в виде энергии химических связей. При горении вся энергия переходит в световую и тепловую, ничего при этом не запасается. При клеточном дыхании запасается энергия в молекулах АТФ, которая впоследствии расходуется во всех процессах жизнедеятельности: синтезе органических веществ, росте, развитии, движении и др.
Следует также отметить другой вопрос, который долгое время занимал ученых. Вопрос был происхождении энергии активации необходимой для взаимодействия водорода и кислорода. Дело в том, что в молекулярной форме кислород относительно малоактивен, поэтому «гремучую смесь» (смесь кислорода с водородом) необходимо нагреть, а водород выходящий из трубки генератора - поджечь. В условиях организма это невозможно, поэтому дискуссия о происхождении энергии активации в процессах биологического окисления получила дальнейшее развитие. В 1897 году была обоснована первая гипотеза тканевого дыхания, названная гипотезой перекисного (пероксидного) окисления. Ее разрабатывали независимо А.Н. Бах в России и Энглер в Германии. Суть данной гипотезы состоит в том, что при дыхании, как считали авторы, происходит активирование молекул О2 за счет энергии самоокисляющихся веществ, образование пероксидов и разложение их с участием другого вещества
О = О – О – О – (активный кислород)
– О – О – + А (субстрат) А (пероксид)
А + В (второй субстрат) АО + ВО
Для указанных целей необходимо последовательное действие двух ферментов - оксигеназы и пероксидазы. Впоследствии оказалось, что это не главный, а частный случай окисления веществ при дыхании. В настоящее время известно, что это тип медленного окисления органических веществ имеет место в микросомах печени, а не в митохондриях.
Активация водорода достигается взаимодействием его с коферментами дегидрогеназ. Так редокс-потенциал (о природе и величине редокс-потенциала будет сказано ниже) газообразного водорода равен 0 (нулю), а когда водород в составе кофермента НАДН·Н+ редокс-потенциал снижается до величины -0,32 В, что говорит об резком увеличении восстанавливающих свойств водорода.
Активация кислорода достигается путем взаимодействия на уровне цитохромоксидазы двух электронов, идущих по дыхательной цепи с молекулой О2. В результате неполного восстановления молекулы О2 (для полного восстановления молекулы О2 необходимо 4 электрона) образуется активная форма кислорода - пероксидный свободный радикал. Таким образом, теория активации кислорода также нашла свое подтверждение.
ЗНАЧЕНИЕ:
Реактивные формы кислорода (РФК) или активные формы кислорода (АФК) (англ. Reactive oxygen species, ROS) - включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. Это, как правило, небольшие молекулы с исключительной реактивностью благодаря наличию неспаренного электрона на внешнем электронном уровне.
АФК постоянно образуются в живой клетке как продукты нормального метаболизма кислорода. Активные формы кислорода образуются также под действием ионизирующего излучения. Некоторые АФК могут играть роль медиаторов важных внутриклеточных сигнальных путей. Однако повышенная продукция АФК приводит к оксидативному стрессу. Нормальные функции АФК включают индукцию иммунной системы и мобилизацию систем ионного транспорта. Например, клетки крови на месте повреждения начинают продуцировать АФК, что рекрутирует тромбоциты, необходимые для начала процесса заживления раны. РФК также запускают программируемую клеточную смерть (апоптоз).
В настоящее время выделено 4 основные пути использования кислорода в организме:
1. Оксидазный путь - окислительное фосфорилирование. Является основным источником АТФ в аэробных тканях. Потребляет 90% кислорода.
2. Монооксигеназный путь. Обеспечивает включение 1 атома кислорода в молекулу субстрата. Используется для синтеза новых веществ (стероидные гормоны), обезвреживания ксенобиотиков и токсических продуктов обмена в митохондриях и ЭПР.
3. Диоксигеназный путь. Обеспечивает включение молекулы кислорода в молекулу субстрата. Используется для деградации АК и синтеза новых веществ.
4. Пероксидазный и радикальный пути. Кислород участвует в образовании перекисей и активных радикалов, которые необходимы в пероксисомах для внутриклеточного пищеварения, разрушения макрофагами бактерий, вирусов, регуляции метаболизма и т.д. Перекиси и активные кислородные радикалы оказывают также повреждающее воздействие на структуры клеток и тканей, активируя ПОЛ. Разрушение перекисей и инактивация свободных радикалов осуществляется с помощью ферментативной и неферментативной антиокидантной системы.
33.Дыхательный контроль. Коэффициент P/O. КПД тканевого дыхания.
В норме субстраты тканевого дыхания и О2 находятся в достаточном количестве и не лимитируют окислительное фосфорилирование. Активность окислительного фосфорилирования ограничивает только концентрация АДФ, которая обратно пропорциональна концентрации АТФ.
При нагрузке концентрация АТФ снижается, а АДФ увеличивается, что ускоряет дыхание и фосфорилирование. В состоянии покоя количество АТФ увеличивается, а АДФ снижается, что тормозит дыхание и фосфорилирование.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. В результате дыхательного контроля скорость синтеза АТФ соответствует потребностям клетки в энергии. Общее содержание АТФ в организме 30—50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40—60 кг АТФ и столько же распадается
Подводя итог, можно сказать, что дыхательный контроль – это прямое ингибирующее влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ / АДФ, количественная сумма которых в клетке примерно постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Для оценки эффективности окислительного фосфорилирования используют коэффициент окислительного фосфорилирования (Р/О).
Коэффициентом окислительного фосфорилирования называют отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания.
При окисление молекулы НАДН2, е- по дыхательной цепи проходят 3 пункта сопряжения, что обеспечивает синтез 3 АТФ при затрате 3 Н3РО4 и 3 АДФ на 1 атом кислорода. Соответственно для НАДН2 Р/О=3.
При окисление молекулы ФАДН2, е- по дыхательной цепи проходят только 2 пункта сопряжения, что обеспечивает синтез 2 АТФ при затрате 2 Н3РО4 и 2 АДФ на 1 атом кислорода. Соответственно для ФАДН2 Р/О=2.
Э
ти величины Р/О отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт.
Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т.е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН2 на I и II комплексах, ингибирование ферментов ЦТК и пируват-дегидрогеназы под влиянием НАДН и замедление катаболизма в клетке.
Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+.
При этом протонный градиент, естественно, снижается, подавление движения электронов не происходит и поэтому величина потока электронов по цепи возрастает. В результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров
34.Разобщение окисления и фосфорилирования. Эндогенные и экзогенные
разобщители. Механизм разобщения. Ингибиторы комплексов тканевого
дыхания.
35.Токсичность кислорода. Активные формы кислорода. Механизм их
образования. Механизмы повреждения. Антиокисданты.
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
- гидроксильный радикал;
- супероксидный анион;
- пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов.
ЦПЭ как источник активных форм кислорода
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток.
Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона - KoQH•
Монооксигеназы, например цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода.
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода - гидроксильного радикала (ОН•) по следующей реакции:
Fe2+ + Н2О2 → Fe3+ + ОН- + ОН•.
Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.

