Файл: Реферат по дисциплине Общая и неорганическая химия.docx
Добавлен: 16.03.2024
Просмотров: 41
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
РЕФЕРАТ
по дисциплине: «Общая и неорганическая химия»
на тему: S-элементы.
Выполнила студентка группы Ф-11/21
Проверил преподаватель:
Нальчик
2022
Содержание
| | Введение……………………………………………………………………… | 3 |
| 1. | Общая характеристика s-элементов ……………………….......................... | 3 |
| 2. | Щелочные металлы……………………………….......................................... | 4 |
| 3. | Нахождение в природе……………………………........................................ | 5 |
| 4. | Интересные факты……………………………............................................... | 6 |
| 5. | 10 рекордсменов среди металлов……………………................................... | 16 |
| 6. | Понятие МСФО……………………………………………………………… | 17 |
| 7. | Международные стандарты и российский учёт…………………………… | 19 |
| 4. | Унификация систем бухгалтерского учёта………………………………… | 21 |
| | Выводы……………………………………………………………………….. | 23 |
| | Список использованной литературы……………………………………….. | 25 |
ВВЕДЕНИЕ
S Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
К s-элементам относятся:
-
щелочные металлы, -
щелочноземельные металлы, -
водород и гелий.
1.ОБЩАЯ ХАРАКТЕРИСТИКА S-ЭЛЕМЕНТОВ.
К
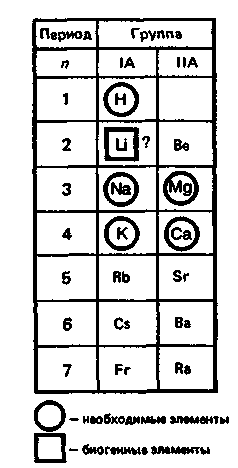 блоку s-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Электронная формула внешней оболочки элементов IА-группы и водорода ns
блоку s-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Электронная формула внешней оболочки элементов IА-группы и водорода ns
1
Как следует из электронных формул, элементы IА-группы имеют на внешнем энергетическом уровне по одному s-электрону, а элементы IIА-группы — по два электрона.
Химические свойства s-элементов IА- и IIА-групп сходны. s-Элементы легко отдают валентные s-электроны, т. е. они представляют собой сильные восстановители. Элементные вещества — типичные металлы, обладающие блеском, высокой электрической проводимостью и теплопроводностью, химически весьма активны.
s-Элементы имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило, они образуют соединения с ионным типом связи, исключение составляет водород, для которого в соединениях даже с самыми электроотрицательными элементами (например, в воде) характерна преимущественно ковалентная связь. Частично ковалентный характер связи в соединениях в известной мере имеет место у лития, бериллия и магния.
Большинство природных соединений натрия, калия, кальция, стронция растворимы в воде и слабых кислотах, и поэтому ионы этих металлов могут мигрировать из водных растворов в организм растений, животных и человека.
Водород, натрий, калий, магний, кальций — жизненно необходимы для живых и растительных организмов. [1]
2.ЩЕЛОЧНЫЕ МЕТАЛЛЫ.
Щелочными называются метаны, расположенные в первой главной (LА) группе периодической системы элементов К ним относятся литий Li, натрий Na, калин К. рубидии Rb, цезии Cs. франций Fr. Гидроксиды этих металлов называются щелочами . именно поэтому сами металлы получили название щелочные .
Дэви Хэмфри (1778—1829)

Английский ученый. В 1808 г. путем электролиза солей и щелочей получил калий, натрий, барий, кальций, амальгаму стронция и магния. Имеет множество научных работ.
Наиболее важные из них в практическом отношении — натрии и калий. Схема строения их атомов дана в таблице 20. Строение атомов остальных щелочных металлов аналогично.
Щелочные металлы в своих соединениях проявляют степень окисления равную +1 их валентность также всегда равна 1. Они пластичны и легко режутся ножом. Щелочные металлы относятся к легким металлам, энергично взаимодействуют с кислородом (цезий со взрывом!), водой,
кислотами и большинством неметаллов, поэтому их хранят под слоем керосина.
При взаимодействии щелочных металлов с кислородом в зависимости от металла образуются оксиды состава

Знаешь ли ты?
В современных сотовых телефонах батарея изготовлена m гндрошш лития, помешенного в алюминиевый каркас.
При взаимодействии щелочных металлов, их оксидов и пероксидов с водой образуются гидроксиды общей формулы ROH. которые хорошо растворимы вводе, сильные основания (щелочи). Сила основании ROH возрастает от лития к цезию.
Гидриды щелочных металлов соответствуют формуле RH. В этих соединениях степень окисления водорода равна -1.
3.НАХОЖДЕНИЕ В ПРИРОДЕ.
Из-за своей активности металлы этой группы в свободном состоянии в природе не встречаются. Из соединении щелочных металлов широко распространены соединения калия и натрия, поэтому натрий и калин относятся к числу восьми наиболее распространенных элементов земной коры (2.64 и 2.41% по массе соответственно).
Соединения других щелочных металлов встречаются редко. Франипи получен искусственно, радиоактивным металл мало исследован и не имеет практического применения. Соли калия имеют очень большое значение в жизни растений.
4.ИНТЕРЕСНЫЕ ФАКТЫ.
Название щелочные произошло от латинского слова, означающего "растворимое, едкое вещество”
Рубидий и цент — редкие элементы. Их соединения используются для изготовления фотоэлементов, в медицине и органической химии.
Щелочными называют металлы, расположенные в первой главной (IA) группе периодической системы элементов. Гидроксиды этих металлов называются щелочами щ именно поэтому' сами металлы получили название щелочные . Все они имеют один s-электрон на наружном электронном слое, и электронная конфигурация может быть представлена как
5. 10 РЕКОРДСМЕНОВ СРЕДИ МЕТАЛЛОВ.
-
Алюминий — самый распространенный -
Франций — самый редкий на Земле -
Осмий — самый плотный -
Литий — самый легкий -
Серебро — самый электропроводный -
Калифорний — самый дорогой -
Вольфрам — самый тугоплавкий -
Ртуть — самый легкоплавкий -
Иридий — самый стойкий к кислотам -
Хром — самый твердый
Натрий
Название элемента натрий
Строение. Химическим элемент с порядковым номером 11. Атомная масса 22.98. Находится в 3-м периоде в главной подгруппе 1 группы Периодической системы Д. И. Менделеева. электронная формула
Нахождение в природе . По распространенности в земной коре натрий занимает шестое место. Огромное количество солей натрия содержится в морской воде. Минералы натрия разнообразны. Наиболее важные из них— галит NaCI (поваренная, пли каменная, соль), мирабилит, или глауберова соль.
крупные из них находятся в Алматинском и Кызылордынской областях.
Физические свойства. Натрий представляет собой серебристо-белый металл. Он мягок: легко режется ножом. Натрий относится к легким

металлам
Натрий получают электролизом расплавленного хлорида натрия, реже гидроксида натрия:
Химические свойства.По химическим свойствам натрии —активный металл. Его хранят под слоем керосина или машинного масла.
1. Взаимодействие с кислородом . При окислении натрия недостатке кислорода при умеренном нагревании образуется оксид натрия (рис. 43):
2. Натрий энергично взаимодействует со многими нем станами, причем взаимодействие со фтором и хлором сопровождается воспламинением ,
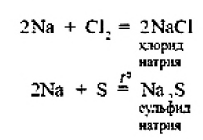

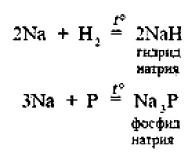
3. Натрии бурно взаимодействует с водой с образованием гидроксида натрия и выделением водорода
4. Активно происходит взаимодействие натрия с различными кислотами, например :
Применение. Металлический натрий широко используется в препаративной химии н промышленности как сильный восстановитель, в т. ч. в металлургии. Натрий используется в производстве весьма энергоемких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрии применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
Натрии также относится к жизненно важным элементам
