Файл: 2 материалы и методы исследования 1 Общие представления об определении комплексообразующей способности пектина.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 16
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Общие представления об определении комплексообразующей способности пектина
2.2 Методика определения комплексообразующей способности пектина по отношению к меди, свинцу, никелю
3.1 Изучение комплексообразующей способности пектиновых веществ с медью
3.2 Изучение комплексообразующей способности пектиновых веществ с кобальтом
3.3 Изучение комплексообразующей способности пектиновых веществ с никелем
2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Общие представления об определении комплексообразующей способности пектина
В присутствии поливалентных ионов металлов пектины осаждаются из растворов [47]. Стабильность комплекса пектиновых веществ с катионами зависит от наличия свободных карбоксильных групп, то есть степени этерификации, которая определяет линейную плотность заряда макромолекулы, а также, следовательно, силу и способ связи катионов. При высокой степени этерификации пектина кальциевые и стронциевые соли пектиновой кислоты практически полностью диссоциируют. С уменьшением степени этерификации, то есть при увеличении заряда макромолекулы, связь пектиновых веществ с катионами возрастает, а константа стабильности солей увеличивается в функции, близкой к логарифмической зависимости [42, 48]. При степени этерификации около 40% происходит изменение конформации, приводящей к агрегатированию пектиновых макромолекул и образованию прочной внутримолекулярной хелатной связи [43, 49].
Большое количество предлагаемых методик основано на образовании осадка пектината металла и его анализом: определение количества связанного металла в осадке. Ещё можно использовать метод определения по остаточному, не связанному, металлу в надосадочной жидкости. Анализирование осадка требует предварительной и длительной пробоподготовки, обычно используют «мокрое сжигание», а также проведения холостого опыта из-за возможного загрязнения пектиновых веществ определяемым элементом [50].
Проще всего с этой точки зрения использовать методики определения комплексообразующей способности по остаточному, то есть не поглощенному металлу, которые основаны на анализе надосадочной жидкости [31].
Многочисленные исследователи отдают предпочтение проверенным классическим методам комплексонометрии. Однако в последние годы широкое распространение получили такие методы анализа, как электрохимические и спектрофотометрические. Амперометрия, потенциометрия и кулонометрия позволяют проследить весь процесс образования пектата металла [46, 49]. К их достоинствам можно отнести доступность оборудования, простоту проведения эксперимента.
2.2 Методика определения комплексообразующей способности пектина по отношению к меди, свинцу, никелю
В данной работе исследовалась способность яблочного пектина связывать поливалентные катионы никеля, кобальта и меди и выяснялось влияние концентрации растворов пектина в продуктах питания с точки зрения выведения этих элементов из организма. Концентрацию пектина изменяли в диапазоне от 0,5% до 2,0%. Связывающую способность пектина определяли путем взаимодействия 15 мл раствора пектина с 5%-ыми растворами солей исследуемых металлов. С целью обеспечения полноты соединения пектина в виде соответствующих комплексов объем осаждающего реагента варьировали от 5 до 15 мл при увеличении концентрации пектина от 0,5 до 2,0%. Исследования проводились в кислой и щелочной средах. Реагирующие вещества и полученные растворы выдерживали в термостате в течении 30 мин и 1 ч и при разных температурах: 20°С, 37°С. Полученные осадки отфильтровывали, затем измеряли оптическую плотность фильтрата на фотоколориметре КФК-2МП, длину волны определяли по наибольшему показателю оптической плотности, путем измерения 1%-го раствора соли. Измерения проводились 3 раза, значения усреднялись.
2.3 Объекты, приборы и материалы исследования
Объект исследования: яблочный пектин, получен Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП). Внесен Техническим комитетом по стандартизации ТК 93 "Продукты переработки плодов и овощей". Утвержден и введен в действие Постановлением Госстандарта России от 6 сентября 2002 г. N 326-ст.21.
Для определения физико-химических характеристик были использованы следующие приборы:
-
весы аналитические 2-го класса точности с наибольшим пределом взвешивания 150 г по ГОСТ 24104; -
электротермостат, обеспечивающий температуру (103±2)ºС; -
фотоколориметр КФК-2МП, спектральный диапазон от 315 до 980 нм ГОСТ 15150-69; -
магнитная мешалка с подогревом ЭКРОСХИМ ПЭ-6110 по ТУ 4321-009-23050963-2007; -
кюветы прямоугольные кварцевые для спектрофотометров по ГОСТ 20903-75; -
пробирки по ГОСТ 19908-90; -
стаканы стеклянные по ГОСТ 19908-90; -
колбы плоскодонные по ГОСТ 19908-90; -
пипетки по ГОСТ 29227; -
цилиндры по ГОСТ 1770; -
бумага фильтровальная по ГОСТ 12026-76.
Реактивы:
-
яблочный пектин по ГОСТ 29186-91; -
HCl конц. по ГОСТ 25794.1-83; -
HNO3 конц. по ГОСТ 701-89; -
CuSO4•5H2O по ГОСТ 19347-2014; -
Ni(NO3)2•6H2O по ГОСТ 4055-78; -
CoCl2•6H2O по ГОСТ 4525-77; -
NaOH по ГОСТ 25794.1-83; -
дистиллированная вода, ГОСТ 52501-2005.
3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Нами проведены исследования по установлению характера влияния определённых количественных соотношений металл–пектин на комплексообразование пектина. Экспериментальные исследования были проведены в лаборатории химии кафедры общей и биологической химии экологического факультета УлГУ.
Для проведения наших исследований в качестве анализируемого объекта был выбран пектин, выделенный из яблок. Мы выбрали данный объект исследований потому, что этот пектин обладает высокой комплексообразующей способностью, уступая только свекловичному, свойства которого изучены очень подробно [32]. Комплексообразующая способность пектина, выделенного из яблок, ранее была изучена в небольшом объеме.
3.1 Изучение комплексообразующей способности пектиновых веществ с медью
Мы нашли оптические плотности пектин-медного комплекса при длине волны света 720 нм. Результаты измерений приведены нами в таблице 1 (Приложение А). На основе полученных результатов измерений построили градуировочный график зависимости концентрации ионов меди от их оптической плотности (рисунок 12). По найденным нами оптическим плотностям были определены их концентрации в растворах.
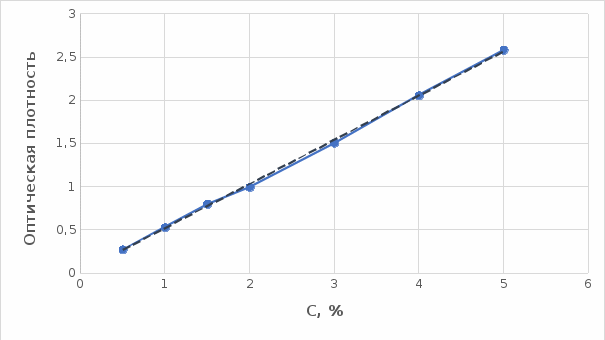
Рисунок 12. Градуировочный график зависимости концентрации ионов Cu2+ от оптической плотности.
По разности изначально взятого количества меди и не связавшегося с ним в комплекс пектином определили массу металла, связанного пектином. Результаты расчетов приведены в таблице 2 (Приложение Б).
Из полученных результатов мы узнали, что наибольшее связывание происходит при концентрации яблочного пектина 0,5% в кислой и щелочной средах. По этим данным мы построили графики зависимости связанного иона металла на 1 г пектина от объема раствора CuSO4•5H2O.
Результаты связывания пектина с медью в кислой среде представлены на рисунках 13 и 14:
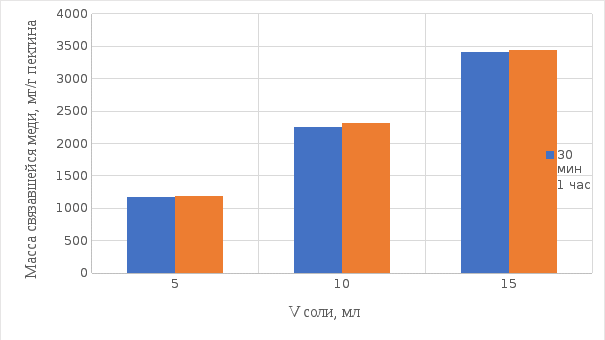
Рисунок 13. Связывание меди 0,5%-ным пектином при температуре 20°С.
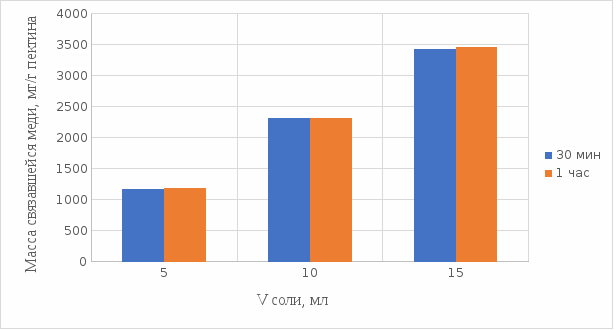
Рисунок 14. Связывание меди 0,5%-ным пектином при температуре 37°С.
На вышеприведенных графиках показано, что больше связывание происходит в течение 1 ч. Затем мы сравнили полученные данные связывания пектина с медью в комплекс в течение 1 ч при температурах 20°С и 37°С по графику (рисунок 15).
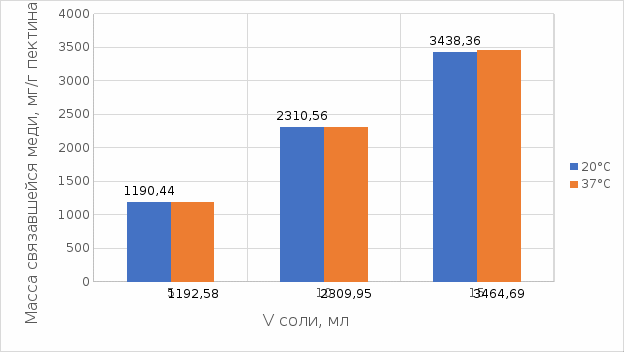
Рисунок 15. Сравнение связывания пектина в кислой среде при температуре 20°С и 37°С.
По графику на рисунке 15 видно, что в кислой среде яблочный пектин лучше связывается в комплекс с медью при температуре 37°С.
Результаты связывания пектина с медью в щелочной среде представлены на рисунках 16 и 17:
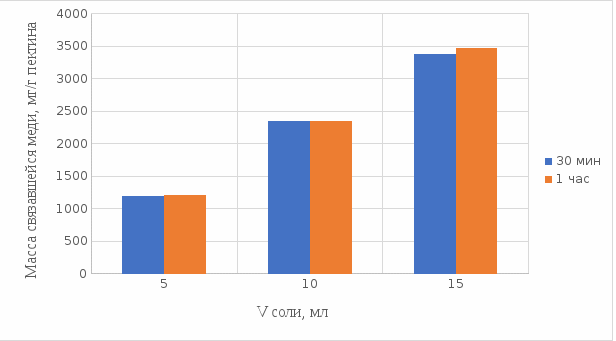
Рисунок 16. Связывание меди 0,5%-ным пектином при температуре 20οС.
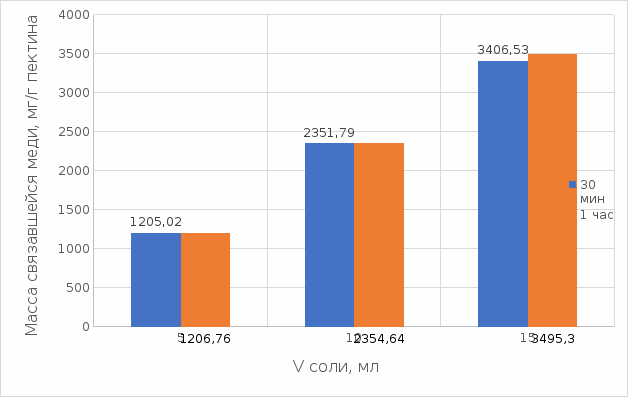
Рисунок 17. Связывание меди 0,5%-ным пектином при температуре 37°С.
По графикам на рисунках 16 и 17 можно наблюдать, что в щелочной среде связывание преимущественно происходит в течение 1 ч. Поэтому далее мы сравнили результаты связывания меди с пектином в комплекс в щелочной среде в течение 1 ч при температурах 20°С и 37°С по графику (рисунок 18):
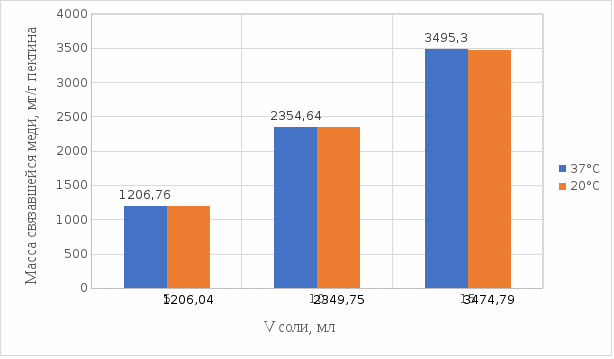
Рисунок 18. Сравнение связывание пектина в щелочной среде при температуре 20°С и 37°С.
По полученному графику (рисунок 18) видно, что связывание при температуре 37°С происходит в большем объёме.
Наконец, мы сравнили полученные результаты связывания пектина в комплекс с медью в течение 1 ч при температуре 37°С, так как это наилучший нами выявленный показатель, в кислой и щелочной средах по графику (рисунок 19):
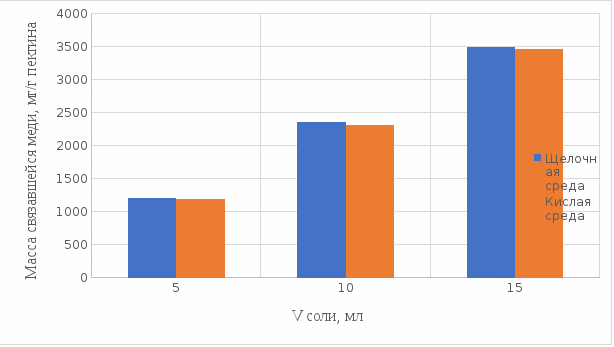
Рисунок 19. Сравнение связывания пектина с медью в кислой и щелочной средах.
По графику (рисунок 19) видно, что преимущественно наибольшее связывание происходит в щелочной среде.
Из полученных экспериментальным путём данных можно сделать вывод, что наибольшее связывание пектина с медью происходит в щелочной среде в течение 1 часа при температуре 37°С. Также было установлено, что пектин с медью образует комплекс состава 10:1 (одна молекула меди на десять моносахаридных фрагментов).
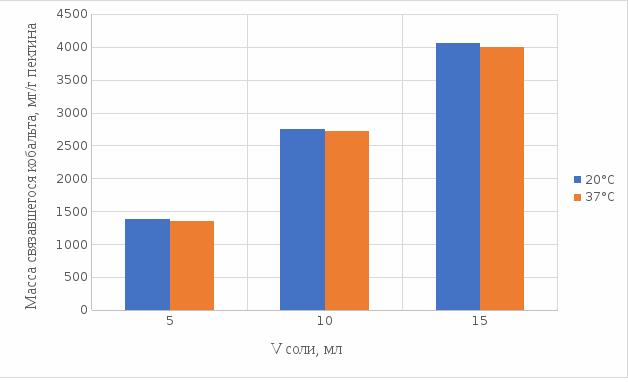
3.2 Изучение комплексообразующей способности пектиновых веществ с кобальтом
Мы нашли оптические плотности полученного комплекса пектин-кобальт при длине волны 540 нм. Результаты измерений приведены в таблице 3 (Приложение В). На основе полученных результатов построили градуировочный график зависимости концентрации ионов кобальта от оптической плотности (рисунку 20). По выше найденным нами оптическим плотностям определили их концентрации.
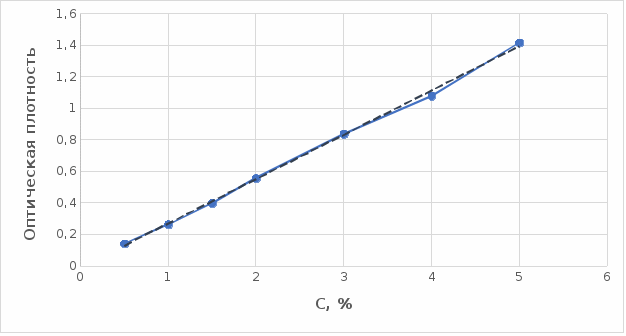
Рисунок 20. Градуировочный график зависимости концентрации Co2+ от оптической плотности.
По разности изначального количества кобальта и не связавшегося с пектином в комплекс определили массу металла, образующего с пектином комплекс. Результаты расчетов приведены в таблице 4 (Приложение Г).
Из полученных результатов можно сделать вывод, что преимущественное связывание кобальта с пектином в комплекс происходит при концентрации пектина 0,5% в кислой и щелочной средах. По этим данным мы построили графики зависимости массы связывающегося металла, в мг, на 1 г пектина от объема раствора CoCl2•6H2O.
Результаты связывания пектина в кислой среде представлены на рисунках 21 и 22:
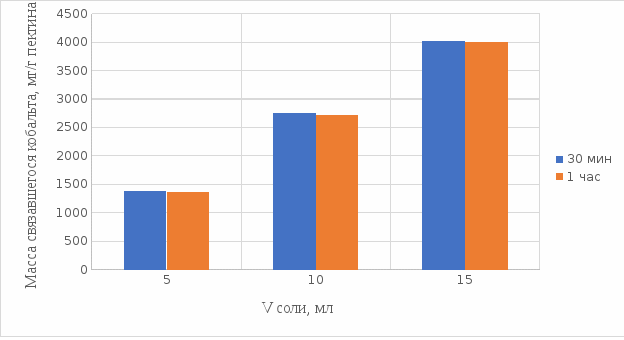
Рисунок 21. Связывание кобальта 0,5%-ным пектином при температуре 20°С.
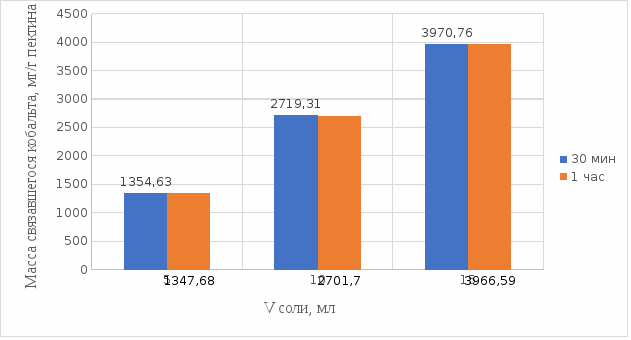
Рисунок 22. Связывание кобальта 0,5%-ным пектином при температуре 37°С.
Из выше приведенных графиков видно, что оптимальное связывание происходит в течение 30 мин. Мы сравнили эти данные связывания кобальта пектином в течение 30 мин при температурах 20°С и 37°С по графику (рисунок 23):
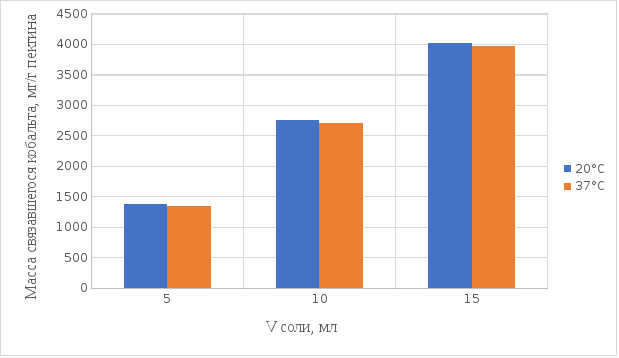
Рисунок 23. Сравнение связывания кобальта пектином в кислой среде при температуре 20°С и 37°С.
По графику (рисунок 23) видно, что в кислой среде больше всего пектин связывается в комплекс при температуре 20°С.
Результаты связывания пектина в щелочной среде представлены на рисунках 24 и 25:
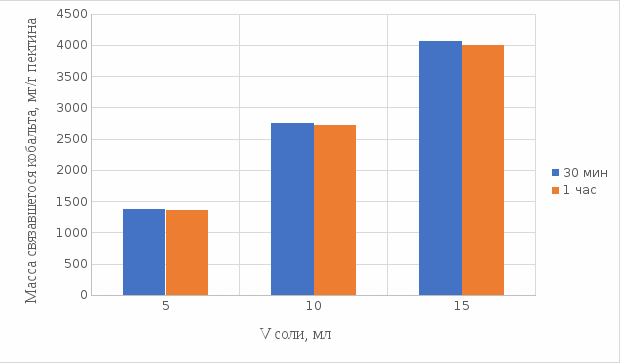
Рисунок 24. Связывание кобальта 0,5%-ным пектином при температуре 20°С.
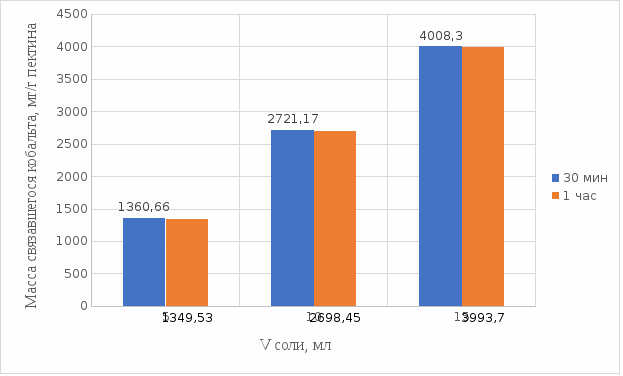
Рисунок 25. Связывание кобальта 0,5%-ным пектином при температуре 37°С.
По графикам (рисунки 24 и 25) наблюдаем, что в щелочной среде больше всего связывается в течение 30мин. Так же сравнили эти данные связывания кобальта с пектином в течение 30 мин при температурах 20°С и 37°С по графику (рисунок 26):