Файл: Учебное пособие по химии для студентов i курса факультета всо оренбург, 2016 удк 54(075. 8) Ббк 24я73 у 91.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 181
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| LOO· + LH -> LOOH + L· |
Чередование двух последних реакций как раз и представляет собой цепную реакцию перекисного окисления липидов.
В конце концов, цепи обрываются, поскольку свободные радикалы L·и LO2·, "ведущие" цепи окисления, исчезают из-за одной из возможных реакций обрыва цепей. Это могут быть следующие реакции:
| L· + L· -> LL | |
| L· + LO2· -> LOOL | |
| LO2· + LO2· -> L=O + LOH + фотон | |
СЛОЖНЫЕ ЛИПИДЫ
Ткани головного и спинного мозга содержат сложные структурные единицы, стоящие из белка и фосфотидов – фосфолипиды (производные a-фосфатидновой кислоты и ВЖК).
При гидролизе фосфатидов образуются глицерин, ВЖК, фосфорная кислота и амино-спирты или другие более сложные спирты.
В основе строения фосфолипидов лежит L-3-глицерофосфат.

Общая формула фосфолипидов:

Фосфатидилэтаноламины (кефалины)
1. Реакция образования. В основе реакция образования сложных эфиров ВЖК и глицерола по гидроксилам 1и 2 атомов, т.е. в a и β положениях и реакция образования сложного эфира между фосфорной кислотой и коламином)

Строение внутренней соли:

2. реакция омыления

Фосфатидилхолины
1. реакция образования фосфатидилхолина и реакция образования внутренней соли

2. реакция омыления

Фосфатидилсерин
1. реакция образования фосфатидилсерина и реакция образования его внутренней соли.

2. реакция омыления

Инозинфосфатиды
1. Монофосфоинозин

Неомыляемые липиды не гидролизуются в щелочной или кислой средах.
Стероиды: ХС (холестерол), ЭХС (эфир холестерола), Д3 (витамин), ПГ (половые гормоны), ГК (глюкокоритикоиды), МК (минералкоритикоиды).
Основным представителем стероидов является холестерол (ХС) животного происхождения. В организме человека составляет 140 гр. С пищей поступает 300-400 гр в сутки экзогенного ХС и около 1 гр синтезируется эндогенного холестерола в организме во всех клетках, но интенсивнее в печени из ацетил- CoA.
Холестерол это циклический одноатомный, ненасыщенный спирт, в основе лежит кольцо циклопентанпергидрофенатрен
Строение
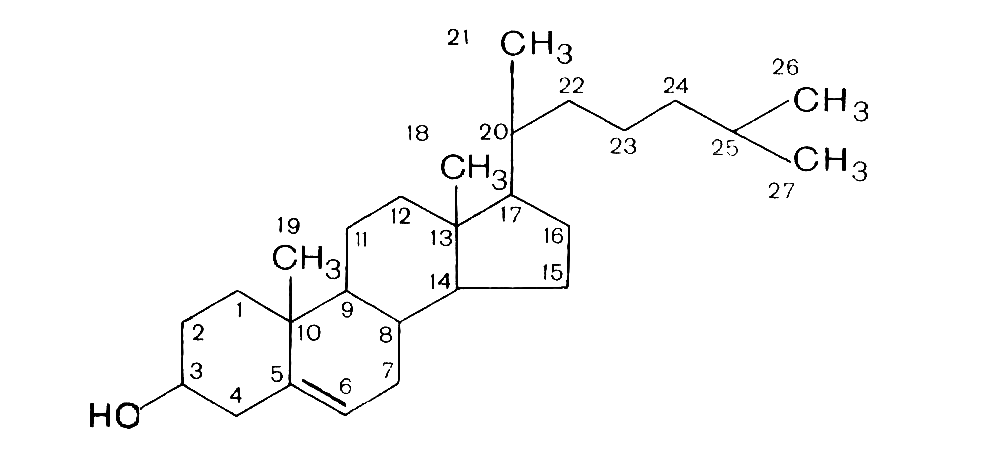
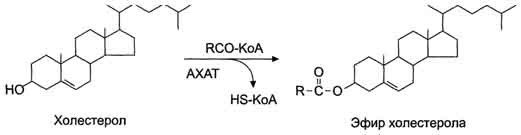
Холестерол образует с непредельными ВЖК эфиты холестерола (ЭХС)
Биологическая роль холестерола
- структурная
- источник биологически активных веществ: витамина Д3 ; половых гормонов; глюкокоритикоидов; минералкоритикоидов; желчных кислот (холевой, хенодезоксихолевой)
- в виде эфира холестирола транспортируют непредельные ВЖК из тканей в печень для синтеза триацилглицератов, фосфолипидов
VIII. Упражнения:
1. Написать строение всех насыщенных и ненасыщенных ВЖК. Для всех кислот написать эмпирическую формулу и конформационную структуру. Биологическая роль ненасыщенных ВЖК (ЭПК, ДГК).
2. Написать следующие уравнения химических реакций:
а) образование амида глютаминовой и аспарагиновой аминокислот,
биологическую роль образования амидов в организме;
в) написать схему реакции образования ацетил - КоА из ПВК (пировиноградной кислоты);
3. Показать схему ферментативного гидролиза ТАГ в желудочно-кишечном тракте.
4. Понятие о пероксидном окислении липидов. Схема ПОЛ олеиновой кислоты в составе ФЛ мембран.
5. Написать схему образования эфира ХС с олеиновой кислотой.
IX. Рекомендуемая литература:
а) основная учебная литература
1. Пузаков С.А. Химия: учебник для факультета ВСО – М.: ГЭОТАР-Медиа, 2006 – 640 с.
2. Пузаков С.А. Химия [Электронный ресурс] / Пузаков С.А., 2006 , ГЭОТАР-Медиа « Консультант студент»
б) дополнительная учебная литература
1. Тюкавкина, Н. А. Биоорганическая химия: учебник / Н. А. Тюкавкина, Ю.И. Бауков, С. Э. Зурабян. - М.: ГЭОТАР-Медиа, 2009. - 416 с
2. Тюкавкина Нонна Арсеньевна Биоорганическая химия [Электронный ресурс] / Тюкавкина Нонна Арсеньевна, 2012 , ГЭОТАР-Медиа « Консультант студент»
3. Материалы лекций
Занятие № 8
I.Тема 8: Аминокислоты, пептиды, белки
II.Актуальность темы: Белки составляют основу структуры и функций живых организмов. Они являются незаменимыми веществами, выполняя ряд уникальных функций. Свыше двадцати природных аминокислот, часть из них являются незаменимыми, включаются в различные реакции, имеющие общие и специфические пути превращения. Знание строения, классификации, номенклатуры, физико-химических свойств аминокислот, имеет большое теоретическое и практическое значение, для последующего изучения и применения этих знаний в медицинской практике.
III. Цель: Сформировать и закрепить знание о строении, классификации, химических свойствах аминокислот, пептидов, белков, как биологически важных химические реакции протекающие в живом организме. Знать понятие о белках и пептидах, строении белков и связях, формирующих первичную, вторичную, третичную и четвертичную структуру.
IV.Исходный уровень:
Для усвоения материала темы студент должен знать:.
1. Строение некоторых аминокислот.
2. Строение пептидной связи.
3. Понятие о белках и их биологическая роль.
V. Учебно – целевые вопросы к занятию
1. Аминокислоты, строение, номенклатура. Кислотно-основные свойства, биполярная структура.
2. Классификация: по химической природе радикала, по полярности радикалов, по кислотно-основным свойствам, по биологической значимости.
2. Химические свойства α-аминокислот:
а). Образование внутрикомплексных солей.
б). Реакции этерификации.
в). Образование пептидной связи.
г). Образование амидов.
4. Биологически важные биохимические реакции, протекающие в организме.
I.по α-NH2 группе: а) трансаминирование; б) дезаминирование
II. по α-СООН группе декарбоксилирование (образование биогенных аминов);
III. специфические превращения аминокислот ( трансметилирование на примере метионина);
5. Понятие о трансаминировании, строение кофактора ПАЛФ (роль витамина В6 в этом процессе). Механизм трансаминирования. Схема реакции на примере АЛТ (аланинаминотрансферазы). Биологическая роль трансаминирования.
6. Понятие о дезаминировании АМК. Виды дезаминирования: окислительное (глутаминовая кислота), гидролитическое (серин), внутримолекулярное (гистидин), восстановительное (аланин). Биологическая роль дезаминирования.
7. Превращение по α-СООН группе - декарбоксилирование α -аминокислот, образование биогенных аминов (коламина, гистамина, серотонина, кадаверина, дофамина, ГАМК). Биологическая роль биогенных аминов.
8. Понятие о пептидах и белках. Электронное и пространственное строение пептидной (амидной) связи.
9. Кислотный, щелочной и ферментативный гидролиз белков.
10. Установление аминокислотного состава белков с помощью современных физико-химических методов.
11. Структурная, пространственная организация белковой молекулы
а. Понятие о первичной, структуре белка.
б. Понятие о вторичной структуре белка, α - спираль и β - складчатая структура, связи, формирующие вторичную структуру.
в. Понятие о третичной, нативной конформации белка (глобулярные и фибриллярные белки), связи, формирующие третичную структуру.
г. Понятие о четвертичной структуре белка на примере белка Нb гемоглобина (Нb) , связи, которые формируют четвертичную структуру.
VI.после изучения темы студент должен
знать:
- строение, классификацию, биологическую роль АМК
- физико-химические свойства аминокислот:
а) образование пептидной связи
в) образование биогенных аминов
г) образование амидов
- значение метионина в виде активной формы SAM , как донора метильной группы для синтеза различных соединений (холина)
- понятие о белках, биологической роли и структурно-пространственной организации белковой молекулы
- некоторые качественные реакции на АМК (биуретовая, нингидриновая, ксантопротеиновая реакции, реакция Фоля, реакция Сакагучи, реакция Милона)
уметь:
- прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ
- использовать знания по строению АМК и белков для понимания физиологической роли их в организме
- объяснять значение биогенных аминов для нормального функционирования организма
- решать ситуационные задачи в рамках данной темы
владеть:
- навыками написания химических формул АМК
- навыками составления пептидов
- навыками написания химических реакций характерных для амнокислот
VII. Теоретический материал
Аминокислоты.
α-аминокислоты – гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома, т.е. аминокислоты – бифункциональные соединения (α-углеродного атома).Общая формула:
( основная функция) H2N-CH-COOH( кислотная функция)
R( радикал)
Биологическая роль аминокислот
1. Большая часть аминокислот используется для синтеза собственных белков организма (гормоны, ферменты и т.д.)
2. Для образования нейромедиаторов биогенных аминов. Глицин и глутаминовая кислота сами являются нейромедиаторами.
3. На биосинтез гормонов аминокислотной природы Т3 (трииодтиронин), Т4, (тетраиодтиронин или тироксин), адреналин, норадреналин.
4. На биосинтез гема и белка гемоглобина (Нв), Мв, ферментов каталазы.
5. Биоcинтез карнитина, креатина, азотистых оснований (пуриновых и пиридиновых)


