ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 82
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лекция 4
ЗАВИСИМОСТЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ И
ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОТ СТРОЕНИЯ МОЛЕКУЛЫ
Направленный синтез основан на том, что уже проверенное лекарственное вещество немного совершенствуется и модернизируется специалистами, а после проверяется на животных. Нужно заметить, что совсем малые изменения в структуре препарата могут сильно поменять активность вещества. Так, например, если в молекуле морфина заменить всего один атом водорода на метильную группу, то получится совсем другое средство – кодеин – средство от кашля, чье болеутоляющее действие уже снижено в десять раз. Если в той же молекуле морфина заменить 3 атома водорода на метильную группу, получится – тебаин, который вызывает судороги.
Целенаправленный синтез лекарственных веществ подразумевает создание веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия.
Классические закономерности влияния химической структуры молекулы на фармакологический эффект, используемые в настоящее время:
-
Влияние непредельных связей. Ненасыщенные соединения значительно активнее насыщенных. Например, трихлорэтилен более сильное снотворное средство, чем хлорэтан. -
Разветвление углеродной цепи усиливает физиологическое действие препарата. Например, в группе барбитуратов (препаратов снотворного действия) барбамил более эффективен как снотворный препарат, чем барбитал. -
Длина цепи. В пределах до С5 обычно происходит нарастание физиологического эффекта, а далее, начиная с С6 и выше, физиологический эффект уменьшается и, наконец, пропадает. Это объясняется тем, что при увеличении количества углеродных атомов в цепи растворимость веществ понижается, вследствие чего они не поступают в кровь и не достигают соответствующих центров, а поэтому и не вызывают необходимого эффекта. -
Оптическая изометрия. Установлено, что левовращающие изомеры часто активнее правовращающих. Установлено также, что изомеры действуют различно на вкусовые нервные окончания и имеют различную силу действия. Например, правовращающие аспарагиновая и глютаминовая кислоты сладкого вкуса, а их левовращающие изомеры - безвкусны. -
Введение галогенов. Галогенопроизводные как жирного, так и ароматического ряда обладают более активным действием, чем соответствующие им углеводороды. Например, метан не является наркотическим веществом, хлористый метил СНзСl уже обладает легким наркотическим действием, хлористый этил СНзСН2Cl и хлороформ СНСlз обладают соответственно более выраженным наркотическим действием. -
Введение аминогруппы. Приводит к усилению жаропонижающих свойств, например анилин обладает ясно выраженным антипиритическим свойством. Одновременно аминогруппа придает соединению токсичность, поэтому анилин, как известно, не является лекарственным препаратом. -
Одновременное присутствие в ароматическом ядре аминогруппы и гидроксила придает молекуле анестезирующие свойства, которые еще более усиливаются этерификацией гидроксила. -
Введение нитрогруппы (-N02) в ароматическое ядро придает молекуле антибактериальное действие, а также действие на центр дыхания. -
Введение нитрозогруппы (-N=O) направляет вещество к нервному центру, ответственному за расширение кровеносных сосудов (амилнитрит, натрия нитрит). -
Химическое строение. Как правило, вещества сходной химической структуры обладают однотипными фармакологическими свойствами. В связи с этим лекарственные вещества часто классифицируют по их химическому строению. Например, различные производные барбитуровой кислоты (барбитураты) оказывают сходное угнетающее влияние на ЦНС и применяются в качестве снотворных, а наиболее активные из них - в качестве средств для наркоза. Однако в ряде случаев сходное действие оказывают вещества разного химического строения (например, атропин и платифиллин). -
Физические и физико-химические свойства. Действие лекарственных веществ может зависеть от их физических и физикохимических свойств, таких как растворимость и характер растворителя. Как правило, для того, чтобы лекарственное вещество оказало действие, оно должно растворяться в воде или жидкостях организма. Чем лучше растворяется вещество, тем скорее окажет действие. Большое значение имеет и характер растворителя. Например, фенол плохо растворяется в воде, но водные растворы фенола являются хорошими антисептиками и хорошо растворяются в масле, но масляные растворы фенола значительно более слабые антисептики. По силе антисептического действия 1%-ный водный раствор фенола равен примерно 10%-ному масляному раствору. Это объясняется тем, что сродство фенола к маслам значительно больше, чем к липидам микробной клетки. -
Лекарственная форма оказывает существенное влияние на действие лекарственных веществ. Растворы, как правило, всасываются быстрее, чем порошки, порошки быстрее, чем таблетки и пилюли. Растворы, приготовленные на разных растворителях, всасываются с разной скоростью. Быстрее всего всасываются спиртовые, затем водные и затем масляные растворы.
Лекция 5
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ СПИРТОВ И АЛЬДЕГИДОВ
Спиртами алхимики называли все летучие вещества. Впервые этиловый спирт выделен из продуктов брожения в Италии в 11-12 вв. Абсолютированный этиловый спирт получил перегонкой водного раствора над поташом (карбонатом калия) Т. Е. Ловиц (1796). В 1855 М. Бертло синтезировал этиловый спирт из этилена (через этилсерную кислоту). Производство синтетического этилового спирта началось с 1930 в США.
Спирт этиловый 95%, 96 % ФС.2.1.0036.15
(Spiritus aethylicus)
Спирт этиловый 95% содержит от 94,9 % до 96,0% этанола С2Н6О); спирт этиловый 96% содержит от 95,1% до 96,9% этанола, в ГФ Х имеется ФС на спирты этиловые 90, 70 и 40%-ный.
Описание. Прозрачная бесцветная подвижная жидкость с характерным спиртовым запахом.
Растворимость. Смешивается с водой, хлороформом, ацетоном и глицерином во всех отношениях.
Получение
-
Брожение сахаристых веществ под влиянием дрожжевых ферментов.
C6H12O6 → 2C2H5OH + 2CO2
-
Из крахмала. При гидролизе крахмала образуется глюкоза
2(С6H10O5)n + H2O → nC12H22O11 (мальтоза) → 2C6H12O6 C6H12O6 → 2C2H5OH + 2CO2
Для брожения используют: сок плодово-ягодных культур, зерно, картофель, мелассу- отход сахароварения. Брожение происходит в присут. дрожжей при 15-30 °С, длительность от 10-15 ч до 2-3 сут. Реакц. смесь после брожения (бражка) содержит 10-14% спирта, воду, а также нелетучие примеси: дрожжи, соли, несбраживаемые углеводы, красящие вещества, глицерин, а также летучие примеси: метиловый, пропиловый, изобутиловый, изоамиловый. Последние три спирта составляют основу сивушного масла. Метиловый спирт содержится в зерно-картофельной и свекловичной бражке.
Далее полученную бражку подвергают ректификации (процесс основан на разных температурах кипения компонентов смеси). При этом получают 700, а затем 95-960, это спирт сырец (в котором содержатся летучие примеси метанол, сивушные масла, альдегиды и др.) Полученный спирт-сырец подвергают второй ректификации с целью очищения от примесей. В результате получается ректификационный спирт.
Получить 100% этиловый спирт ректификацией невозможно, так как температуры кипения абсолютного спирта и спирта, содержащего 4% воды одинаковы. Для получения абсолютного этанола используют химические методы связывания воды: этилат алюминия, сульфат натрия, негашеная известь (CaO), но в медицине абсолютный спирт не используется.
Для получения технического спирта используются синтетические методы получения:
-
Из этилена прямой гидратацией
-
Из ацетилена по реакции Кучерова.
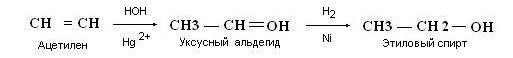
Медицинский спирт получают только методом брожения сахаристых веществ.
Подлинность:
ГФ:
-
Образование этилацетата.
Субстанцию смешивают с ледяной уксусной кислотой и концентрированной серной кислотой, при нагревании ощущается запах этилацетата.

-
Йодоформенная проба.
При взаимодействии спирта этилового с йодом в щелочной среде при нагревании образуется осадок желтого цвета с характерным запахом.
Не ГФ:
-
Окисление до альдегидов
При окислении спирта дихроматом калия в присутствии серной кислоты при нагревании ощущается запах уксусного альдегида.

Чистота:
-
ГФ требует испытание на кислотность и устанавливает допустимый ее предел. -
С помощью ГХ устаналивают наличие примесей: метанола, этилацетата, метилацетата, уксусного альдегида, сивушных масел. -
Также проверяют фурфурол, восстанавливающие вещества, нелетучие вещества, сульфаны, хлориды, тяжелые металлы.
Количественное определение
Спирт этиловый 95% имеет плотность от 0,808 до 0,812 г/см3, спирт этиловый 96%: от 0,804 до 0,811 г/см3. Измеряют с помощью ареометра или пикнометра.
Также концентрацию этилового спирта вычисляют по показателю преломления (рефрактометрия)
В настойках – по температуре кипения.
Хранение:
В плотно укупоренной упаковке, вдали от огня.
Применение:
-
Для приготовления настоек, экстрактов, как консервант. -
в виде компрессов как раздражающее средство, -
антисептическое средство, -
противошоковое средство (5-20% при в/в) -
Можно в качестве седативного и снотворного средства, хотя прием нерационален из-за угнетения центра дыхания. -
Энергетическое действие (при терапии истощенных
больных) При окислении 1 г спирта высвобождается 7,2 ккал
-
Как пеногаситель при бронхообструкции -
При отравлении этиленгликолем и метанолом.
ФС.2.1.0043.15 Формальдегида раствор Formaldehydi solution
CH2O М. м.
30,03
Получение
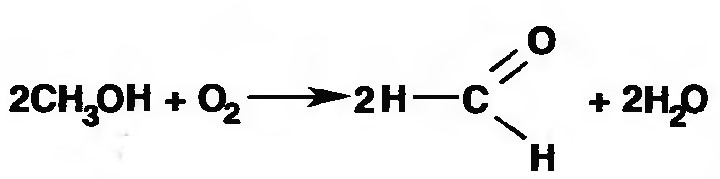
Формальдегид получают окислением метилового спирта кислородом воздуха. После охлаждения формальдегид (бесцветный газ с острым запахом) растворяют в воде до получения 34,5-38%- водного раствора, который называют формалином.
Описание раствора формальдегида
Прозрачная бесцветная жидкость с резким характерным запахом.
Смешивается с водой и спиртом 96 %.
Стабилизация и хранение.
Раствор формальдегида следует хранить в защищенном от света месте, при температуре не ниже +15 °С. При более низкой температуре происходит полимеризация с образованием параформа (параформальдегида) [СН2О]n — твердого белого вещества.
Для предохранения от полимеризации к раствору добавляют до 1% метилового спирта. Его роль - предупреждение окислительновосстановительного процесса превращения формальдегида в муравьиную кислоту.
При выпадении осадка параформа бутыль оставляют на сутки при комнатной температуре, далее осадок отфильтровывают и определяют фактическое содержание формальдегида. Лекарственные формы готовят исходя из фактического содержания.
Подлинность
По ФС
-
Реакция «серебряного зеркала».
К субстанции добавляют аммиачный раствор серебра нитрата; выделяется металлическое серебро в виде зеркала или серого осадка
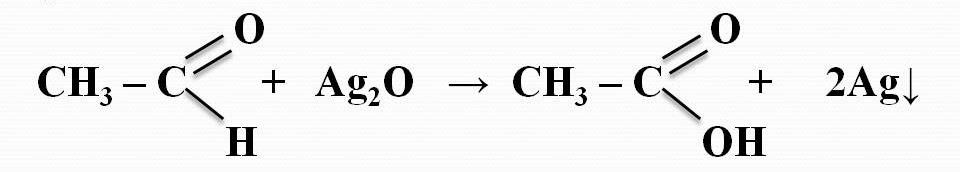
-
Реакция конденсации с салициловой кислотой
(специфическая реакция)
Салициловую кислоту растворяют в конц. серной кислоте. К полученному раствору прибавляют субстанцию и осторожно нагревают, появляется неисчезающее ярко-красное окрашивание (ауриновый краситель).
Не ФС: реакция с реактивом Фелинга, Нессера
Чистота
ГФ устанавливает допустимый предел кислотности. В результате получения, а затем и хранения формальдегида незначительно образуется муравьиная кислота, которая способствует образованию нерастворимого параформа. Количество муравьиной кислоты не должно превышать 0,2%.
Определяют ее, титруя гидроксидом натрия (индикатор фенолфталеин). Количественное определение.
1. Йодометрия.
Количественное определение формальдегида в растворе и хлоралгидрата можно провести, используя реакцию окисления альдегидов йодом в щелочной среде. Йод при этом образует гипойодит (сильный окислитель):
Гипойодит окисляет альдегиды до кислот:

Затем добавляют избыток серной кислоты, непрореагировавший гипойодит превращается в йод, который оттитровывают тиосульфатом натрия
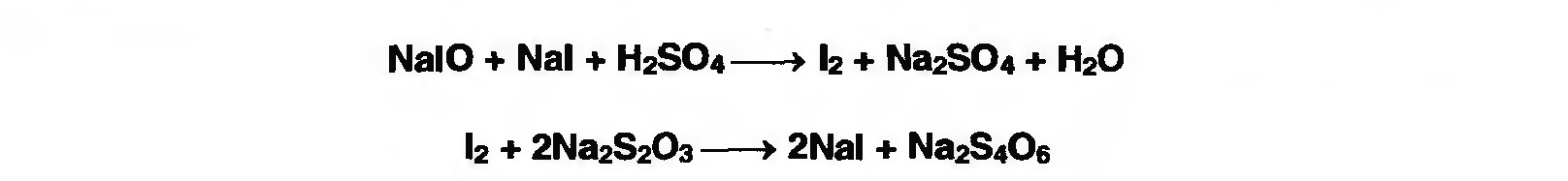
Применение
Является протоплазматическим ядом, не может назначаться внутрь
-
Применяется 0,5% раствор как дезинфицирующее средство для мытья рук, обработки хирургических инструментов, протирания ног при потливости. -
Для консервации анатомических и биологических препаратов.
Гексаметилентетрамин (уротропин, метенамин)
Hexamethylentetraminum
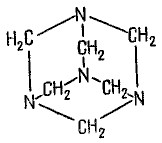
М.м. 140,19 г/моль Гексаметилентетрамин синтезирован А.М. Бутлеровым из параформальдегида и аммиака в 1860 г., но медицинское применение нашел только в 1895 г. Он представляет собой продукт конденсации формальдегида и аммиака.

По химическому строению гексаметилентетрамин может быть отнесен к гетероциклическим соединениям, производным триазина. Способы его испытаний и фармакологическое действие основаны на реакциях гидролиза, сопровождающихся образованием формальдегида.
Описание:
Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего и сладкого, а затем горьковатого вкуса. При нагревании улетучивается, не плавясь, так как гидролизуется с образованием аммиака и формальдегида.
Хорошо растворим в воде и спирте, хлороформе. Нерастворим в эфире. Водные растворы имеют слабощелочную реакцию.
Подлинность
ФС
Гидролиз гексаметилентетрамина (добавление кислоты служит для усиления гидролиза)
(CH2)6N4
