ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 86
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В качестве реактива также можно использовать FeSO4, в результате образуется фиолетовый аскорбинат железа. FeCl3 использовать нельзя, так как он является окислителем.
Восстановительные свойства:
Характерной частью молекулы аскорбиновой кислоты обуславливающей ее химические свойства является ендиольная группировка. Благодаря подвижности водородных атомов енольных гидроксильных групп аскорбиновая кислота легко окисляется, аскорбиновая кислота восстанавливает серебро из нитрата серебра уже при комнатной температуре в отличие от альдегидов.
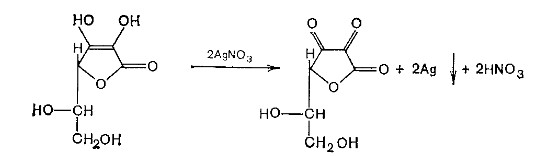
-
стадия - Аскорбиновая кислота окисляется до дикетоаскорбиновой кислоты (кетонная форма) способной снова восстанавливаться до аскорбиновой кислоты. -
стадия – Разложение дикетоаскорбиновой кислоты до фурфурола, процесс необратимый.
Количественное определение
-
Йодатометриметрический метод (прямое титрование). Субстанцию растворяют в воде, прибавляют раствор калия йодида и хлороводородной кислоты и титруют раствором калия йодата до появления стойкого слабо-синего окрашивания (индикатор - крахмал).
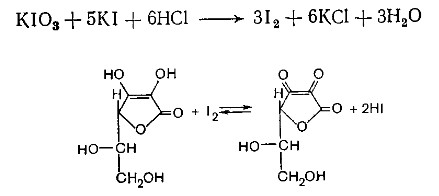
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты.
-
Йодометрия (обратное титрование).

-
Алкалиметрия. Титруют гидроксидом натрия как одноосновную кислоту по енольному гидроксилу в 3-м положении.
Стабилизация лекарственных форм
Кислота аскорбиновая используется в виде растворов для инъекций. Поскольку в растворах она легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (Na2SO3, Na2S2O5).
В раствор для инъекций добавляют натрия гидрокарбонат, так как препарат имеет кислую реакцию среды
, раздражающую ткани.
Хранение
В сухом защищенном от света месте, в хорошо укупоренной неметаллической таре.
Применение
В отличие от животных у человека не синтезируется. Наибольшее ее количество обнаруживается в надпочечниках, значительное количество содержится в лейкоцитах. Аскорбиновая кислота необходима для синтеза стероидных гормонов, норадреналина, адреналина. Витамин С обладает адаптогенным действием, повышает умственную и физическую работоспособность. Усиливает желудочную секрецию, всасывание железа, синтез гликогена, альбумина, протромбина, обезвреживание токсических веществ. При недостатке развивается цинга.
Лекция 8
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ АМИНОКИСЛОТ
Аминокислоты, класс органических соединений, объединяющих в себе свойства кислот и аминов, т. е. содержащих наряду с карбоксильной группой —COOH аминогруппу —NH2. В зависимости от положения аминогруппы относительно карбоксильной группы различают α-, β-, γ-, δ-, ε- и др.
аминокислоты.
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, растворимые в воде; в водном растворе молекулы имеют структуру главным образом амфотерных (двузарядных) ионов. Например, строение простейшей
аминокислоты — глицина — можно выразить формулой
Оптическая изомерия:
Оптическое вращение – способность вещества вращать плоскость поляризации при прохождении через него поляризованного луча. В зависимости от природы оптически активного вещества, вращение плоскости поляризации может иметь разные направления и величины. Если вращение по часовой стрелке (+), то вещество правовращающее.
Значение удельного вращения используют для определения подлинности, чистоты, количественного определения.
Глютаминовая кислота (ФС 42-0229-07)
Acidum glutaminicum

альфа-аминоглутаровая кислота
Описание
. Белый кристаллический порошок или бесцветные кристаллы. Легко растворим в кипящей воде, мало растворим в воде.
Удельное вращение. От + 30,5 до + 32,5º в пересчете на сухое вещество (10% раствор субстанции в 1 М растворе хлористоводородной кислоты).
Получение. В больших количествах содержится в белках мозга, злаковых культурах. Из них она и получается. Ранее путем кислотного гидролиза, сейчас синтетически из глутаровой кислоты.
Подлинность
На аминогруппу (-NH2)
Нингидриновая проба. Субстанцию растворяют в воде, добавляют раствор нингидрина и нагревают; появляется сине-фиолетовое окрашивание. Схема реакции:

Количественное определение:
-
Метод нейтрализации по карбоксильной группе. Аминогруппа мешает нейтрализации расположенной рядом карбоксильной группы, так как связывает водород. Нейтрализация идет по удаленной от аминогруппы карбоксильной группе. Титрант - 0,1 М раствор натрия гидроксида до перехода желтой окраски в голубовато-зеленую (индикатор бромтимоловый синий).
HOOC-CH2-CH2-CH(NH2)-COOH + NaOH → NaOOC-CH2-CH2-CH(NH3+)COO- + H2O
Поэтому f=1!
-
Формольное титрование. Чтобы аминогруппа не мешала титрованию и по второй карбоксильной группе, ее связывают добавлением формальдегида. При этом протекает реакция:

Теперь фактор эквивалентности становится равен ½!
-
Метод Кьельдаля.
Точную навеску АК, смешивают с порошком K2SO4, CuSO4 (10:1). К полученой смеси прибавляют H2SO4. Проводят реакцию в колбе Кьельдаля, соединенной с холодильником и специальным приемником. При нагреве идет минерализация:
C→CO2; N→NH3→(NH4)2SO4
Нагревают до полного просветления раствора, затем колбу охлаждают, прибавляют NaOH. Идет процесс нейтрализации избытка H2SO4, разрушение аммониевой соли.
H2SO4 + NaOH → Na2SO4 + H2O
(NH4
)2SO4 + NaOH → Na2SO4 + NH3 + H2O Аммиак в специальном приемнике реагирует с борной кислотой:
2NH3 + 4H3BO3 → (NH4)2B4O7 + 5H2O
Титруют HCl в присутствии м/о + м/с. Разрушается тетраборат с образованием H3BO4 + NH4Cl.
Применение: Таблетки при заболеваниях центральной нервной системы, при различных психических расстройствах. Хранение: В хорошо упакованной таре, недоступно для света.
Аминокапроновая кислота ФС.2.1.0001.15 Acidum aminocaproicum

Получение: В настоящее время синтетическим путем из
циклогексанона
Описание. Белый или почти белый кристаллический порошок или бесцветные кристаллы без запаха. Легко растворим в воде.
Подлинность по ФС
-
С нингидрином – сине-фиолетовое окрашивание -
Субстанцию растворяют в воде, прибавляют фенолфталеин и натрия гидроксид; должно появиться красное окрашивание. После прибавления 0,1 мл формалина, нейтрализованного по фенолфталеину
(слабо-розовое окрашивание), окраска Количественное определение
-
Формольное титрование -
Метод Кьельдаля -
Неводное титрование. Растворитель – ледяная уксусная кислота. Титрант 0,1 М раствор хлорной кислоты до перехода фиолетовой окраски в сине-зеленую (индикатор - кристаллический фиолетовый).
Хранение. В плотно укупоренной упаковке.
Применение:Как кровоостанавливающее средство.
