ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 85
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
+ 2H2SO4 + 6HOH→ 6 формальдегид + 2(NH4)2SO4
Затем к реакционной смеси добавляют NaOH ощущается запах аммиака
2(NH4)2SO4 + 4NaOH → 4NH3 + 2Na2SO4 + 4H2O
Не ФС
Примеси
В гексаметилентетрамине недопустимы примеси солей аммония и параформа, что возможно при нарушении условий хранения препарата. Обе примеси открывают реактивом Несслера (после добавления реактива не должно появляться ни желтого окрашивания, ни осадка). Для этого к раствору препарата добавляют реактив и нагревают на водяной бане. В присутствии солей аммония возникнет желтое окрашивание. Параформ при нагревании дает формальдегид, который с реактивом Несслера образует металлическую ртуть.
Количественное определение
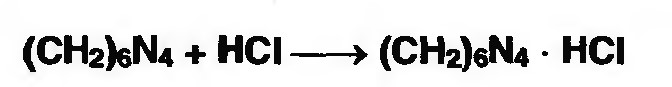
(CH2)6N4 + 2H2SO4 + 6HOH→ 6формальдегид + 2(NH4)2SO4 Навеску препарат нагревают с точно известным объемом серной кислоты. После охлаждения избыток серной кислоты оттитровывается NaOH индикатор метиловый красный.
Индикатор смешанный: метиловый оранжевый + метиловый синий (1:1)
(зеленая→ фиолетовая) Т = 0,0140 г/мл
Хранение
В хорошо укупоренной таре.
Особенности технологии 40% раствор гексаметилентетрамина для инъекций
Растворы уротропина при обычной температуре сравнительно устойчивы и обладают бактерицидным действием. При повышении же температуры происходит гидролиз гексаметилентетрамина с образованием формальдегида и аммиака, поэтому приготовление его 40% раствора проводят в асептических условиях (1 класс чистоты), без тепловой стерилизации. Лекарственное вещество должно быть сорта «для инъекций». На предприятиях используют стерилизующию фильтрацию с использованием мембранных фильтров. Применение
Препарат можно рассматривать как пролекарство.
Как дезинфицирующее средство внутрь и внутривенно. Его действие основано на образовании формальдегида в кислой среде, который и оказывает дезинфицирующее действие. Применяется при заболеваниях мочевых путей.
Лекция 6
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ УГЛЕВОДОВ И ПРОСТЫХ ЭФИРОВ
Глюкоза моногидрат (Декстроза) Glucosum
ФС 42-2419-86 В природе глюкоза широко встречается во фруктах и ягодах. Является необходимой составной частью крови человека. Норма в крови 5,5 ммоль.

C6H12O6 * H2O М.м. 198,17
Описание. Белый кристаллический порошок, без запаха, сладкого вкуса.
Медленно растворима в 1,5ч воды, мало растворима в 95% спирте.
Подлинность
По ФС. К раствору 0,2 г препарата в 5мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично – красный осадок.

Не ФС.
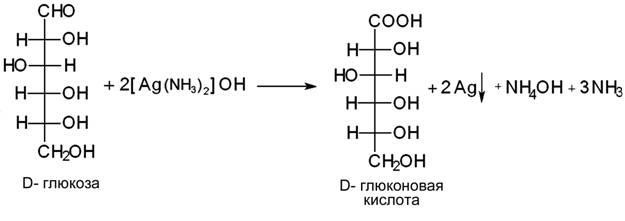
К раствору глюкозы добавляют аммиачный раствор нитрата серебра, при нагревании на стенках пробирки выделяется металлическое серебро
К раствору глюкозы приливают несколько капель раствора сульфата меди и гидроксида натрия. Образуется комплекс меди – василькового цвета.

Определение удельного вращения.
Глюкоза является оптически активным веществам, из-за наличия в молекуле четырех асимметрических атомов углерода.
В водном растворе в динамическом равновесии находятся линейная форма глюкозы и циклические.
Переход от ациклической формы к циклической
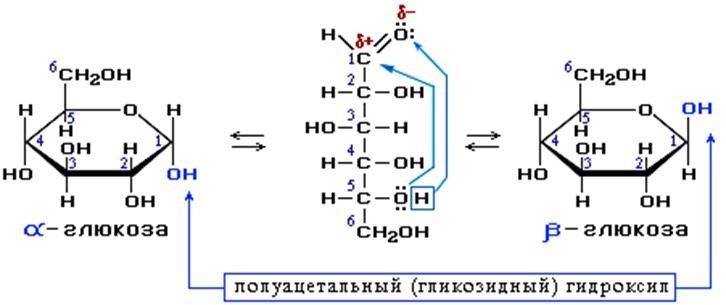
Для α-D-глюкозы величина угла вращения составляет +109,6 0, а для βD-глюкозы +20,5о. Согласно ФС удельное вращение 10% раствора глюкозы от +52,0 до +53,0°. Если определять угол вращения глюкозы сразу после ее растворения, то этот показатель составит +109,16
0С и конечного значения +52,30 достигнет только через несколько часов. Изменение во времени величины угла вращения называется мутаротацией. Для ускорения процесса муторатации к раствору добавляют несколько капель аммиака.
Количественное определение
Для субстанции глюкозы не предусмотрено.
В растворах для инъекций глюкозу определяют рефрактометрически.
Особенности изготовления растворов глюкозы:
В ГФ имеются 2 примечания, в которых сказано, что при изготовлении любых растворов глюкозы следует учитывать, что она содержит 10% кристаллизационной воды, поэтому необходимо сделать пересчет на безводную глюкозу.
При изготовлении растворов глюкозы для инъекций добавляют стабилизатор состоящий из хлороводородной кислоты и натрия хлорида.
Добавление NaCl создает в растворе условия, способствующие сдвигу в сторону образования более устойчивой к окислению циклической формы. Кислота хлористоводородная обеспечивает РН 3,0 – 4,0, в данном диапазоне замедляются процессы окисления глюкозы.
Применение
Димедрол (ФС 42-0232-07) (МНН - Дифенгидрамин)
(Dimedrolum)

CH3
N HCl
CH3
М.м. 291,82
N,N – диметил – 2 – (дифенилметокси)-этиламина гидрохлорид
Описание. Белый или почти белый кристаллический порошок. Растворимость: очень легко растворим в воде; легко в спирте и хлороформе, очень мало растворим в эфире.
Подлинность.
Сl-+Ag+ → AgCl↓
Количественное определение:
Титрование проводят в среде ледяной уксусной кислоты, для связывания
HCl добавляют ртути (II) ацетат. В качестве титранта используют хлорную кислоту. Индикатор кристаллический фиолетовый, титруют до желто-зеленой окраски раствора.
2HCl+ Hg(CH3COO)2 → HgCl2 + 2CH3COOH
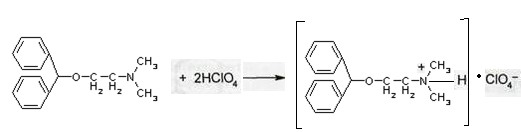
Уравнение: [димедрол]*HCl+NaOH → [димедрол основание]↓+ NaCl + HOH
Применение. Применяют при аллергических заболеваниях, особенно при поражении кожи и слизистых оболочек.
Лекция 7
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ
КАЛЬЦИЯ ГЛЮКОНАТ ФС.2.1.0019.15
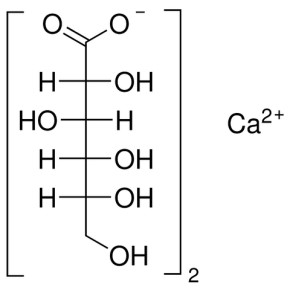
Описание. Белый или почти белый зернистый или кристаллический порошок без запаха. Легко растворим в кипящей воде, умеренно (медленно) растворим в воде, практически нерастворим в спирте 96 %.
1. Определение иона кальция
Соли кальция окрашивают пламя в красный цвет
С оксалатом аммония – образуется осадок белого цвета
2. Определение глюконат-иона. В нейтральных растворах при действии хлоридом железа (III) появляется светло-зеленое окрашивание

Комплексонометрия. Титрант – 0.05М раствор трилона Б, индикатор – кислотный хром темно-синий. Условие: аммиачный буфер.
Хранение
В хорошо укупоренной упаковке, в защищенном от света месте.
Кальция глюконат медленно растворим в 50 частях воды и растворим в 5 частях кипящей воды, таким образом, 10% раствор пересыщен. Растворение проводят при нагревании в течение 3 ч. Далее раствор охлаждают, фильтруют, разливают в ампулы и стерилизуют в автоклаве при температуре 110°С в течение 1 часа. При оценке качества инъекционных растворо учитывают, что при длительном кипячении раствор глюконата кальция часто карамелизуется (желтеет), а примеси оксалата кальция, во время растворения образуют комплексы с глюконатом кальция, которые при хранении раствора в ампулах, выпадают в осадок.
Применение:
Как кровоостанавливающее, при аллергических заболеваниях, при недостаточности паращитовидных желез, сопровождающейся тетанией, препарат обладает токомиметическим действием (т.е. повышает тонус и сократительную способность мышц матки).
Аскорбиновая кислота (витамин с)
HO OH
 O
O
CH2OH
М.м. 176,13
Аскорбиновая кислота, возможно, имеет генетическое родство с моносахаридами, что проявляется в сходстве структурных фрагментов молекул. Поэтому витамин С содержится в органах многих культурных и диких растений.
Получают аскорбиновую кислоту из сорбозы (диастереоизомер фруктозы). Путем окисления и некоторых других превращений. Второе название витамина С- аскорбиновая кислота – не совсем правильно, так как он по строению он представляет собой не кислоту, а лактон.

Описание: Белый кристаллический порошок кислого вкуса. Она легко растворима в спирте, воде, нерастворима в эфире, бензоле, хлороформе. Удельное вращение. От +20,5 до +21,5 º (10 % раствор).
Кислотные свойства
Аскорбиновая кислота не содержит свободной карбоксильной группы, но 5% раствор имеет рН от 2,1 до 2,6. Кислотный характер аскорбиновой кислоты обусловлен атомом водорода гидроксильной группы в положении 3. Второй гидроксил – кислотными свойствами не обладает. Енольный гидроксил взаимодействует с щелочами и гидрокарбонатом натрия.
Затем к реакционной смеси добавляют NaOH ощущается запах аммиака
2(NH4)2SO4 + 4NaOH → 4NH3 + 2Na2SO4 + 4H2O
Не ФС
-
на третичный атом азота – общеалкалоидные реактивы -
на формальдегид, после кислотного гидролиза (реакция с салициловой кислотой)
Примеси
В гексаметилентетрамине недопустимы примеси солей аммония и параформа, что возможно при нарушении условий хранения препарата. Обе примеси открывают реактивом Несслера (после добавления реактива не должно появляться ни желтого окрашивания, ни осадка). Для этого к раствору препарата добавляют реактив и нагревают на водяной бане. В присутствии солей аммония возникнет желтое окрашивание. Параформ при нагревании дает формальдегид, который с реактивом Несслера образует металлическую ртуть.
Количественное определение
-
Метод нейтрализации (Фармакопейный анализ)
(CH2)6N4 + 2H2SO4 + 6HOH→ 6формальдегид + 2(NH4)2SO4 Навеску препарат нагревают с точно известным объемом серной кислоты. После охлаждения избыток серной кислоты оттитровывается NaOH индикатор метиловый красный.
-
При экспресс-анализе используют ацидиметрию. Метенамин ввиду наличия в его молекуле четырех атомов азота имеет в водных растворах щелочную реакцию. Поэтому количественное определение можно также выполнить методом кислотно-основного титрования, без реакции гидролиза. Образуются малоустойчивые соли:
Индикатор смешанный: метиловый оранжевый + метиловый синий (1:1)
(зеленая→ фиолетовая) Т = 0,0140 г/мл
Хранение
В хорошо укупоренной таре.
Особенности технологии 40% раствор гексаметилентетрамина для инъекций
Растворы уротропина при обычной температуре сравнительно устойчивы и обладают бактерицидным действием. При повышении же температуры происходит гидролиз гексаметилентетрамина с образованием формальдегида и аммиака, поэтому приготовление его 40% раствора проводят в асептических условиях (1 класс чистоты), без тепловой стерилизации. Лекарственное вещество должно быть сорта «для инъекций». На предприятиях используют стерилизующию фильтрацию с использованием мембранных фильтров. Применение
Препарат можно рассматривать как пролекарство.
Как дезинфицирующее средство внутрь и внутривенно. Его действие основано на образовании формальдегида в кислой среде, который и оказывает дезинфицирующее действие. Применяется при заболеваниях мочевых путей.
Лекция 6
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ УГЛЕВОДОВ И ПРОСТЫХ ЭФИРОВ
Глюкоза моногидрат (Декстроза) Glucosum
ФС 42-2419-86 В природе глюкоза широко встречается во фруктах и ягодах. Является необходимой составной частью крови человека. Норма в крови 5,5 ммоль.

C6H12O6 * H2O М.м. 198,17
Описание. Белый кристаллический порошок, без запаха, сладкого вкуса.
Медленно растворима в 1,5ч воды, мало растворима в 95% спирте.
Подлинность
По ФС. К раствору 0,2 г препарата в 5мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично – красный осадок.

Не ФС.
-
Реакция серебряного зеркала
К раствору глюкозы добавляют аммиачный раствор нитрата серебра, при нагревании на стенках пробирки выделяется металлическое серебро

-
Реакция на многоатомные спирты
К раствору глюкозы приливают несколько капель раствора сульфата меди и гидроксида натрия. Образуется комплекс меди – василькового цвета.

-
Специфическая реакция (позволяет открывать глюкозу в присутствии других восстановителей) с тимолом после добавления концентрированной серной кислоты появляется темно-красное окрашивание
Определение удельного вращения.
Глюкоза является оптически активным веществам, из-за наличия в молекуле четырех асимметрических атомов углерода.
В водном растворе в динамическом равновесии находятся линейная форма глюкозы и циклические.
Переход от ациклической формы к циклической

Для α-D-глюкозы величина угла вращения составляет +109,6 0, а для βD-глюкозы +20,5о. Согласно ФС удельное вращение 10% раствора глюкозы от +52,0 до +53,0°. Если определять угол вращения глюкозы сразу после ее растворения, то этот показатель составит +109,16
0С и конечного значения +52,30 достигнет только через несколько часов. Изменение во времени величины угла вращения называется мутаротацией. Для ускорения процесса муторатации к раствору добавляют несколько капель аммиака.
Количественное определение
Для субстанции глюкозы не предусмотрено.
В растворах для инъекций глюкозу определяют рефрактометрически.
Особенности изготовления растворов глюкозы:
В ГФ имеются 2 примечания, в которых сказано, что при изготовлении любых растворов глюкозы следует учитывать, что она содержит 10% кристаллизационной воды, поэтому необходимо сделать пересчет на безводную глюкозу.
При изготовлении растворов глюкозы для инъекций добавляют стабилизатор состоящий из хлороводородной кислоты и натрия хлорида.
Добавление NaCl создает в растворе условия, способствующие сдвигу в сторону образования более устойчивой к окислению циклической формы. Кислота хлористоводородная обеспечивает РН 3,0 – 4,0, в данном диапазоне замедляются процессы окисления глюкозы.
Применение
-
Изотонические растворы (5%) глюкозы применяют для пополнения организма жидкостью и как источник питательного материала, при катаболизме которого выделяется энергия. -
Гипертонические растворы повышают осмотическое давление крови, поэтому жидкость начинает поступать в кровь в результате расширяются сосуды, улучшается детоксикационная функция печени, работа сердца, увеличивается диурез. -
Широко применяют при гипогликемии, инфекционных заболеваниях, болезнях печени, при шоке и коллапсе.
Димедрол (ФС 42-0232-07) (МНН - Дифенгидрамин)
(Dimedrolum)

CH3
N HCl
CH3
М.м. 291,82
N,N – диметил – 2 – (дифенилметокси)-этиламина гидрохлорид
Описание. Белый или почти белый кристаллический порошок. Растворимость: очень легко растворим в воде; легко в спирте и хлороформе, очень мало растворим в эфире.
Подлинность.
-
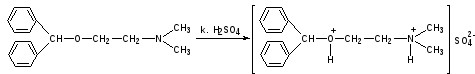
Образование оксониевых солей. На часовое стекло наносят серную кислоту концентрированную и прибавляют субстанцию; появляется яркожелтое окрашивание, постепенно переходящее в кирпично-красное. При прибавлении нескольких капель воды окраска исчезает (соли гидролизуются при добавлении воды).

-
На хлорид-ион с нитратом серебра.
Сl-+Ag+ → AgCl↓
Количественное определение:
-
По ФС – Метод неводного титрования
Титрование проводят в среде ледяной уксусной кислоты, для связывания
HCl добавляют ртути (II) ацетат. В качестве титранта используют хлорную кислоту. Индикатор кристаллический фиолетовый, титруют до желто-зеленой окраски раствора.
2HCl+ Hg(CH3COO)2 → HgCl2 + 2CH3COOH

-
Экспресс-анализ. Прямая алкалиметрия в водной среде по связанной HCl с добавлением хлороформа - органического растворителя. Титрантом является ги дроксид натрия. Индикатор фенолфталеин. Добавление органического растворителя необходимо для растворения образующегося основания димедрола. Если растворитель не добавить, то выделяющееся основание в водном растворе будет образовывать суспензию белого цвета.
Уравнение: [димедрол]*HCl+NaOH → [димедрол основание]↓+ NaCl + HOH
-
Аргентометрия – метод Фаянса. Индикатор бромтимоловый синий. Хранение. В защищенном от света месте.
Применение. Применяют при аллергических заболеваниях, особенно при поражении кожи и слизистых оболочек.
Лекция 7
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ
КАЛЬЦИЯ ГЛЮКОНАТ ФС.2.1.0019.15
Calcii gluconas

Описание. Белый или почти белый зернистый или кристаллический порошок без запаха. Легко растворим в кипящей воде, умеренно (медленно) растворим в воде, практически нерастворим в спирте 96 %.
Подлинность
1. Определение иона кальция
Соли кальция окрашивают пламя в красный цвет
С оксалатом аммония – образуется осадок белого цвета
CaСl2 + (NH4) 2C2O4 →СаС2O4↓ + 2NH4Cl
2. Определение глюконат-иона. В нейтральных растворах при действии хлоридом железа (III) появляется светло-зеленое окрашивание

Количественное определение
Комплексонометрия. Титрант – 0.05М раствор трилона Б, индикатор – кислотный хром темно-синий. Условие: аммиачный буфер.
Хранение
В хорошо укупоренной упаковке, в защищенном от света месте.
Особенности изготовления лекарственных форм
Кальция глюконат медленно растворим в 50 частях воды и растворим в 5 частях кипящей воды, таким образом, 10% раствор пересыщен. Растворение проводят при нагревании в течение 3 ч. Далее раствор охлаждают, фильтруют, разливают в ампулы и стерилизуют в автоклаве при температуре 110°С в течение 1 часа. При оценке качества инъекционных растворо учитывают, что при длительном кипячении раствор глюконата кальция часто карамелизуется (желтеет), а примеси оксалата кальция, во время растворения образуют комплексы с глюконатом кальция, которые при хранении раствора в ампулах, выпадают в осадок.
Применение:
Как кровоостанавливающее, при аллергических заболеваниях, при недостаточности паращитовидных желез, сопровождающейся тетанией, препарат обладает токомиметическим действием (т.е. повышает тонус и сократительную способность мышц матки).
Аскорбиновая кислота (витамин с)
Acidum ascorbinicum γ-лактон 2,3-дегидро-L-гулоновой кислоты
HO OH
 O
OCH2OH
М.м. 176,13
Аскорбиновая кислота, возможно, имеет генетическое родство с моносахаридами, что проявляется в сходстве структурных фрагментов молекул. Поэтому витамин С содержится в органах многих культурных и диких растений.
1. Получение
Получают аскорбиновую кислоту из сорбозы (диастереоизомер фруктозы). Путем окисления и некоторых других превращений. Второе название витамина С- аскорбиновая кислота – не совсем правильно, так как он по строению он представляет собой не кислоту, а лактон.

Описание: Белый кристаллический порошок кислого вкуса. Она легко растворима в спирте, воде, нерастворима в эфире, бензоле, хлороформе. Удельное вращение. От +20,5 до +21,5 º (10 % раствор).
Подлинность
Кислотные свойства
Аскорбиновая кислота не содержит свободной карбоксильной группы, но 5% раствор имеет рН от 2,1 до 2,6. Кислотный характер аскорбиновой кислоты обусловлен атомом водорода гидроксильной группы в положении 3. Второй гидроксил – кислотными свойствами не обладает. Енольный гидроксил взаимодействует с щелочами и гидрокарбонатом натрия.

