Файл: 1. Одноатомный (простой) ион это заряженная атомная частица.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 20.03.2024
Просмотров: 24
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
92. Понятие «валентность» применимо к _ ковалентной _______ связи.
93. _ Водородная _______ связь – связь, образуемая атомами водорода, уже ковалентно связанными с атомами элементов с высокой электроотрицательностью (F, O, N, реже Cl, S), с другими атомами этой же группы элементов.
94. Энергия связи уменьшается в ряду ковалентная связь – ионная связь – металлическая связь.
95. Для оценки типа связи в бинарных соединениях используют критерий Полинга.
96. Водород образует наименее полярную химическую связь с
97. При _
98. Число образующихся гибридных атомных орбиталей _ всегда равно числу ______________ исходных атомных орбиталей.
99. В молекуле _
100. Второму возбужденному состоянию атома хлора Cl** отвечает электронная формула
101. Раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических явлений, называется химической термодинамикой.
102. Предметом химической термодинамики служит термодинамическое рассмотрение явлений, относящихся к области химии.
103. Системы, в которых имеет место обмен с окружающей средой энергией и веществом, называются открытыми.
104. Системы, в которых исключен обмен с окружающей средой и энергией, и веществом, называются изолированными.
105. Системы, состоящие из одной фазы, т. е. системы, внутри которых нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам, называются гомогенными.
106. Совокупность однородных частей системы, одинаковых во всех точках по физическим, химическим и термодинамическим свойствам и отделенных от других фаз границей раздела, называется фазой.
107. Параметры, зависящие от количества вещества в системе, называются экстенсивными параметрами.
108. Параметры, которые зависят только от свойств самой системы, т. е. определяются совокупным движением частиц системы и их взаимным расположением, называются внутренними параметрами (параметрами состояния).
109. Функции, которые зависят только от состояния системы и не зависят от пути, по которому это состояние получено, называются функциями состояния.
110. Функции, значение которых зависит от пути, по которому происходит изменение состояния системы, называются функциями процесса.
111. Тело или совокупность тел, находящихся во взаимодействии, отделенных от окружающей среды реальной или воображаемой оболочкой (границей), называется системой.
112. Системы, в которых имеет место обмен с окружающей средой только энергией, называются закрытыми.
113. Системы, состоящие, по крайней мере, из двух фаз и имеющие поверхность раздела между фазами, называются гетерогенными.
114. Параметры, которые не зависят от количества вещества в системе, называются интенсивными параметрами.
115. Молекулярно-микроскопический способ передачи энергии называется теплотой.
116. Процессы, которые совершаются в системе без «вмешательства извне», называются самопроизвольными процессами.
117. Теплота, выделяющаяся или поглощающаяся в результате химической реакции, называется тепловым эффектом реакции, если отсутствует любая работа, кроме работы против внешних сил, неизменно давление или объем системы, постоянна температура до и после реакции.
118. Общий запас энергии системы за вычетом кинетической энергии системы в целом и ее потенциальной энергии положения называется внутренней энергией системы.
119. Утверждение о том, что для двух практически важных процессов теплота процесса приобретает свойства функции состояния, является формулировкой закона Гесса.
120. Необходимым условием осуществления самопроизвольного процесса в изобарно-изотермических условиях в неизолированной системе является уменьшение энергии Гиббса.
121. Закрытые системы без теплообмена называются _ адиабатически изолированными ___________ системами.
122. Независимые переменные, зафиксированные условиями существования системы, называются_ термодинамическими ______ параметрами.
123. Параметры состояния окружающей среды по отношению к исследуемой системе называются _ внешними ________ параметрами.
124. Уравнение _ Клапейрона – Менделеева __________ является уравнением состояния идеального газа.
125. Особенностью описания _ термодинамических __________ процессов является их характеристика не скоростями изменения свойств, а величинами изменений.
126. Одной из формулировок _ первого ________ начала термодинамики является утверждение о том, что теплота, сообщаемая системе, идет на приращение внутренней энергии и на работу, совершаемую системой.
127. Функцией _ давления и температуры ___________ является энтальпия
128. При изобарном процессе тепловой эффект реакции – это изменение _ энтальпии ______ в ходе реакции.
129. _ Второе __________ начало термодинамики указывает на невозможность создания вечного двигателя второго рода.
130. _ Энтропия _______ – термодинамический параметр, который для веществ всегда больше нуля.
131. Изменение функции состояния ΔΦ при переходе из состояния 1 в состояние 2 определяется выражением
132. Уравнение состояния идеального газа, отнесенное к 1 моль вещества, отвечает выражению
133. На основании первого следствия из закона Гесса для реакции, уравнение которой в общем виде
тепловой эффект реакции при температуре T отвечает выражению

134. Необходимым условием осуществления данного процесса (реакции) в изолированной системе является
135. Критерием равновесного и самопроизвольного процессов в изобарно-изотермических условиях в неизолированной системе является
136. Изменение энергии Гиббса отвечает выражению
137. Для реакции, уравнение которой в общем виде
изменение энергии Гиббса при температуре T как функции состояния можно рассчитать по выражению
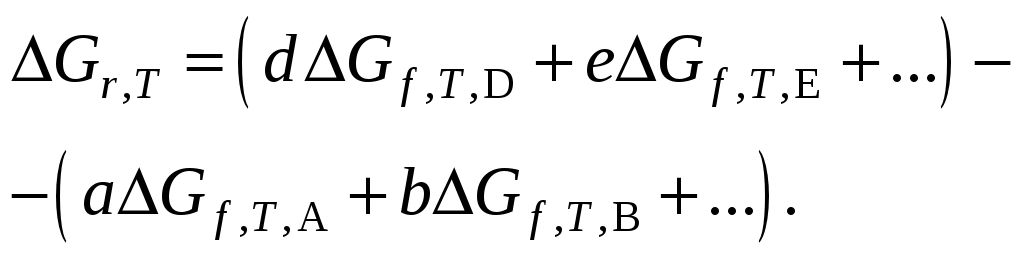
138. Реакция, протекающая в изобарных условиях, является эндотермической, если
139. При получении 22,4 л аммиака (н.у.) по реакции, термодинамическое уравнение которой
140. Теплота образования H2S(г) при н.у. равна – 21 кДж / моль. При взаимодействии (н.у.) 16 г серы и 11,2 л водорода выделяется _10,5_____ кДж теплоты.
141. Учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции, называется химической кинетикой.
142. Реакции, включающие несколько стадий, являющихся простыми или элементарными, называются сложными.
143. В результате промежуточных элементарных стадий образуются промежуточные продукты.
144. Скорость гомогенной химической реакции, идущей при постоянном объеме, по одному из компонентов – это изменение концентрации этого компонента в единицу времени.
145. Кривые, характеризующие изменение концентрации реактантов (или связанного с ними свойства системы) во времени в результате протекания химической реакции (ее элементарной стадии для сложных реакций), называются кинетическими кривыми.
146. Скорость реакции совпадает с ее скоростью по одному из компонентов, если его стехиометрический коэффициент равен единице.
147. Если экспериментально установлено, что химическая реакция, схематически представленная как
простая, то
148. Величина константы скорости реакции численно равна скорости реакции при концентрациях всех реагентов, равных единице.
149. Константа скорости реакции зависит только от температуры и природы реактантов.
150. Утверждение о том, что кинетические уравнения в алгебраической форме показывают, что скорость реакции в каждый момент времени пропорциональна произведению наличных, возведенных в некоторые степени, концентраций реагентов, является основным законом кинетики
151. Необходимым условием протекания любой химической реакции является реакционная способность реагентов.
152. Запас энергии, необходимый для преодоления потенциального (энергетического) барьера, разделяющего реагенты и продукты, называется энергией активации.
153. Количество вещества, прореагировавшего в единицу времени в единице реакционного пространства, называется скоростью химической реакции.
154. Молекулярность и порядок реакции совпадают только для простых реакций, протекающих в одну элементарную стадию без участия посторонних формульных единиц.
155. Утверждение о том, что скорость реакции пропорциональна общему давлению, взятому в степени, равной порядку реакции, является формулировкой закона общего давления.
156. Если экспериментально не установлено, что химическая реакция, схематически представленная как
простая, то
157. Энергии активации реакции при каталитическом (Ea,к), некаталитическом (Ea) процессах и при ингибировании (Ea,инг) изменяются в ряду
158. Температурный коэффициент скорости реакции отвечает выражению
159. Правило Вант-Гоффа отвечает выражению
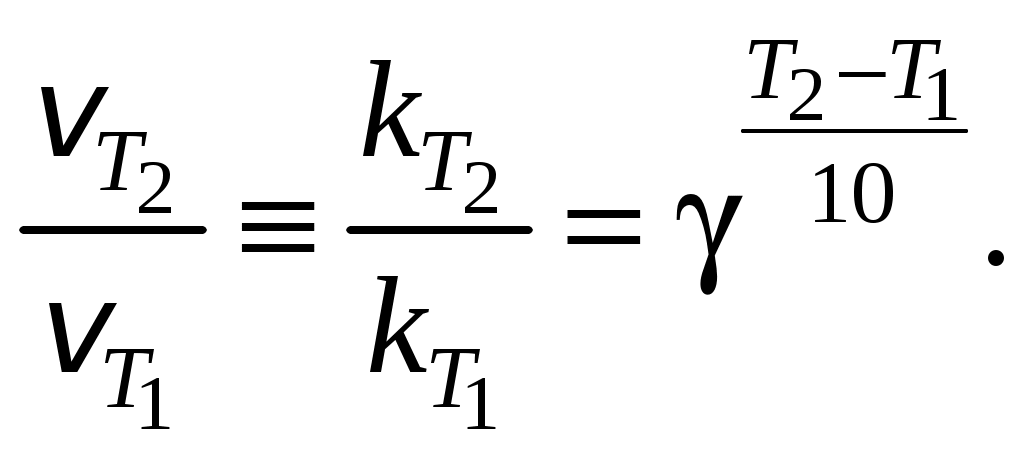
160. Уравнение Аррениуса в экспоненциальной форме имеет вид
161. При изменении общего давления в 4 раза скорость реакции второго порядка, в которой имеются газообразные реагенты изменится в 16 раз.
162. Для понижения скорости реакции, температурный коэффициент скорости которой равен 3, в 27 раз температуру надо понизить на 30 градусов.
163. Скорость прямой реакции в системе
увеличивается в 4 раза при двукратном увеличении концентрации оксида азота(II) или при четырехкратном увеличении концентрации водорода. Общий порядок реакции равен 3.
164. Скорость реакции возросла в 16 раз при повышении температуры на 40 градусов. Температурный коэффициент скорости реакции равен 2.
165. Скорость прямой реакции в системе
увеличивается в 4 раза при четырехкратном увеличении концентрации водорода. Общий порядок реакции равен 1.
166. Неизменностью состояния системы при сохранении внешних условий характеризуется состояние истинного равновесия.
167. Подвижностью равновесия характеризуется состояние истинного равновесия.
168. Динамическим характером равновесия характеризуется состояние истинного равновесия.
169. Различием в достижении равновесного состояния характеризуется состояние истинного равновесия.
170. _____________Равновесные молярные концентрации – это молярные концентрации участников реакции при равновесии.

