Файл: 1. Одноатомный (простой) ион это заряженная атомная частица.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 20.03.2024
Просмотров: 23
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
171. ._____________Равновесные парциальные давления – это парциальные давления газообразных участников реакции при равновесии.
172. Для гомогенных реакций в растворе в выражение для константы равновесия не входят равновесные концентрации растворителя.
173. Для гетерогенных реакций в выражение для константы равновесия не входят концентрации твердых и жидких веществ.
174. Утверждение о том, что отношение произведения равновесных молярных концентраций (парциальных давлений) продуктов в степенях, равных стехиометрическим коэффициентам, к произведению равновесных молярных концентраций (парциальных давлений) реагентов в степенях, равных стеиометрическим коэффициентам, есть величина постоянная при данной температуре, является формулировкой закона действующих масс.
175. Переход из одного состояния равновесия в другое – это сдвиг химического равновесия.
176. Экстремальными значениями энтропии (для изолированных систем) и энергии Гиббса (для неизолированных систем при изобарно-изотермических процессах) характеризуется состояние истинного равновесия
177. Используемые для идеальных систем значения Kc и Kpзависят только от природы реактантов и температуры
178. Константа равновесия обратной реакции есть величина, обратная константе равновесия прямой реакции.
179. Для перевода системы из одного состояния равновесия в другое необходимо изменить извне температуру.
180. Утверждение о том, что если на равновесную систему воздействовать извне изменением какого-либо внешнего параметра равновесия, то равновесие смещается в том направлении, которое способствует восстановлению первоначального положения, является формулировкой принципа Ле Шателье – Брауна.
181. _ Обратимые реакции ___________ – это реакции, протекающие в прямом и обратном направлениях.
182. Равновесные количества веществ _____________ – это не изменяющиеся во времени количества веществ всех участников реакции при равновесии.
183. Константа равновесия ______________ – это постоянная при данной температуре для данной реакции величина, связывающая между собой равновесные концентрации (парциальные давления) участников реакции.
184. Значение _ константы равновесия ___________________ характеризует степень превращения реагентов в продукты.
185. _Одинаковы_______ значения констант равновесия (Kc и Kp) для всех положений одного состояния.
186. Выражение для Kp обратимой реакции, уравнение которой
имеет вид

187. В обратимой реакции, уравнение которой
и прямая реакция эндотермическая, равновесие вправо можно сместить путем повышения температуры извне.
188. Равновесие вправо путем понижения общего давления за счет уменьшения объема системы можно сместить в равновесной системе, полученной в результате реакции, уравнение которой
189. При выражении равновесных молярных концентраций реактантов в моль/л Kc измеряется в
190. При выражении равновесных парциальных давлений реактантов в атм Kp измеряется в
191. Размеры частиц в истинных растворах меньше 10–7 см.
192. В истинных растворах частицы растворенного вещества не могут быть обнаружены оптическим путем.
193. Высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии, называются коллоидными растворами.
194. Гомогенная система, содержащая не менее двух частей, называется раствором.
195. Все составные части раствора за исключением растворителя называются растворенным веществом.
196. Раствор, в котором растворенного вещества мало, называется разбавленным раствором.
197. Раствор, в котором растворенного вещества много, называется концентрированным раствором.
198. Раствор, в котором при данной температуре еще можно растворить некоторое количество данного вещества, называется ненасыщенным раствором.
199. Содержание растворенного вещества в насыщенном растворе – это количественная характеристика способности вещества раствориться в данном гителе.
200. Степень электролитической диссоциации вещества, растворенного в данном растворителе, зависит (при постоянных температуре и давлении) от природы этого вещества и от его концентрации.
201. Гомогенные системы, в которых растворенное вещество диспергировано до атомного или молекулярного уровня, называются истинными растворами.
202. Составная часть раствора, которой больше, чем остальных, и агрегатное состояние которой совпадает с агрегатным состоянием раствора, называется растворителем.
203. Раствор, в котором данное вещество при данной температуре больше не растворяется, называется насыщенным раствором.
204. Масса растворенного вещества в граммах, которая насыщает 100 г растворителя при данной температуре, называется массовым коэффициентом растворимости
205. Для количественного описания свойств растворов в качестве основного параметра используют концентрацию.
206. Вещества, которые при растворении распадаются на ионы в растворе, а также молекулярные ионы, которые в растворе распадаются с образованием других ионов, называются электролитами.
207. Для разбавленных водных растворов характер диссоциации зависит только от природы электролита
208. Электролиты, диссоциирующие обратимо, являются слабыми электролитами
209. Доля формульных единиц, распавшихся в состоянии равновесия на ионы, называется степенью электролитической диссоциации.
210. Закон, характеризующий зависимость степени диссоциации от концентрации (разведения) электролита и устанавливающий связь между константой диссоциации и степенью электролитической диссоциации, называется законом разведения Оствальда.
211. При добавлении к слабой кислоте HAn сильной кислоты равновесие смещается влево, и степень электролитической диссоциации уменьшается.
212. Свойства растворов, которые зависят только от концентрации, но не от природы растворенного вещества, называются коллигативными.
213. Утверждение о том, что относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества и не зависит от его природы – это одна из формулировок первого закона Рауля.
214. Утверждение о том, что осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества и температуре – это формулировка закона Вант-Гоффа
215. Отношение числа частиц (формульных единиц) в растворе к числу растворенных формульных единиц электролита называется изотоническим коэффициентом Вант-Гоффа.
216. Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода.
217. В насыщенном растворе труднорастворимого сильного электролита произведение концентраций его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости
218. Произведение неравновесных (текущих) молярных концентраций тех ионов, которые образуются при необратимой диссоциации сильного мало- или нерастворимого электролита, взятых в степенях, равных стехиометрическим индексам при формулах ионов в формуле электролита, называется ионным произведением.
219. Реакция обменного разложения соли водой (реакция, обратная реакции нейтрализации) называется гидролизом
220. В реакцию гидролиза вступают только соли, образованные хотя бы одним слабым электролитом.
221. Способность данной соли подвергаться гидролизу характеризует значение константы гидролиза.
222. Доля вещества, подвергшегося гидролизу, называется степенью гидролиза.
223. При гидролизе соли слабой кислоты и сильного основания имеет место обратимый гидролиз по аниону
224. При гидролизе соли слабого основания и сильной кислоты имеет место как обратимый, так и необратимый гидролиз по катиону.
225. При гидролизе соли слабого основания и слабой кислоты имеет место как обратимый, так и необратимый гидролиз по обоим ионам.
226. При гидролизе соли слабой кислоты и сильного основания происходит образование щелочи и либо кислоты, либо кислой соли.
227. При обратимом гидролизе соли слабого основания и сильной кислоты происходит образование кислоты и либо слабого основания (или амфолита), либо оснóвной соли.
228. При необратимом гидролизе соли слабого основания и сильной кислоты происходит образование кислоты и слабого основания (или амфолита).
229. При необратимом гидролизе соли слабого основания и слабой кислоты происходит образование кислоты и слабого основания (или амфолита).
230. При обратимом гидролизе соли слабого основания и слабой кислоты происходит образование кислоты или кислой соли и основания или оснóвной соли.
231. Уравнение
является математическим выражением первого закона Рауля для неэлектролитов
232. Уравнение
является математическим выражением закона Вант-Гоффа для электролитов
233. При температуре 25 °C pH + pOH равно 14
234. Диапазоном изменения значений pH при 25 °C является
235. Выражение
является формулой для расчета равновесной концентрации ионов водорода в сильной кислоте HAn.
236. Выражение
является формулой для расчета равновесной концентрации ионов водорода в сильной кислоте H2An
237. Выражение
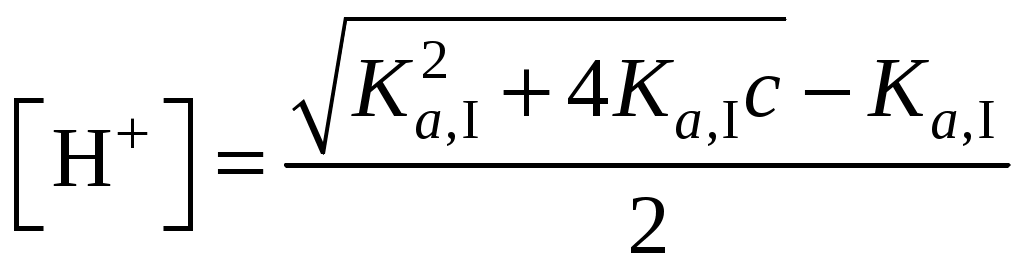
является формулой для расчета равновесной концентрации ионов водорода в слабой кислоте HyAn при c/Ka,I ≤ 100
238. Выражение
является формулой для расчета равновесной концентрации ионов водорода в слабой кислоте HyAn при c/Ka,I > 100.
239. Выражение
является формулой для расчета равновесной концентрации ионов водорода в сильной кислоте с учетом диссоциации воды.
240. Выражение
является формулой для расчета равновесной концентрации ионов водорода в слабой кислоте с учетом диссоциации воды.
241. Для растворимых веществ массовый коэффициент растворимости не менее 1 г / 100 г H2O.
242. Для нерастворимых веществ массовый коэффициент растворимости не более 0,1 г / 100 г H2O.
243. Для малорастворимых (труднорастворимых) веществ массовый коэффициент растворимости меньше 1 г / 100 г H2O, но больше 0,1 г / 100 г H2O.
244. Произведению растворимости труднорастворимого сильного электролита KtxAny отвечает выражение
245. Для насыщенного раствора сильного электролита KtxAny растворимость отвечает выражению
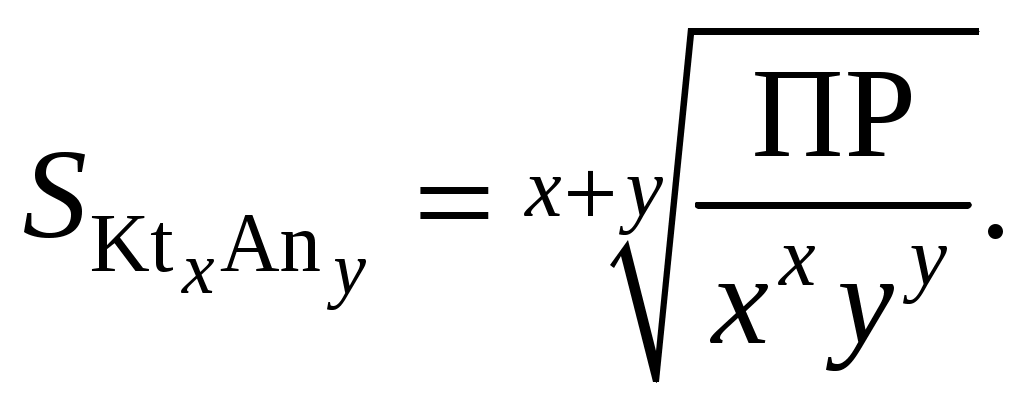
246. Константа гидролиза одноосновной кислоты отвечает выражению
247. Константа гидролиза многоосновной кислоты отвечает выражению _Kh = KW/Ka,y __________, где K

