Файл: 1. Одноатомный (простой) ион это заряженная атомная частица.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 20.03.2024
Просмотров: 25
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
a,y – константа последней ступени диссоциации кислоты.
248. Константа гидролиза однокислотного основания отвечает выражению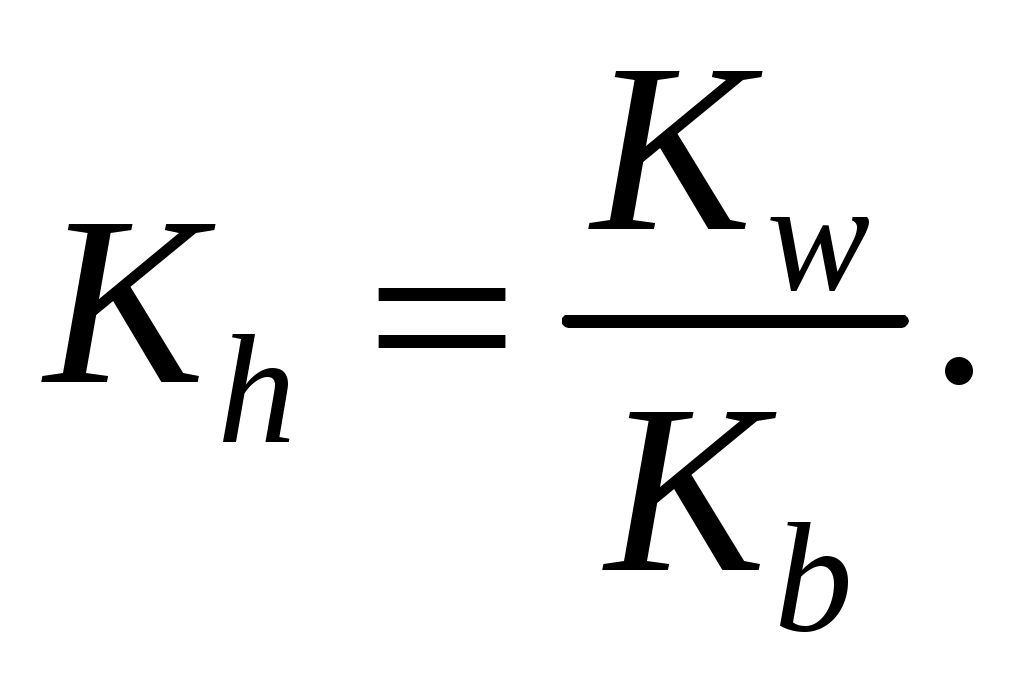
249. Константа гидролиза многокислотного основания отвечает выражению _
Kh = KW/Kb,x ___________, где Kb,x – константа последней ступени диссоциации основания.
250. При обратимом гидролизе только по одному сорту ионов степень гидролиза отвечает выражению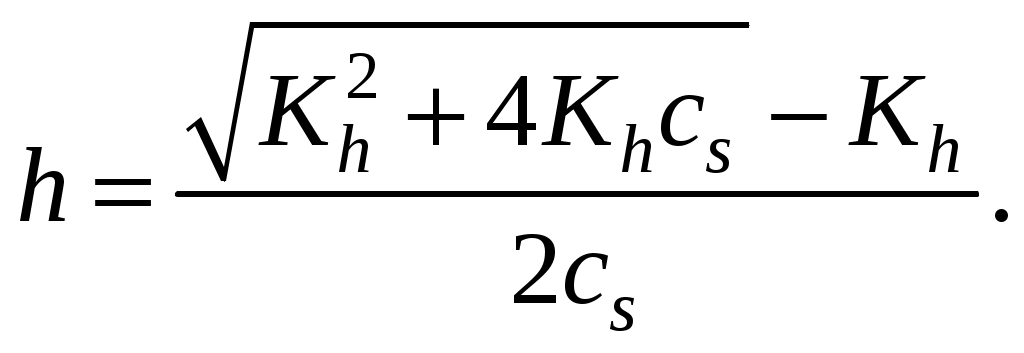
251. Степень окисления, существование ниже которой для атомной частицы элемента невозможно, называется низшей степенью окисления.
252. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в низшей степени окисления, за счет них могут быть только восстановителями.
253. Степень окисления, существование выше которой для атомной частицы элемента невозможно, называется высшей степенью окисления
254. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в высшей степени окисления, за счет них могут быть только окислителями.
255. Степень окисления атомной частицы элемента, которая больше низшей степени окисления, но меньше высшей степени окисления, называется промежуточной степенью окисления.
256. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в промежуточной степени окисления, за счет этого элемента могут быть как восстановителями, так и окислителями, т. е. проявляют окислительно-восстановительную двойственность.
257. Окислительно-восстановительная реакция – это -_______единая реакция, которая может быть условно разбита на две полуреакции: окисление и восстановление.
258. Вещества, между которыми происходит процесс окисления-восстановления, называются окислитель и восстановитель.
259. На том, что общее число электронов, принимаемых окислителем и отдаваемых восстановителем в одной и той же окислительно-восстановительной реакции, должно быть одинаковым основан метод электронного баланса.
260. В ходе окислительно-воостановительной реакции окислитель восстанавливается восстановителем.
261. Химические реакции, в ходе которых происходит изменение степеней окисления атомных частиц элементов, называются окислительно-восстановительными реакциями.
262. Окисление – это полуреакция, при которой степень окисления атомной частицы элемента повышается вследствие отдачи электронов.
263. Восстановление – это полуреакция, при которой степень окисления атомной частицы элемента понижается вследствие присоединения электронов.
264. Окислитель – это реагент, содержащий атомную частицу элемента, понижающую степень окисления путем присоединения электронов.
265. Восстановитель – это реагент, содержащий атомную частицу элемента, повышающую степень окисления путем отдачи электронов.
266. Межмолекулярные окислительно-восстановительные реакции __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители являются атомами различных элементов и входят в состав разных веществ.
267. Внутримолекулярные окислительно-восстановительные реакции __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители входят в состав одного вещества, но являются атомами различных элементов.
268. Реакции диспропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители являются атомами одного и того же элемента, находящимися в одинаковой степени окисления, и входят в состав данного вещества.
269. Межмолекулярные реакции конпропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы одного элемента в разных степенях окисления (окислители и восстановители) входят в состав разных веществ.
270. Внутримолекулярные реакции конпропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы одного элемента в разных степенях окисления (окислители и восстановители) входят в состав одного вещества.
271. Процесс окисления – это
272. Процесс восстановления – это
273. Окислительно-восстановительной является реакция, уравнение которой
274. Веществом, которое за счет атомной частицы элемента Cr может быть только восстановителем, является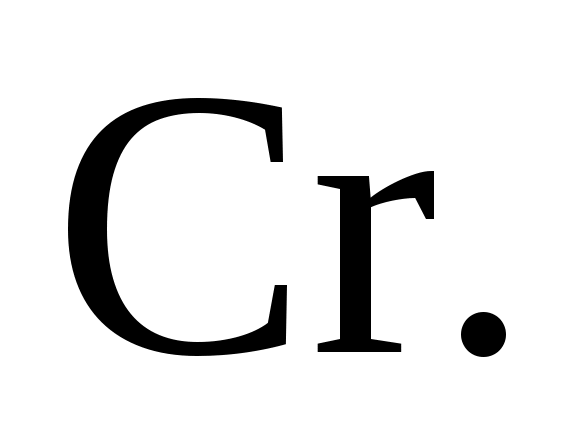
275. Химическим соединением, которое за счет атомной частицы элемента Mn может быть только окислителем, является
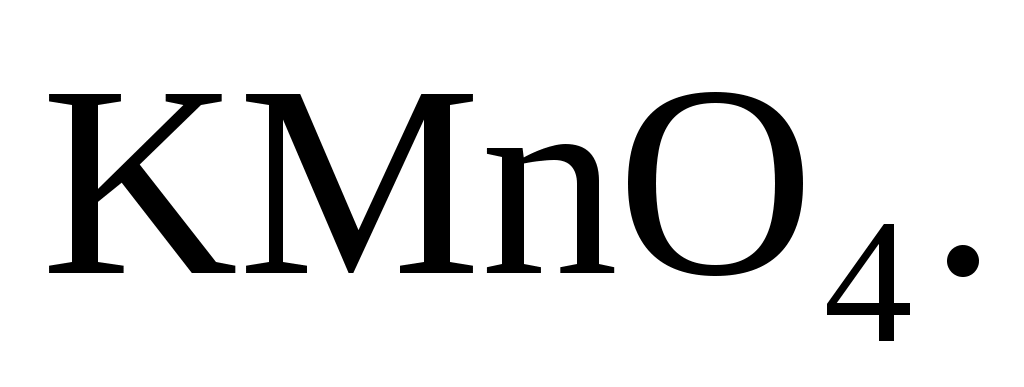
276. Один из разделов физической химии, который занимается изучением закономерностей, связанных с взаимным превращением химической и электрической форм энергии, называется электрохимией.
277. Реакции, протекающие за счет подведенной извне электрической энергии, или же, наоборот, служащие источником ее получения, называются электрохимическими.
278. Электрохимические реакции совершаются на границе раздела фаз и связаны с переносом через нее электрических зарядов в виде расчлененных актов окисления и восстановления.
279. Предмет электрохимии составляет изучение электрохимических систем.
280. Все электрохимические системы состоят из трех частей.
281. Отрицательный электрод или отрицательный полюс элемента –этоэлектрод, посылающий электроны во внешнюю цепь.
282. Положительный электрод или положительный полюс элемента – это электрод, принимающий электроны из внешней цепи.
283. Электрод, принимающий электроны от участников реакции, называется анодом.
284. Электрод, отдающий электроны участникам реакции, называется катодом.
285. Количество энергии, необходимое для вывода электрона из вещества, называется работой выхода электрона.
286. Гетерогенная система, состоящая из проводников первого и второго рода, в которой происходит перераспределение заряда на границе раздела фаз или перемещение заряженной частицы через эту границу, а также перетекание свободных зарядов из одной фазы в другую, называется . электродом.
287. Электродные потенциалы определяют по уравнению Нернста.
288. Напряжение на гальваническом элементе, соответствующее бесконечно малому току во внешней цепи, называется ЭДС гальванического элемента
289. Самопроизвольное разрушение металлов и сплавов под действием окружающей среды называется коррозией
290. Совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании электрического тока (обычно постоянного) через расплав или раствор электролита, называется электролизом
291. Металл, погруженный в раствор, содержащий катионы этого металла, называется_ ионно-металлическим ______ электродом.
292. Потенциал водородного ________ электрода принимается равным нулю.
293. Химическая коррозия ____________ – это коррозия, протекающая в атмосфере агрессивных газов, не содержащих влаги, а также в присутствии неэлектролитов, обусловленная химической реакцией между металлом и коррозионной средой.
294. _Химический источник тока _________ – это электрохимическая система, производящая электрическую энергию за счет протекающих в ней химических превращений.
295. Электролизер ___________ – это электрохимическая система, в которой за счет электрической энергии совершаются химические превращения.
296. Уравнение Нернста для ионно-металлических электродов при температуре 298 K отвечает выражению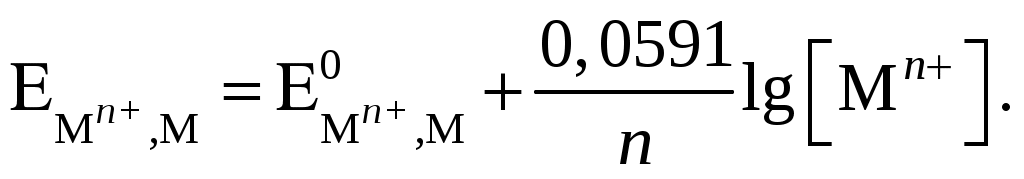
297. При коррозии железа оно анодно окисляется до Fe2+.
298. При работе гальванического элемента, схема которого
 ,
,
на катоде протекает реакция, уравнение которой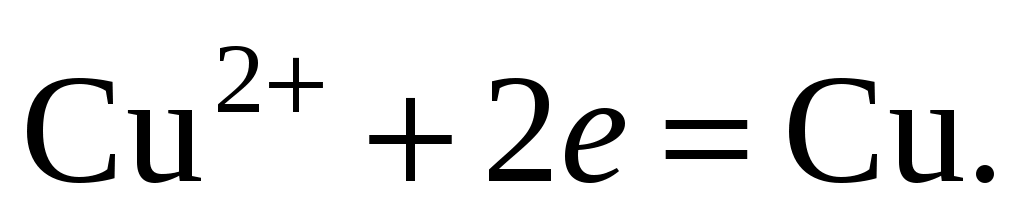
299. На инертном аноде при электролизе водного раствора хлорида меди(II) протекает реакция, уравнение которой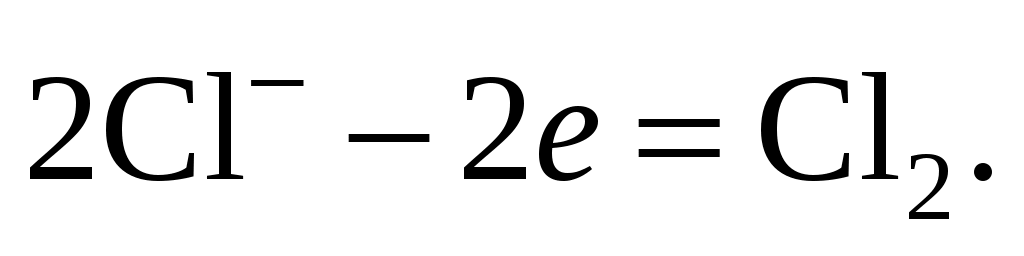
300. Уравнение объединенного закона Фарадея для массы образовавшегося при электролизе вещества имеет вид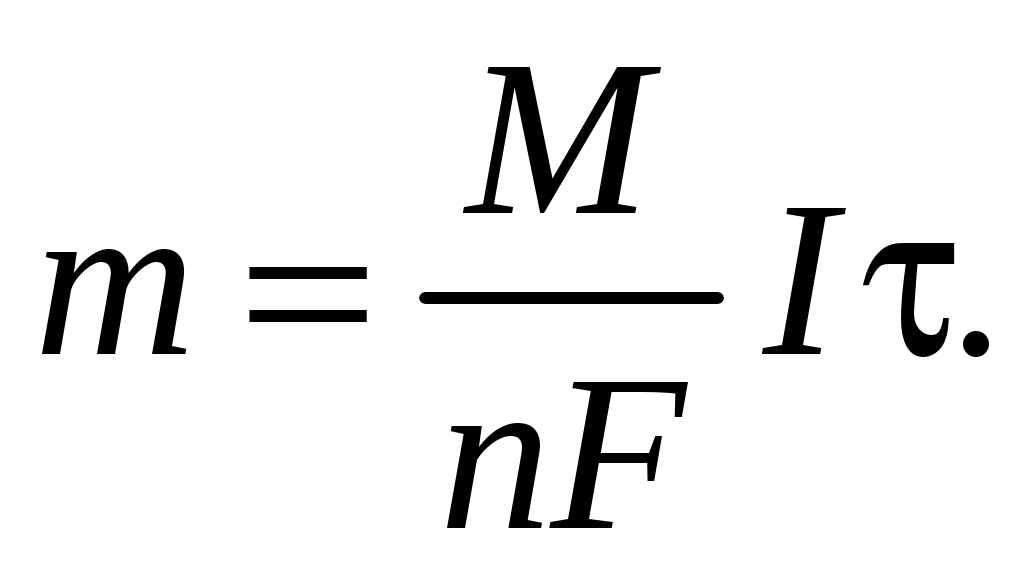
248. Константа гидролиза однокислотного основания отвечает выражению
249. Константа гидролиза многокислотного основания отвечает выражению _
Kh = KW/Kb,x ___________, где Kb,x – константа последней ступени диссоциации основания.
250. При обратимом гидролизе только по одному сорту ионов степень гидролиза отвечает выражению
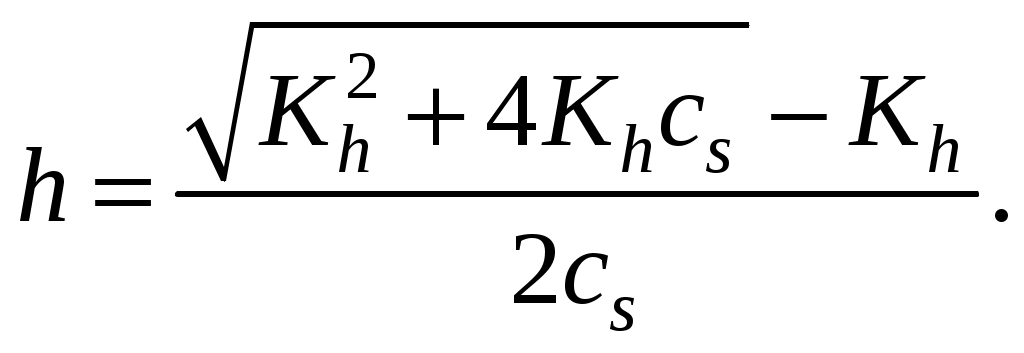
251. Степень окисления, существование ниже которой для атомной частицы элемента невозможно, называется низшей степенью окисления.
252. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в низшей степени окисления, за счет них могут быть только восстановителями.
253. Степень окисления, существование выше которой для атомной частицы элемента невозможно, называется высшей степенью окисления
254. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в высшей степени окисления, за счет них могут быть только окислителями.
255. Степень окисления атомной частицы элемента, которая больше низшей степени окисления, но меньше высшей степени окисления, называется промежуточной степенью окисления.
256. Вещества (частицы), в состав которых входят атомные частицы элемента, находящиеся в промежуточной степени окисления, за счет этого элемента могут быть как восстановителями, так и окислителями, т. е. проявляют окислительно-восстановительную двойственность.
257. Окислительно-восстановительная реакция – это -_______единая реакция, которая может быть условно разбита на две полуреакции: окисление и восстановление.
258. Вещества, между которыми происходит процесс окисления-восстановления, называются окислитель и восстановитель.
259. На том, что общее число электронов, принимаемых окислителем и отдаваемых восстановителем в одной и той же окислительно-восстановительной реакции, должно быть одинаковым основан метод электронного баланса.
260. В ходе окислительно-воостановительной реакции окислитель восстанавливается восстановителем.
261. Химические реакции, в ходе которых происходит изменение степеней окисления атомных частиц элементов, называются окислительно-восстановительными реакциями.
262. Окисление – это полуреакция, при которой степень окисления атомной частицы элемента повышается вследствие отдачи электронов.
263. Восстановление – это полуреакция, при которой степень окисления атомной частицы элемента понижается вследствие присоединения электронов.
264. Окислитель – это реагент, содержащий атомную частицу элемента, понижающую степень окисления путем присоединения электронов.
265. Восстановитель – это реагент, содержащий атомную частицу элемента, повышающую степень окисления путем отдачи электронов.
266. Межмолекулярные окислительно-восстановительные реакции __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители являются атомами различных элементов и входят в состав разных веществ.
267. Внутримолекулярные окислительно-восстановительные реакции __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители входят в состав одного вещества, но являются атомами различных элементов.
268. Реакции диспропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы-восстановители и атомы-окислители являются атомами одного и того же элемента, находящимися в одинаковой степени окисления, и входят в состав данного вещества.
269. Межмолекулярные реакции конпропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы одного элемента в разных степенях окисления (окислители и восстановители) входят в состав разных веществ.
270. Внутримолекулярные реакции конпропорционирования __________ – это окислительно-восстановительные реакции, в которых атомы одного элемента в разных степенях окисления (окислители и восстановители) входят в состав одного вещества.
271. Процесс окисления – это
272. Процесс восстановления – это
273. Окислительно-восстановительной является реакция, уравнение которой
274. Веществом, которое за счет атомной частицы элемента Cr может быть только восстановителем, является
275. Химическим соединением, которое за счет атомной частицы элемента Mn может быть только окислителем, является
276. Один из разделов физической химии, который занимается изучением закономерностей, связанных с взаимным превращением химической и электрической форм энергии, называется электрохимией.
277. Реакции, протекающие за счет подведенной извне электрической энергии, или же, наоборот, служащие источником ее получения, называются электрохимическими.
278. Электрохимические реакции совершаются на границе раздела фаз и связаны с переносом через нее электрических зарядов в виде расчлененных актов окисления и восстановления.
279. Предмет электрохимии составляет изучение электрохимических систем.
280. Все электрохимические системы состоят из трех частей.
281. Отрицательный электрод или отрицательный полюс элемента –этоэлектрод, посылающий электроны во внешнюю цепь.
282. Положительный электрод или положительный полюс элемента – это электрод, принимающий электроны из внешней цепи.
283. Электрод, принимающий электроны от участников реакции, называется анодом.
284. Электрод, отдающий электроны участникам реакции, называется катодом.
285. Количество энергии, необходимое для вывода электрона из вещества, называется работой выхода электрона.
286. Гетерогенная система, состоящая из проводников первого и второго рода, в которой происходит перераспределение заряда на границе раздела фаз или перемещение заряженной частицы через эту границу, а также перетекание свободных зарядов из одной фазы в другую, называется . электродом.
287. Электродные потенциалы определяют по уравнению Нернста.
288. Напряжение на гальваническом элементе, соответствующее бесконечно малому току во внешней цепи, называется ЭДС гальванического элемента
289. Самопроизвольное разрушение металлов и сплавов под действием окружающей среды называется коррозией
290. Совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании электрического тока (обычно постоянного) через расплав или раствор электролита, называется электролизом
291. Металл, погруженный в раствор, содержащий катионы этого металла, называется_ ионно-металлическим ______ электродом.
292. Потенциал водородного ________ электрода принимается равным нулю.
293. Химическая коррозия ____________ – это коррозия, протекающая в атмосфере агрессивных газов, не содержащих влаги, а также в присутствии неэлектролитов, обусловленная химической реакцией между металлом и коррозионной средой.
294. _Химический источник тока _________ – это электрохимическая система, производящая электрическую энергию за счет протекающих в ней химических превращений.
295. Электролизер ___________ – это электрохимическая система, в которой за счет электрической энергии совершаются химические превращения.
296. Уравнение Нернста для ионно-металлических электродов при температуре 298 K отвечает выражению
297. При коррозии железа оно анодно окисляется до Fe2+.
298. При работе гальванического элемента, схема которого
на катоде протекает реакция, уравнение которой
299. На инертном аноде при электролизе водного раствора хлорида меди(II) протекает реакция, уравнение которой
300. Уравнение объединенного закона Фарадея для массы образовавшегося при электролизе вещества имеет вид

