Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 143
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
При n = 2 максимальное число электронов - 8 второй энергетический уровень включает 2 – подуровня ѕ и р.
Поэтому во втором периоде – 8 элементов. В третьем тоже 8 хотя может 18 но объясняется тем, что идет заполнение внешнего р подуровня.
Правило Гунда.
При данном значении ℓ ( т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Так, например: три р е азота необходимо распределить на 3х разных р-орбиталях при этом суммарный спин чтобы был максимальным.
↑ ↑ ↑ mѕ = +1/2 +1/2 + ½ = 3/2
эти же е могут быть расположены таким образом; при этом
↑↓ ↑ … mѕ = +1/2 -1/2 + ½ = ½
1ѕ 2ѕ 2р
Принцип наименьшей энергии ( наибольший вклад в развитие этого принципа внес отечественный ученый В.М.Клечковский
1)В атоме каждый е располагается так, чтобы его энергия была минимальной ( что отвечает наибольшей связи его с ядром)
В 1961 г. Клечковский сформулировал общее положение, гласящее, что е занимает в основном состоянии уровень с наименьшим значением суммы n + ℓ
А в том случае, когда для 2х подуровней суммы значений n + ℓ равны, сначала идет заполнение с меньшим значением n.
Например, 3d 4p 5ѕ сумма = 5 в этом случае заполнение идет 3d →4p→5ѕ
11.Периодический закон и периодическая система элементов Д.И.Менделеева принцип построения группы, периода. Ś-,р-,đ- f- блоки элементов. Их расположение в периодической системе.
12.Важнейшие характеристики элемента: энергия ионизации, относительная электроотрицательность (ОЭО), сродство атома элемента к электрону и их зависимость от радиуса атома. Атомные и ионные радиусы.
Д.И.Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Данные о строении ядра и о распределении электронов в атомах позволяют по-новому рассмотреть периодический закон и периодическую систему элементов. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера)
Периодическая таблица элементов является графическим выражением Периодического закона. Существует несколько форм Периодической таблицы.
Горизонтальные строчки Периодической таблицы называются ПЕРИОДАМИ, а вертикальные - ГРУППАМИ.
В группах собраны элементы с похожими химическими свойствами, а в периодах химические свойства постепенно изменяются.
Если сравнить между собой элементы разных периодов, то можно отметить важную особенность:
Номер ПЕРИОДА, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
В этом заключается физический и химический смысл номера периода. Как же изменяются свойства элементов одного периода?
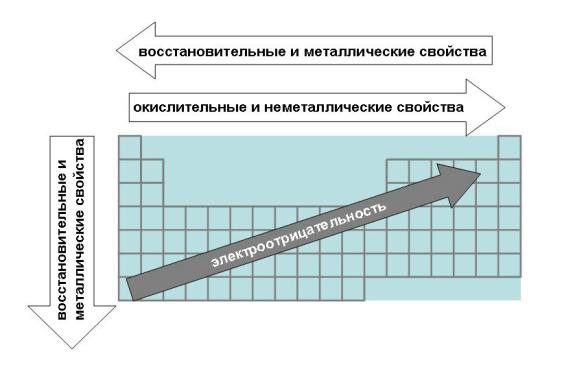
В левой части периодов элементы проявляют ярко выраженные восстановительные свойства. Большинство из этих элементов являются металлами (Li, Na, Mg, Ca).
В правой части собраны типичные неметаллы, обладающие окислительными свойствами (O, F, Cl).
В середине периодов располагаются элементы, обладающие как восстановительными, так и окислительными свойствами. Эти окислительные или восстановительные свойства зависят от того, с каким элементом они реагируют.
Каждый период Периодической таблицы начинается активным металлом и заканчивается инертным газом.
Номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей.
Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов. В этом заключается физический смысл номера группы.
Заряд ядра Z совпадает с ПОРЯДКОВЫМ НОМЕРОМ элемента в Периодической таблице.
Свойства элементов периодически изменяются в соответствии с их атомным весом.
Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы - металлы).Термин “переходные металлы” возник вследствие того, что все d-элементы в периодах служат как бы “переходным мостиком” от металлических s-элементов к p-элементам, среди которых уже много неметаллов.
Все элементы разделяются на 4 электронных семейства.
1.s-элементы – это элементы в атомах которых последним заполняется s – подуровень внешнего электронного слоя. Первые два элемента каждого периода. Они составляют главные подгруппы 1 и 2 групп.
2.р- элементы – это элементы в атомах которых последним заполняется р –подуровень внешнего электронного слоя. Р – элементы составляют главные подгруппы 3-8 групп.
3.d- элементы – это элементы, в атомах которых последним заполняется d- подуровень предвнешнего электронного слоя. Это элементы побочных подгрупп всех восьми групп.
4.f- элементы – это элементы в атомах которых последним заполняется f- подуровень третьего снаружи электронного слоя. Это элементы располагающиеся в нижней части периодической системы лантаноиды и актиноиды.
Валентные электроны – это электроны. Которые могут участвовать в образовании химических связей.
В атомах s- и р- элементов валентными являются, все электроны внешнего слоя.
В атомах d – элементов валентными являются электроны s- и d- подуровней.
В атомах f – элементов валентными являются электроны s- и f- подуровней.
Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательности, степень окисления связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Атомы не имеют строго определенных границ , что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными и кажущимися радиусами, т.е. радиусом шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных.
Радиус атома- расстояние от ядра атома до максимума электронной плотности его валентных электронов. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электрона притягиваются к ядру сильнее.
Атомы. Лишившиеся одного или нескольких электронов, становятся заряженными положительно, т.к. заряд ядра атома превышает сумму зарядов оставшихся электронов. Атомы, присоединяющие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома:
r аниона > r ат.> rкатиона
Энергия ионизации– это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Потенциал ионизации- наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов. Выражается в вольтах
Энергия ионизации, выраженная в электронвольтах, численно равна потенциалу ионизации, выраженному в вольтах.
Электроотрицательность характеризует способность атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Металличность– это способность атомов элемента отдавать электроны.
Неметалличность– это способность атомов элемента присоединять электроны.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
Количественной характеристикой неметаличности является сродство к электрону.
Сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому т.е. при превращении атома в отрицательно заряженный ион:
Э0 + е = Э- + Еср.
Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем, сильнее неметаллические свойства элемента.
13.Химическая связь. Параметры химической связи: энергия связи, длина связи, валентный угол.
Химической связью называется совокупность взаимодействий ядер и электронов, приводящая к образованию молекул.
Химическая связь образуется только в том случае если при сближении, полная энергия атомов снижается. Более устойчива та система атомов, которая содержит меньше энергии.
При сближении двух атомов (например, водорода) между ними возникают силы отталкивания одноименных зарядов и силы притяжения различных зарядов ядер и электронов.
Количественные характеристики химической связи.
Химическая связь характеризуется рядом параметров.
Чаще всех основным параметром относят энергию и длину связи.
Если молекула состоит из трех и более атомов, то к этим параметрам добавляют еще и валентный угол.
Энергией связи называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находится в основном (невозбужденным ) состоянии. Эта величина определяет прочность связи. Чем больше энергии затрачиваемая на разрыв связи, тем прочнее связь.
Единица измерения связи кДж/моль энергия связи в ряду однотипных молекул постепенно изменяется.
Например, энергия связи Н-Г в ряду галогеноводород в НF,HCI,HBr,HI уменьшается ( увеличении радиуса Г) HF=565,7кДж/моль,HI=294,7кДж/моль

