Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 145
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Гибридизация атомных орбиталей.
Метод гибридизации исходит из предположения, что при образовании молекулы вместо исходных s, р, d-электронных облаков образуются такие равноценные «смешанные» или гибридные облака, которые вытянуты по направлению к соседним атомам, чем достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание электронных облаков обеспечивает более прочную химическую связь и следовательно, дополнительный выигрыш энергии. Если этот выигрыш достаточен для компенсации энергии деформации исходных атомных электронных облаков, то гибридизация приводит к уменьшению потенциальной энергии образующейся молекулы, т.е. к повышению ее устойчивости.
Гибридизация атомных орбиталей – это смешение атомных орбиталей (электронных облаков) различного типа , в результате которого образуются одинаковые по форме и энергии гибридные орбитали BeCl2.

Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:

Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали .
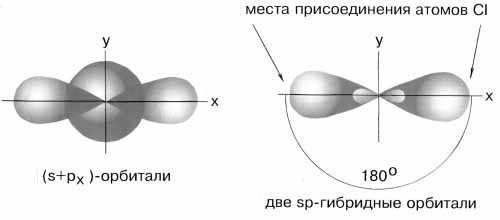
sp-гибридизация валентных орбиталей бериллия в соединении BeCl2. Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой.
Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3.
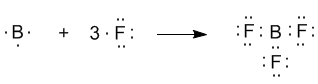
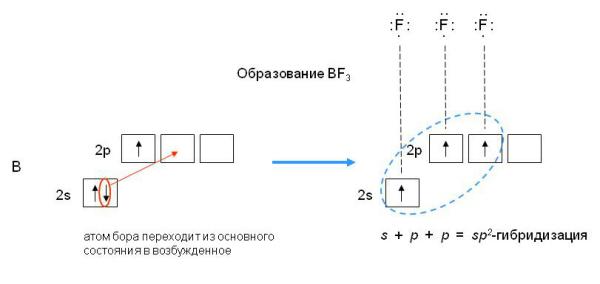

sp2-гибридизация валентных орбиталей бора в соединении BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o.
Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4.

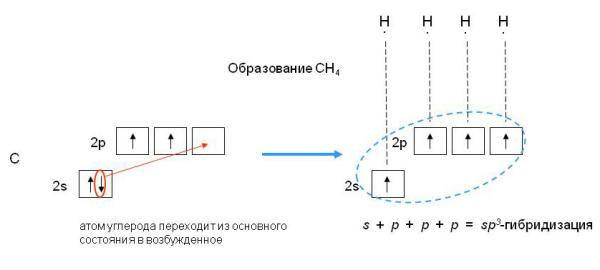
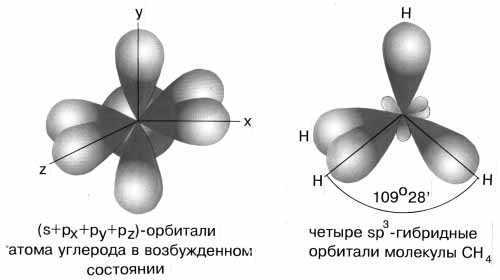
sp3-гибридизация валентных орбиталей углерода. Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.
Существует важное правило: При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
17.Описание молекулы по методу линейной комбинации атомных орбиталей. Молекулярная орбиталь (ЛКАО-МО) Связывающие и разрыхляющие МО ( заполнение электронами МО в простейших молекулах Н2+, Н2, Не2, Не2 +2).
18.Энергетические схемы образования молекул из одинаковых атомов (гомоядерные) и разных атомов (гетероядерные) на примере ΝО, СО, О2, F2.
19.Сравнение МВС и ММО (двухцентровые и многоцентровые связи)
Для описания и расчета ковалентной связи используется два метода. Метод молекулярных орбиталей, в создании которого внес большой вклад Роберт Малликен, следует рассматривать как исследование формы электронных орбиталей в уже образовавшейся молекуле.
Метод предполагает, что при образовании химической связи изменяется состояние всех электронов во взаимодействующих атомах они становятся общими для данной молекулы. АО видоизменяется и превращается в МО.
Разница между АО и МО
Заключается в том, что АО принадлежит ядру одного атома является одноцентровой, а МО- принадлежит сразу двум или нескольким ядрам и является многоцентровой. Таким образом, электроны, находящиеся на МО обобществляется сразу всеми атомами данной молекулы (если по МВС они обобществляются только соседними).
Молекулярной орбиталью называют волновую функцию, описывающую состояние электрона в поле всех атомов данной молекулы. Однако форма и энергия МО зависит от того какие электроны участвуют в ее образовании:
а) МО, образованные внутренними (не валентными АО) взаимно не перекрываются, а значит и не изменяют своей формы, не изменившиеся АО, перешедшие в МО, называется не связывающими (МО) электроны в них обладают тем же запасом энергии что и атомы.
б) Валентные АО, вступал в взаимодействие и превращаясь в МО, становятся многоцентровыми, сложными по форме . Наглядно представить изменение формы АО при образование МО можно путем линейной комбинации волновых функцией, описывающих АО обозначим волновые функции АО через φ МО через ψ
Тогда для двух взаимодействующих орбиталей атомов А и В возможны два вида комбинаций:
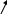 Ψ =φА+φВ
Ψ =φА+φВА+В
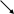 Ψ=φА -φВ
Ψ=φА -φВΨ= φА+φВ или Ψ=φА -φВ
При сложении волновых функций электронная плотность в пространстве между ядрами увеличивается, энергия системы при этом снижается такое состояние МО образованное путем, перекрывания АО (А) и АО (В) называется связывающей МО (МОсв )
при вычитании волны функций электронные орбитали направлены в разные стороны от ядер атомов.
электронная плотность =0 и ядра отталкиваются друг от друга, такая МО называется разрыхляющей (МО разр.), энергия ее выше чем энергия исходных АО (А) и АО(В)
Суть М МО заключается в том, что все электроны находятся на молекулярных орбиталях, единых для всей системы ядер и электронов данной молекулы.
Для определения волновых функций молекулярных орбиталей не пользуют приближение, называемое линейной комбинацией атомных орбиталей (ЛКАО), т.е.
При заключении МО электронами выполняются принцип наименьшей энергии, принцип Паули и правило Хунда
Т.е. согласно принципу наименьшей энергии в первую очередь заполняются МО с наименьшей энергией.
Согласно принципу Паули – на одной МО могут находиться не более 2х электронов с разными значениями спинового квантового числа ( ↑ и ↓) и в соответствии с правилом Хунда электроны распределяются так, чтобы суммарный спин был максимальным, это значит, что на каждой МО с одинаковым значением энергии располагаются по одному электрону ( ↑ ↓)
Для двух атомных молекул соответствует система, обозначений молекул орбиталей – σ и π
 F πP*
F πP*−
__σ*
S
__σсв
Порядок связи равен полуразности числа е на связывающих и разрыхляющих МО
Количество МО =сумме АО атомов, входящих в состав данной молекулы.
Заполнение МО в атомных молекулах, составляющих, из атомов I-го и II-го периодов происходит в такой последовательности:
σ 1S
Порядок связи
Состояние частиц и реально ли их существование Н2, Н2+,Не2,Не22+ можно интерпретировать с точки зрения как МВС так и ММО.
Согласно МВС взаимодействие частиц осуществляется путем спаривания валентных электронов.
Н2

