Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 144
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Зная энергию связи в молекуле, можно судить о ее реакционной способности и производить термохимические расчеты.
Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
1.В ряду аналогичных молекул длина связи изменяется закономерно.
Например, в ряду Н-Г длина связи увеличивается сверху вниз (с возрастанием размера атома Г)
2.В молекулах близких по хим. природе в пределах одного гомологического ряда длины связей между ядрами элементов мало различаются (т.е. можно считать постоянными)
Например, длины связей С-С в предельных углеводородах.
3.Кроме того на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, между ядерными расстояния уменьшаются так, длина связи С-С = 0,154нм;
С-С =0,135нм; С-С = 0,121нм.
Валентные углы это углы между связями в молекуле их схематически можно представит как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые проведенные через два ядра называют линиями связи. Величины вал. углов зависят от природы атомов и характера связи.
Простые двухатомные молекулы всегда имеют линейную структуру . С = О
Трехатомные и более сложные молекулы обладают различными конфигурациями.
Например, в молекуле Н2О угол между линиями связи Н-О = 104,50
О
/ \
Н Н
4. Метод валентных связей для описания и расчета ковалентных связей используются два метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО)
14. Ковалентная связь. Метод валентных связей (МВС). Полярная и неполярная ковалентная связь. Механизмы образования (обменный, донорно-акцепторный)
15.Свойства ковалентной связи: длина, насыщаемость, направленность. Диполь, дипольный момент.
16.σ – π- связи. Форма молекул. Гибридизация атомных орбиталей: Śρ, Śρ2 Śρ3- гибридизация.
Свойства ковалентной связи.
Ковалентная связь обладает рядом важнейших свойств. К ним относятся: насыщаемость и направленность.
Насыщаемость - она проявляется в способности атомов образовывать ограниченное число ковалентной связей. Это связано с тем что одна орбиталь атома может принимать участие в образовании только одной ковалентной связи. Данное свойство и определяет (объясняет) состав молекулярных химических соединений
С точки зрения МВС третий атом Н не может присоединиться т.к. спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле Н2.
Способность образовывать то или иное число ковалентных связей у атомов ограничивается возможностью получения максимального числа неспаренных электронов.
Направленность- свойство ковалентной связи, определяющее геометрическую структуру молекулы.
Причина направленности связи объясняется тем, что перекрывание электронных орбиталей возможно, только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания.
µ = q l
Электрический момент диполя выражается в Дебаях Д , 1Д=3,33 10 -30Кл м. Он является векторной величиной, например от отрицательного полюса диполя к положительному. q+ ← q-
Расстояние меду центрами тяжести эффективных зарядов называется длиной диполя.
В многоатомных молекулах суммарный электрический момент диполя молекулы равен векторной сумме ЭМД отдельных связей. Поэтому полярность или неполярность молекулы, определяется, ее ЭДМ зависит от симметричности распределения зарядов, т.е. от геометрической структуры молекул. Например, молекула СО2 является неполярной вследствие линейного строения, хотя отдельные связи С-О полярны (µ= 8,9 10-29 Кл м).
q+
q- О = С = О q-
→ ←
µ µ
А молекула воды из-за своего строения является полярной:
2q-
О
q+ Н ∕ \ Н q+
Полярность связей и всей молекулы в целом может изменяться под действием внешнего электрического поля или под воздействием другой молекулы или иона. Эта способность характеризуется поляризуемостью. Т.е. неполярные молекулы могут стать полярными, а полярные в еще более полярные вплоть до полного разрыва с образованием положительных и отрицательных ионов:
Н:С1: → Н :С1: → Н+ + :С1:- такой распад называется гетеролитическим.
В случае разрыва с образованием атомов или радикалов наблюдается гомолитический разрыв:
Н : С1: → Н + С1:
Ковалентная связь. В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода . Этот процесс уже является типичной химической реакцией, потому что из одного вещества (атомарного водорода) образуется другое – молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.
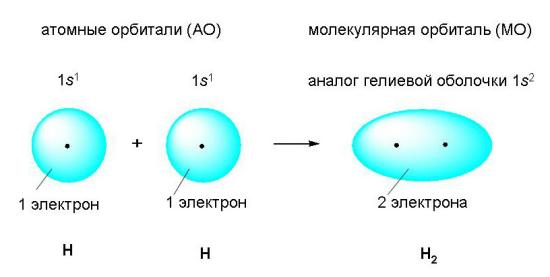
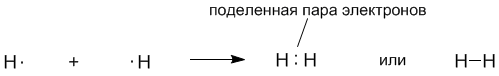
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Различают две разновидности ковалентной связи: неполярную и полярную.
Если двухатомная молекула состоит из атомов одного элемента, например: О2, N2, С12, то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распространяется в пространстве симметрично относительно ядер обоих атомов. Такая связь называется неполярной или гомеополярной (например, молекула хлора). Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении зарядов. Такая связь называется полярной или гетерополярной.
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора.

На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии
, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
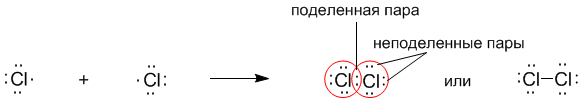
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании.
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
И при взаимодействии молекулы NН3 и ионов Н+ образуется ковалентная связь и неподеленная пара электронов азота становится общей для двух атомов и образуется ион аммония:
Н Н
Н : N: + Н+ →[Н :N:Н]+
Н Н
Т.е. связь возникла за счет пары электронов одного атома и свободной орбитали другого. Атом, представляющий пару электронов называется донором. А свободную орбиталь - акцептором. Такой способ образования ковалентной связи называется донорно-акцепторным. Связь, образовавшаяся по такому механизму, не отличается по своим характеристикам от ковалентной связи. Создаваемой за счет неспаренных электронов взаимодействующих атомов.
Таким образом, атомы образуют ковалентную связь различными способами.
При использовании метода валентных связей (МВС) эта способность оценивается с помощью валентности, количественной мерой которой является число ковалентных связей, образованных данным атомом, или, что-то же самое, число орбиталей, используемых атомом для образования связей.
σ- связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
π- связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.

