Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 123
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2
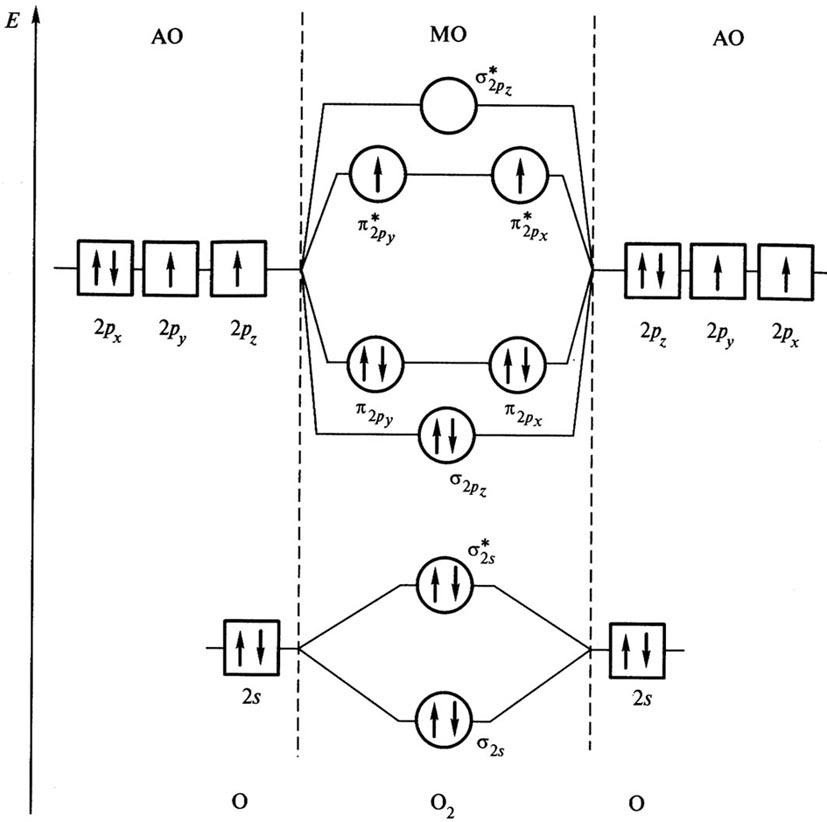
Энергетическая диаграмма молекулы О2.
s-электроны второго уровня 2s1 перейдут с АО на МО с образованием связывающей МО и s2s* – разрыхляющей МО.
связывающей МО и s2s* – разрыхляющей МО.
р-электроны перейдут с трех АО 2рх, 2ру, 2рz на МО с образованием -связывающей, на которой размещаются два электрона с АО 2рх, затем с образованием двух p2р-связывающих МО, на которых размещаются четыре электрона С АО (2ру и 2рz). Последние два электрона С АО 2рz в соответствии с правилом Гунда разместятся по одному на двух s2p* разрыхляющих орбиталях.
-связывающей, на которой размещаются два электрона с АО 2рх, затем с образованием двух p2р-связывающих МО, на которых размещаются четыре электрона С АО (2ру и 2рz). Последние два электрона С АО 2рz в соответствии с правилом Гунда разместятся по одному на двух s2p* разрыхляющих орбиталях.
Магнитные свойства молекул. Характер распределения электронов по МО позволяет объяснить магнитные свойства молекул. Собственный магнитный момент (парамагнетизм) молекул обусловлен наличием неспаренных электронов. В молекуле кислорода имеется два неспаренных электрона, поэтому она парамагнитна. Методом ВС парамагнетизм молекулярного кислорода объяснить не удается.
Строение гетероядерных молекул. Метод МО позволяет рассмотреть строение гетероядерных молекул, в состав которых входит два и более атомов различных элементов.
В молекуле СО (так же как и в молекуле N2) на внешнем уровне находится 10 электронов, в т.ч. 8 электронов на связывающих и 2 электрона на разрыхляющих МО. Порядок связи для молекул СО и N2 равен 3. Это обуславливает сходство в свойствах и параметрах молекул СО и N2.
Таким образом, метод МО успешно объясняет магнитные и оптические (спектральные) свойства различных молекул. Оба метода (МО и ВС) дополняют друг друга в описании химической связи молекул.
Сравнение МВС и ММО :
Метод ВС обладает многими достоинствами . Он относительно прост и нагляден и позволяет предсказывать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия и длина связей. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. В методе ВС постулируется участие в образовании связей пары электронов, в то же время существуют свободные радикалы, молекулярные ионы, такие как Н
2+, Не2+, О2-, которые имеют неспаренные электроны. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. выталкиваются из магнитного поля. Согласно методу ВС молекула О2 не имеет неспаренных электронов, между тем кислород парамагнитен.
Согласно методу МО электроны в молекулах распределены по молекулярным орбиталям, которые подобно АО характеризуются определенной энергией и формой В отличии от АО молекулярные орбитали охватывают не один атом , а всю молекулу, т.е. является двух или многоцентровыми. Если в методе ВС атомы молекул сохраняют определенную индивидуальность, то в методе МО молекула рассматривается как единая система. Наиболее широко в методе МО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил.
21.Ионная связь. Поляризация и поляризующая способность ионов. Механизм образования, свойства. Водородная и металлическая связь.
Ионная связь, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
При образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами, или катионами; а атомы неметаллов превращаются в отрицательные ионы – анионы.
Связь между ионами называется ионной связью.
Энергия, которая требуется для разрыва связи, называется энергией химической связи.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z = 11) и фтора (Z = 9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z = 10). Для того, чтобы убедиться в этом, надо записать электронные формулы всех трех элементов:
Na: 1s2 2s2 2p6 3s1
F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
В электронных формулах нам важны только электронные конфигурации внешних уровней (они подчеркнуты).
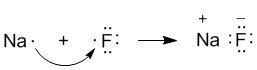
Натрий, отдав фтору свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает атом F, приняв один электрон, отданный натрием. Теперь это ион F–. Разумеется, при этом ионы F– и Na+ продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут изменить природу элемента – число протонов в его ядре.
Νа0 – 1 е = Νа+ F0 + е = F–
Νа+ + F– = Νа F
Теперь в дополнение к ковалентной составляющей химической связи в молекуле Na+:F– добавляется еще и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность химической связи. Однако ковалентная составляющая (стремление к октету) продолжает играть большую роль и в ионных соединениях.
В отличие от ковалентной связи, ионная связь не обладает направленностью, Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется
относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака.
.
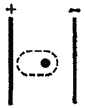
Рис. Поляризация иона в электрическом поле.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля (см., рис., пунктиром показана деформация электронной оболочки иона в электрическом поле), смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга.
Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и в результате слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду
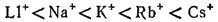
Точно так же поляризуемость ионов галогенов изменяется в следующей последовательности:
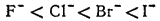
Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров . Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков.
Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле; следовательно, наибольшей поляризующей способностью обладают многозарядные ноны. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры

Энергетическая диаграмма молекулы О2.
s-электроны второго уровня 2s1 перейдут с АО на МО с образованием
р-электроны перейдут с трех АО 2рх, 2ру, 2рz на МО с образованием
Магнитные свойства молекул. Характер распределения электронов по МО позволяет объяснить магнитные свойства молекул. Собственный магнитный момент (парамагнетизм) молекул обусловлен наличием неспаренных электронов. В молекуле кислорода имеется два неспаренных электрона, поэтому она парамагнитна. Методом ВС парамагнетизм молекулярного кислорода объяснить не удается.
Строение гетероядерных молекул. Метод МО позволяет рассмотреть строение гетероядерных молекул, в состав которых входит два и более атомов различных элементов.
В молекуле СО (так же как и в молекуле N2) на внешнем уровне находится 10 электронов, в т.ч. 8 электронов на связывающих и 2 электрона на разрыхляющих МО. Порядок связи для молекул СО и N2 равен 3. Это обуславливает сходство в свойствах и параметрах молекул СО и N2.
Таким образом, метод МО успешно объясняет магнитные и оптические (спектральные) свойства различных молекул. Оба метода (МО и ВС) дополняют друг друга в описании химической связи молекул.
Сравнение МВС и ММО :
Метод ВС обладает многими достоинствами . Он относительно прост и нагляден и позволяет предсказывать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия и длина связей. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. В методе ВС постулируется участие в образовании связей пары электронов, в то же время существуют свободные радикалы, молекулярные ионы, такие как Н
2+, Не2+, О2-, которые имеют неспаренные электроны. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. выталкиваются из магнитного поля. Согласно методу ВС молекула О2 не имеет неспаренных электронов, между тем кислород парамагнитен.
Согласно методу МО электроны в молекулах распределены по молекулярным орбиталям, которые подобно АО характеризуются определенной энергией и формой В отличии от АО молекулярные орбитали охватывают не один атом , а всю молекулу, т.е. является двух или многоцентровыми. Если в методе ВС атомы молекул сохраняют определенную индивидуальность, то в методе МО молекула рассматривается как единая система. Наиболее широко в методе МО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил.
-
Число МО равно общему числу АО из которых комбинируются МО. -
Энергия одной МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО полученных из набора АО, приблизительно совпадает со средней энергией этих АО. -
Электроны заполняют МО, как и АО в порядке возрастания энергии, при этом соблюдается принцип запрета Паули, и Правило Гунда -
Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей энергией.
21.Ионная связь. Поляризация и поляризующая способность ионов. Механизм образования, свойства. Водородная и металлическая связь.
Ионная связь, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
При образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами, или катионами; а атомы неметаллов превращаются в отрицательные ионы – анионы.
Связь между ионами называется ионной связью.
Энергия, которая требуется для разрыва связи, называется энергией химической связи.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z = 11) и фтора (Z = 9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z = 10). Для того, чтобы убедиться в этом, надо записать электронные формулы всех трех элементов:
Na: 1s2 2s2 2p6 3s1
F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
В электронных формулах нам важны только электронные конфигурации внешних уровней (они подчеркнуты).
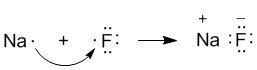
Натрий, отдав фтору свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает атом F, приняв один электрон, отданный натрием. Теперь это ион F–. Разумеется, при этом ионы F– и Na+ продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут изменить природу элемента – число протонов в его ядре.
Νа0 – 1 е = Νа+ F0 + е = F–
Νа+ + F– = Νа F
Теперь в дополнение к ковалентной составляющей химической связи в молекуле Na+:F– добавляется еще и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность химической связи. Однако ковалентная составляющая (стремление к октету) продолжает играть большую роль и в ионных соединениях.
В отличие от ковалентной связи, ионная связь не обладает направленностью, Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется
относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака.
.

Рис. Поляризация иона в электрическом поле.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля (см., рис., пунктиром показана деформация электронной оболочки иона в электрическом поле), смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга.
Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и в результате слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду
Точно так же поляризуемость ионов галогенов изменяется в следующей последовательности:
Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров . Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков.
Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле; следовательно, наибольшей поляризующей способностью обладают многозарядные ноны. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры

