Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 127
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
б) энергия соударения частиц должна быть достаточной для разрыва прежних и образование новых связей. Такой энергией обладают не все молекулы, а лишь определенная их часть, относимая к активным.
Та избыточная энергия, которой обладают активные частицы и благодаря которой становится возможной химическая реакция, называется энергией активации.
в ) «удачно» столкнувшиеся молекулы образуют активированный переходный комплекс, т.е. временное непрочное соединение энергии, в котором ослаблены и удлинены связи, разрываемые в ходе реакции. Ослабление и удлинение связей требует затраты энергии. Следовательно, кинетическая энергия соударений должна превышать энергию активации. Энергетическая диаграмма хода химического процесса имеет вид.
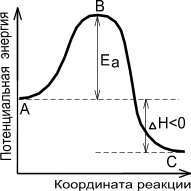 | 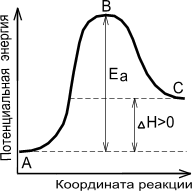 |
| Экзотермическая реакция | Эндотермическая реакция |
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Методы измерения скорости химической реакции.
В зависимости от способа измерения концентрации вещества методы измерения скорости делят на химические, физические, биохимические так например в выше указанной реакции можно получить данные определения скорости по изменению концентрации НС1 Методом кислотно-основного титрования - химический метод. Или по величине водородного показателя рН с помощью рН- метра можно определить изменение СНС1- физико-химический метод кроме того количество выделяющегося Н2 можно определить в л т.е. по объему или по р – физический метод.
К физическим методам относят и спектральные методы, основанные на измерениях спектров поглощения реагентов или продуктов в ультрафиолетовой видимой инфракрасной области.
Смещение химического равновесия. Принцип Ле-Шателье.
Если система находится в состоянии равновесия, т о она будет пребывать в нем до тех пор, пока внешнее условие сохраняются постоянно.
Если условия изменить, то система выйдет из равновесия- скорости прямого и обратного процессов изменятся по-разному.
Наибольшее значение имеет случай нарушения равновесия вследствие изменения
1) концентрации какого либо из веществ, участвующих в
равновесии.2) давление 3) температуры.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB « pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплот
Так синтез аммиака представляет собой экзотермическую реакцию.
N2 +Н2 = 2NН3 + 92,3к∂ж
При повышении температуры равновесие смещается влево.
принцип Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему находящуюся в равновесии. Оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшиться.
29.Тепловой эффект химического процесса. Тепловой эффект образования сложного вещества энтальпия образования элементных веществ. Стандартные изменения термодинамических величин сложных веществ.
30.Термодинамические реакции .Закон Гесса и следствия из него.
31.Обратимые необратимые в термодинамическом смысле процессы. Направление самопроизвольных процессов. Свободная энергия Гиббса, энтропия. Второе начало термодинамики.
32.Энтропия. Физический смысл. Формула Больцмана. Стандартная энтропия. Энтальпийные и энтропийные факторы.
Термохимические реакции. Закон Гесса и следствия из него.
Любой химический процесс можно разделить на две стадии:
1.- разрыв химических связей, во взаимодействующих частицах сопровождающихся поглощением ΔH>O энергии извне
(ΔH1=Hкон. –Hнач. >0) и повышением полной энергии системы;
2 – образование новых химических связей, освобождающее часть энергии и передающее ее в окружающую среду ΔH
ΔH2=Hкон. –Hнач. <0
ΔH>O эндотермический
ΔH
ΔH=O нет обмена
Суммарный энергетический ΔH эффект химического процесса ΔH=0
ΔH=H2 –H1.
Если ΔH2>ΔH1 то ΔH>O и суммарный энергетический эффект химического процесса- положительный (эндотермический).
Если ΔH1>ΔH2 то ΔH
Энергия освобождающаяся в результате химических реакций или при некоторых физических процессах ( конденсация пара в жидкость или кристаллизация жидкости ΔH
ΔU=ΔH
Таким образом, количество внутренней энергии содержащейся в веществах и освобождающейся в результате химических и физических превращений называется тепловым эффектом.
Тепловой эффект образования сложного вещества.
ΔHобр. в отличие от ΔH относится к образованию одного моля сложного вещества. Например
Н2 (г) + С12(г) = 2НС1 ΔH
Но при образовании одного моля вещества НС1
½ Н2 (г) + ½ С12(г) = НС1 ΔHобр.
Отсюда следует. что ΔH = 2ΔHобр.
ΔH зависит от температуры и давления в системах.
Для удобства сравнения введено понятие стандартного состояния вещества, т.е. такого, которое соответствует состоянию чистого продукта при давлении Р= 101,325 кПа и температуре Т= 298 К (250С) отнесенные к стандартным состояниям условий, изменения соответствующих термодинамических величин называют стандартными , их обозначения снабжаются верхним индексом 0:
ΔH0обр.- стандартное изменение энтальпии образования одного моля сложного вещества.
Стандартные изменения энтальпий сложных веществ приводятся в таблицах термодинамических величин.
Энтальпия образования С ;О2; Н2; и всех других элементных веществ, устойчивых при t = 298 К и Р= 101,325 кПа принимают равной нулю т.е. при стандартных условиях ΔHэ= 0
Основной принцип (закон), на котором основываются все термохимические расчёты установлен русским химиком Г. И. Гессом в 1840 году, (изучал тепловые эффекты различных реакций) который формируется следующим образом: суммарный тепловой эффект химического процесса зависит не от пути, а только от начального и конечного состояний системы.
ΔН= ΔН1+ ΔН2= ΔН3+ ΔН4+ ΔН5 – согласно закону Гесса.
Закон Гесса соблюдается только для процессов протекающих при Р=соnst; и V=соnst.
Из закона Гесса следует:
1.тепловые эффекты прямой и обратной реакции равны и противоположны по знаку:
ΔH1
А ↔ В ΔН1= - ΔН2
ΔH2
2.суммарный тепловой эффект кругового процесса равен нулю:
ΔН1+ ΔН2+ ΔН3+ ΔН4 =0
-
тепловой эффект химической реакций равен разности сумм стандартных теплот образования продуктов реакции и исходных
А + В = С + Д ; ΔH
ΔH=[ΔH0обр.(С)+ ΔH0обр.(Д) ] - [ΔH0обр.(А)+ ΔH0обр.(В) ] или
ΔH=∑ΔH0прод. −∑ΔH0исх.
Или иначе говоря переход системы из начального состояния 1 с энтальпией Н1 в состояние 2 с энтальпией Н2 . Изменение энтальпии системы в результате этого перехода, называется энтальпией данной реакции и равно разности
ΔH=H2. −H1
А + В = С + Д
Н1 Н2.
Второе начало термодинамики. Свободная энергия Гиббса.
Изменение внутренней энергии для закрытой системы не может быть критерием самопроизвольного протекания реакций, следовательно, первое начало термодинамики недостаточно для решения вопроса о самопроизвольности.
Процесс называется самопроизвольным, если он осуществляется без каких либо воздействий из вне, т.е. система предоставлена самой себе.
Решение вопроса о самопроизвольности протекания процесса достигается с помощью второго начала термодинамики. Но, кроме того, здесь необходимо вспомнить понятия – обратимые и необратимые в термодинамическом смысле процессы.
Если система находится в равновесии , это состояние сохраняется сколько угодно долго, если не изменить внешние условия.( Если например внутри цилиндра с поршнем установилось равновесие с объемом V1, то это состояние равновесия сохранится до тех пор пока не изменится внешнее давление Р, т.е. при изменении (Р) идет процесс приводящий к изменению объема V2 , т.е. система переходит из начального состояния с объемом V1 в конечное с объемом V2.
Процесс называется термодинамически обратимым,если при переходе из начального состояния в конечное, все промежуточные состояния оказываются равновесными, т.е. обратимый процесс на любом этапе можно заставить идти обратно, изменив внешние условия.
Процесс называется необратимым, если хоть одно из промежуточных состояний не равновесно. С обратимостью связана такая важная проблема медицины - как консервация тканей при низких температурах.
В классической термодинамике под S понимают такое свойство системы, изменение которого при обратимом процессе, численно равно отношению теплоты к температуре протекания процесса :
ΔS=Q/T Р. Клаузиус
В термодинамике обратимым называется такой процесс, который протекает бесконечно медленно и при этом система все время находится в состоянии равновесия . (например испарение воды в условиях кипения).
Суть функции состояния (S), чтобы понять оперируют понятиями макро- и микро- состояний системы. Наиболее наглядным примером может служить коробка с ячейками, в которых находятся шары. Например, в 9 ячейках находится 4 шара – это модель макросистемы. Шары можно разложить по ячейкам 126 способами, каждый из которых является- микросостоянием.
Число микросостояний, посредством которых реализуется данное макросостояние, связано с термодинамической вероятностью. Вот S и определяется термодинамической вероятностью. S тем выше, чем больше способов реализации макросостояния. Поэтому и считают S- мерой неупорядоченности системы. Математическая связь S с числом микросостояний установил Л. Больцман.
S= k ln g U,V
где g – термодинамическая вероятность данного состояния системы при определенном запасе внутренней энергии и объеме. К = постоянная Больцмана = 1,38. 10-23 Дж/К
Возможность самопроизвольного протекания химического процесса или химической реакции в системе определяется совокупностью двух факторов:
- Стремление системы к состоянию наименьшей энергии
- Стремление системы достижения наиболее вероятного состояния
1. Мерой стремления системы к состоянию с наименьшей энергией служит – энтальпия (Н) ΔH→min
2. Мерой стремления системы к наиболее вероятному состоянию служит – энтропия (S) Δ S →max неупорядоченному состоянию.
Энтропия есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности.
Направление химических процессов характеризует изобарно-изотермический потенциал или свободная энергия Гиббса связанная с Н и S следующим соотношением. G=H- Т S
Физический смысл G заключается (раскрывается) следующим образом:
H- полная энергия системы
Т S- связанная энергия, которая ни при каких обстоятельствах не превращается в работу.
Т.о. G- характеризует энергетику системы, т.е. активность химических реакций. Чем больше G тем активнее химический процесс, тем максимальнее совершаемая им работа.
Отсюда следует, что G – это та часть энергии, которая превращается в работу.
Для процесса протекающего при Т = соnst P=const (изобарно изотермический) уравнение Гиббса принимает вид
Δ G=ΔH- ТΔ S уравнение Гиббса - Гельмгольца
Δ G- зависит от величины вклада, которые вносят энтальпийный и энтропийный составляющие. Т.к. во время химического процесса энергия Гиббса убывает, то по знаку Δ G можно судить о направлении химического процесса.
В состоянии равновесия G=const ΔG=Ο
ΔG< 0 в условиях самопроизвольности (т.о. реакция идет в прямом направлении)
ΔG>0 реакция самопроизвольно не протекает (идет в обратном направлении)
В изолированной системе нет обмена энергии с окружающей средой Δm=0 ΔU=0, следовательно ΔH=0 и в этой системе будут протекать реакции (процессы), которые вызывают только рост энтропии в этом суть второго начала термодинамики- одного из важнейших законов, живой и неживой природы.
Δ G=ΔH- ТΔ S
Чем больше Δ S тем меньше Δ G и реакция идет в прямом направлении.
Т.О. изменение энергии Гиббса может служить критерием обратимости.
В обратимых процесса
Qmin=ΔU-Amax
Amax = ΔU- Qmin
Максимально достижимый к п д характеризующий эффективность затрат внутренней энергии системы равен.
η макс =Амакс / ΔU
Максимальная работа Амакс, которая может быть получена при данной убыли внутренней энергии ΔU достигается лишь в том случае, если этот процесс обратимый и при этом выделяется минимальная теплота Qmin или
ΔS=Qmin /T
Т.о. по ΔS можно прогнозировать направление самопроизвольных процессов ( только в изолированных системах).
В качестве критерия самопроизвольности в процессов в открытых и закрытых системах служит функция состояния системы- энергию Гиббса.
Изменение свободной энергии системы при изобарно- изотермическом процессе также подчиняется закону Гесса: ΔG=ΣGпрод.р. –ΣGи.в.
Для получения сравнимых данных характеризующих различные реакции, сопоставляют стандартные изменения ΔΗот;ΔSот;ΔGот; для простых и сложных веществ эти значения табулированы.
33.Учение о растворах. Общие свойства растворов. Классификация дисперсных систем. Истинные растворы. Концентрации растворов.
34.Способы выражения концентрации растворов: молярная, моляльная, нормальная, процентная, мольная доля.
35.Коллигативные свойства разбавленных растворов (осмос осмотическое давление, диффузия, закон Вант-Гоффа, законы Рауля.).
36.Роль осмоса и осмотического давления в биологических системах.(«Тургор», изотонические растворы, асмоляльность-, гипертонические, гипотонические растворы, лизис, гемолиз, плазмолиз) Использование явления осмоса в медицинской практике.(гипертонические повязки, действие слабительных).
Растворами называются гомогенные (т.е. однородные) смеси переменного состава из двух или более веществ. Наиболее распространенное агрегатное состояние растворов – жидкое.
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом
Важной количественной характеристикой растворов являются концентрация и растворимость. Под концентрацией понимается количество растворенного вещества в объеме раствора (растворителя). Под растворимостью понимается максимально возможное количество растворенного вещества в объеме (массе) растворителя до появления осадка (гетерогенная система, и есть граница раздела фаз). В случае ограниченной растворимости можно выделить растворы ненасыщенные, содержание растворенного вещества в которых меньше, чем максимально возможное при данных условиях; насыщенные, в которых данное вещество при данных условиях больше не растворяется, и пересыщенные, содержание растворенного вещества в которых больше, чем в насыщенном растворе при данных условиях (пересыщенный раствор можно получить, например, быстрым охлаждением раствора вещества, растворимость которого значительно повышается с ростом температуры).
Процесс растворения есть процесс самопроизвольного распределения частиц растворенного вещества между молекулами растворителя в результате физического и химического взаимодействия.
Современная теория растворов объясняет механизм процесса растворения как совокупность 3х стадий.
1 стадия. Ориентация молекул растворителя вокруг растворяемого вещества, их взаимодействие, приводящее к ослаблению связей внутри растворяемого компонента. Этот процесс называется сольватацией, а если растворитель вода –гидратацией. Сольватация зависит от температуры, природы растворителя и растворенного вещества.
11 стадия. Разрыв химической связи внутри молекул растворенного вещества и ориентация молекул растворителя вокруг образующихся частиц. Этот процесс называется диссоциацией, на нее влияет температура, природа взаимодействующих частиц.
Внешний энергетический эффект растворения определяется именно этой стадией. Если растворение происходит в неполярном растворителе, т о 11 стадия отсутствует.
Ш стадия – равномерное распределение сольватированных частиц растворенного вещества в объеме растворителя – диффузия – эта стадия зависит только от температуры.
Количественной характеристикой состава раствора является его концентрация, она показывает отношение количества растворенного вещества к общему количеству раствора и выражается различными способами.
Массовая доля ω – отношение массы растворенного вещества к массе раствора
ω =mв-ва/m +m0 m0- масса растворителя выражается в % .
При условии что плотность раствора, есть отношение его массы к объему то массовую долю можно связать с объемом раствора т.е. ρ= m+m0/ V следовательно
ρV=m+m0 ω=m /ρV .100%
Мольная доля N – отношение количества данного вещества к сумме количеств компонентов раствора, т.е. мольная доля растворенного вещества, например
N=n /n+n0 100%
где n, n0- количество растворенного вещества и растворителя.
Мольная доля растворителя N0 = n0 / n+n0 100%
Объемная доля φ –отношение объема растворенного вещества V к объему всей системы V+V0
Φ=V/V+V0 100% φ0 = V0/ V+V0 100%
ω,N,φ- безразмерные величины.
Молярная концентрация – отношение количества растворенного вещества к объему раствора.
См = n/V+V0 моль/л
Если учесть, что n=m/М, где m- масса растворенного вещества, М – его молярная масса, то
См = m/ М (V+V0) моль/л
Моляльная концентрация – отношение количества растворенного вещества к массе растворителя
Сm= n/m0 моль/кг
Зная, что n=m/М это выражение можно преобразовать:
Сm= m/М m0 моль/кг
Молярная концентрация эквивалента (нормальность)- отношение молей эквивалентов растворенного вещества к объему раствора Сn=nэ/ V+V0 моль/л Сn=m/Э V
Т =m/V+V0 г/мл
В разбавленных растворах неэлектролитов ослаблено взаимодействие между частицами растворителя и растворенного вещества и им можно пренебречь.
Свойства таких растворов называются коллигативными . они определяются только числом частиц в растворе и не зависят от их природы.
К таким свойствам относятся : изменение давления насыщенного пара над раствором, температура замерзания и температура кипения раствора (законы Рауля), явления осмоса (закон Вант- Гоффа).
В процессе растворения происходит самопроизвольное распределение частиц растворяемого вещества между молекулами растворителя – диффузия.
Процесс этот двусторонний и продолжается до тех пор пока существует градиент концентрации ∆С (выравнивание концентраций).
Если на пути движения частиц стремящихся занять весь объем, поместить полупроницаемую мембрану , процесс выравнивания концентраций станет односторонним: молекулы растворителя будут проникать через мембрану из раствора с меньшей концентрацией растворенного вещества в более концентрированный.
Процесс односторонней диффузии растворителя через полупроницаемую мембрану называется осмосом. Давление, которое надо приложить к системе, чтобы остановить в ней осмос, называется осмотическим давлением. Осмос такой же самопроизвольный процесс, что и диффузия.
Применив к явлению осмоса законы идеальных газов,
Вант-Гофф установил следующую зависимость:
Росм= СмRT закон Вант-Гоффа
Где Росм- осмотическое давление раствора с молярной концентрацией См при температуре Т, R- универсальная газовая постоянная.
Зная, что См = m/ М V
уравнение можно преобразовать Росм = mRT/МV
И использовать для определения молярной массы неизвестного вещества по осмотическому давлению: М= m RT / Росм V
Закон Вант-Гоффа- справедлив лишь при значениях См≤10-2 моль/л.
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клетки (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении таких клеток в растворы с различной концентрацией наблюдается осмос.
Растворы , имеющие одинаковое осмотическое давление, называют изотоническими.
Изотонические растворы содержат одинаковое количество осмотически активных частиц.
Количество осмотически активных частиц в растворе выражается через осмомоляльность. Эта величина определяется концентрацией всех содержащихся в растворителе осмотически активных частиц (моль/кг)
При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют.
При помещении клеток в гипотонический раствор вода из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого . Такое разрушение клеток называют лизисом.
В случае эритроцитов этот процесс называют гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью.
При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом.
Изотонический раствор NаС1 (0,9%)
Гипотонический раствор NаС1 (0,1%)
Гипертонический раствор NаС1 (2%)
Давление пара над жидкостью, когда скорость испарения равна скорости конденсации (равновесие на границе раздела фаз), называется давлением насыщенного пара.
Величина относительного понижения давления пара (депрессии) над раствором по сравнению с чистым растворителем пропорциональна концентрации растворенного вещества (закон Рауля):
где P0 – давление пара над чистым растворителем, P — давление пара над раствором, N2 – мольная доля растворенного вещества.
У закона Рауля есть два следствия, связанные с кипением и замерзанием (отверждением) растворов по сравнению с растворителем.
Повышение температуры кипения растворов, по сравнению с растворителем называется эбулиоскопией, а математически выражается формулой:
DTкип = KE×Cm,
где KE – эбулиоскопическая постоянная для данного растворителя, Сm – моляльная концентрация. Аналогично для замерзания растворов – криоскопия и уравнения для температуры замерзания раствора по сравнению с чистым растворителем и имеет вид:
DTзам= KE×Cm,
где КК – криоскопическая постоянная. Методами эбулиоскопии и криоскопии можно, например, определить молекулярную массу неизвестного вещества. Как известно, если к g1 г растворителя добавить g2 г растворенного вещества, то моляльная концентрация будет равна:
где M – молекулярная масса растворенного вещества.
Тогда
0>

