Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 124
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Металлическая связь.
Металлы, во-первых, отличаются от других веществ высокой электрической проводимостью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами .
Из первого характерного свойства металла следует, что по крайней мере часть электронов может передвигаться по всему объему куска металла. Из второго свойства металлов следует. Что их атомы не связаны друг с другом локализованными двухэлектронными связями. Число валентных электронов атома металла недостаточно для образования подобных связей со всеми его соседями.
Природу химической связи и характерные особенности металлов можно объяснить на примере лития следующим образом. В кристалле лития орбитали соседних атомов перекрываются. Каждый атом предоставляет на связь четыре валентные орбитали и всего лишь один валентный электрон. Значит. В кристалле металла число электронов значительно меньше числа орбиталей. Поэтому электроны могут переходить из одной орбитали в другую. Тем самым электроны принимают участие в образовании связи меду всеми атомами кристалла металла. К тому же атомы металлов характеризуются невысокой энергией ионизации – валентные электроны слабо удерживаются в атоме, т.е. легко перемещаются по всему кристаллу. Возможность перемещения электронов по кристаллу определяет электрическую проводимость металла.
Водородная связь.
Водородная связь представляет собой результат электростатического притяжения положительно поляризованных атомов водорода к отрицательному полюсу полярных молекул.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
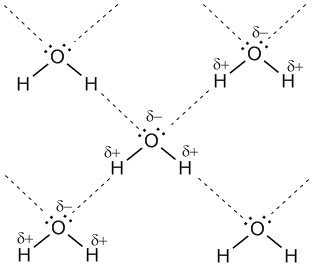
Водородные связи между молекулами воды (обозначены пунктиром).
Учитывая заметную разницу зарядов на атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной связи придает притяжение разноименных зарядов. Водородные связи характерны для таких веществ, как вода H
2O, аммиак NH3, фтороводород HF.
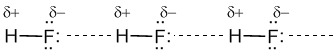
22.Химическая кинетика. Гомогенная и гетерогенная системы. Фаза. Гомогенные и гетерогенные реакции, их скорость (зависимость скорости от механизма реакции)
23.Энергетические диаграммы состояний энергии активации прямой и обратной реакции ( экзотермический и эндотермический процесс) Влияние концентрации на смещение равновесия ( отношение Пс/Кс).
24.Катализ. Гомогенный и гетерогенный катализ. Примеры. Цепные реакции.
25.Зависимость скорости химической реакции от температуры. Уравнение Аррениуса правило Вант-Гоффа. Энергия активации. Состояние реакционной системы (активированный комплекс переходное состояние) Зависимость скорости от концентрации (закон действующих масс)
26.Обратимые и необратимые химические реакции. Равновесие с точки зрения термодинамики и химическое равновесие с точки зрения кинетики. Химический потенциал.
27.Константа равновесия Кр - как важнейшая характеристика химического взаимодействия (Кр→∞,Кр→О) Смещение химического равновесия ( влияние температуры, концентрации) направление реакции, если Пс≥Кс как изменится при этом ∆Ğ.
28.Смещение химического равновесия. Принцип Ле-Шателье. Закон Вант-Гоффа (уравнение, выражающее зависимость температуры от энтальпии)Энергетические диаграммы экзотермической и эндотермической реакции.
Цепные реакции
Цепные реакции- это совокупность последовательно протекающих реакций
, в которой реагентами очередного развивающегося процесса служат продукты предыдущего процесса.
Типичным примером цепной реакции может служить взрывоподобный процесс взаимодействия хлора с водородом, для развития которого реакционную смесь достаточно осветить на ничтожно малое время. Этот процесс начинается со стадии химического распада молекулы хлора на атомы при поглощении кванта света - зарождение цепи
С12 + hv=С1.+С1.
За этой стадией следует группа непрерывно повторяющихся реакций с участием активных частиц и образованием новых активных частиц без воздействия света – продолжение цепи.
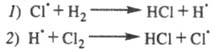
Кроме этих реакций одновременно протекают процессы, которые приводят к исчезновению активных частиц – обрыв цепи
Реакции обрыва цепи могут проходить при столкновении активных частиц со стенками реакционного сосуда, при тройном соударении с частицей М, к которой переходит выделившаяся энергия, при взаимодействии с различными примесями, например, молекулами кислорода:
С1.+С1. +М =С12 +М*
Н.+О2+М=НО2+ М*
Обратимые и необратимые реакции:
Необратимые – протекают до полного израсходования реагирующих компонентов, т.е. одного из реагирующих.
1) один из продуктов реакции удаляется из раствора в виде газа:
Zn + 4HNO3 = Zn(NO3)2 +2NO2 + 2H2O
2) один из продуктов реакции выпадает в осадок:
Ba(NO3)2 + H2SO4 = BaSO4 +2HNO3
3) образуется малодиссоциирующей вещество ( здесь вода)
КОН + НС1 = КС1 + Н2О
4) образуется комплексная соль:
СиSО4 +4 NН3 = [Си(NН3)4]SО4
5)выделение большого количества теплоты:
2Мg + О2 = 2МgО - ∆Н
6) окислительно-восстановительные реакции:
2 СrСI3 + 10 КОН + 3 Н2О2= 2К2СrО4+ 6КС1 + 8 Н2О
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
К обратимым физическим процессам относятся: растворение, испарение, плавление.
К необратимым – осаждение, конденсация, кристаллизация веществ.
В гомогенной системе реакция идет во всем объеме.
В гетерогенной системе реакция протекает только на поверхности раздела фаз
Скоростью химической реакции называют изменение количества реагирующего вещества или образующегося продукта в единице объема за единицу времени.
Для гомогенной (однофазной) системы реакционным пространством служит объем, и скорость v может быть выражена:
где Dn – изменение количества вещества; t – время; Dc – изменение концентрации. В кинетике под реагентами понимают исходные вещества, а образующиеся в ходе реакции вещества – продукты.
Для гетерогенных систем (различные фазы) реакции протекают на поверхности раздела фаз, и скорость определяется количеством вещества, вступившего
в реакцию или получившегося в результате реакции (Dn) за единицу времени (Dt) на единице поверхности раздела (S):
→
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + . . . ® . . .
V = k • [A]a • [B]b • . . .
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2изменение скорости реакции можно рассчитать по формуле:
| | | (t2 - t1) / 10 |
| Vt2 / Vt1 | = g | |
(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A • e –Ea/RT
где
R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)];
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
А – перед экспоненциальный множитель, который характеризует константу скорости при нулевой энергии активации
К = Аехр и показывает число наиболее вероятных столкновений всех частиц соударяющихся в системе.
Множитель [-Еа/RТ] долю « удачных» столкновений, энергия которых превышает энергию активации Е*,
Энергию активации легко рассчитать, если известны константы скорости при разных температурах.
Разница в энергиях между исходным и переходным состоянием равна энергии активации. То есть, активные молекулы должны обладать энергией активации для осуществления взаимодействия для того, чтобы произошло ослабление связей в исходных веществах, для преодоления отталкивания между электронами в сближающихся молекулах, которое мешает их столкновению. Следовательно, энергия активации является одним из параметров, характеризующих скорость процесса. Чем больше энергия активации, тем меньше скорость процесса.
Фундаментальным представлением в теории химической кинетики является понятием об активном комплексе, включающее несколько отправных моментов.
а) не любое столкновение частиц в реальном объеме приводит к их взаимодействию, а лишь такое, при котором обеспечена выгодная пространственная ориентация, максимально сближающая ядра и электронные орбитали партнеров.

