Файл: Термодинамика, фазалы тепетедіктер. ! Химиялы термодинамика зерттейді.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 57
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Термодинамика, фазалық тепе-теңдіктер.
! Химиялық термодинамика зерттейді:
*+химиялық энергияның электрлік, жылулық, механикалық, беттік және т.б. түрлеріне айналуының негізгі заңдылықтарын.
! Ашық термодинамикалық жүйе қоршаған ортамен алмасады:
*+қоршаған ортамен массасымен және энергиясымен алмасады.
! Гетерогендік жүйе:
*+екі және одан да көп фазалардан тұрады.
! Гомогендік жүйедегі фазалар саны φ:
* φ=0. *+φ=1. * φ>1. * φ=2. * φ>2.
! Гетерогендік жүйедегі фазалар саны φ:
*+φ>1.
! Гомогендік термодинамикалық жүйе:
*+әрбір нүктесінде қасиеттері бірдей және бір фазадан тұрады.
! Келтірілген термодинамикалық параметрлердің ішінен термодинамикалық функцияларды таңдаңыз:
*+H.
! Келтірілген термодинамикалық параметрлердің ішінен термодинамикалық функцияларды табу керек: *+S.
! Интенсивтік термодинамикалық параметрлерді таңдаңыз:
*+C.
! Тек экстенсивтік термодинамикалық параметрлерді таңдаңыз:
*+m, V, U, H, G.
! Тікелей өлшенетін келесі термодинамикалық параметрлер:* +масса.
! Келтірілген термодинамикалық жүйелерден гетерогендік жүйені табыңыз:
*+жүйе: сұйық су – мұз.
! Жабық термодинамикалық жүйелерді таңдаңыз:
*+суыған тас.
! Ашық термодинамикалық жүйені таңдаңыз:* суыған пеш.
*+өсімдік.
! Тікелей өлшенетін термодинамикалық жүйе параметрлерін айтады:
*+негізгі
! Тікелей өлшенбейтін термодинамикалық жүйе параметрлерін айтады:
*+күй функциясы.
! Адам термодинамикалық жүйе ретінде болып табылады:
*+гетерогендік, ашық.
! Эндотермиялық реакциялар үшін:
*+Q<0, ∆H>0.
! Экзотермиялық реакциялар үшін:
* +Q>0, ∆H<0.
! Термодинамиканың бірінші заңының математикалық өрнектелуі:*+ Q=∆U + A.
! Экзотермиялық реакцияларда:
* +жылу бөлінеді.
! Эндотермиялық реакцияларда:
*+жылу сіңіріледі.
! Термодинамикалық функция болып табылады: *+U.
! Гиббстің еркін энергиясы анықталатын формула:*+∆G = ∆H - T∆S.
! ∆G = ∆H - T∆S теңдеуіндегі T∆S шамасы сипаттайды:
*+жүйенің байланысқан энергиясын.
! Джоульмен өлшенетін физикалық шамаларды таңдаңыз:
*+жылу мөлшері.
! Жылусыйымдылықтың өлшем бірліктерін анықтаңыз:
*+Дж/моль*К.
! Келтірілген заттардан қайсысының түзілу жылу нөльге тең:
*+Н2.
! Энтропия өзгерісі ∆S>0 болатын реакцияны табыңыз:*+2Н2О = 2H2 + O2.
! Энтропия өлшем бірліктерін табыңыз:
*+Дж/мольК.
! Абсолюттік ноль температурасында дербес кристалл затының энтропиясы нөлге тең:
*+термодинамиканың үшінші заңы.
! Қайтымды изобаралық-изотермиялық процессте жүйе жасайтын максималды жұмыс абсолюттік шамасы бойынша тең:
*+Гиббс энергиясына.
* Энтальпияға.
* изохоралық-изотермиялық потенциалға.
* Гельмгольц энергиясына.
! Қайтымды изохоралық- изотермиялық процессте жүйе жасайтын максималды жұмыс абсолюттік шамасы бойынша тең:
* Энтропияға. * Гиббс энергиясына.
* Энтальпияға.
* изохоралық-изотермиялық потенциалға.
*+Гельмгольц энергиясына.
! кДж/моль өлшенетін шамалар:
* S. * V. *+∆H. * ∆ S. * p.
! Химиялық жүйенің реакциялық қабілетін анықтайтын шама: * ішкі энергия.
* жүйенің температурасы.
* реакция өнімдерінің түзілу жылулары.
*+Гиббс энергиясы.
* қоршаған ортаның температурасы.
! «Мұз-су-бу» жүйесінің құрамында:
* бір компонент, тривариантты.
* бір компонент, бивариантты.
*+бір компонент, инвариантты.
* үш компонент, моновариантты.
* екі компонент, бивариантты.
! Судың күй диаграммасындағы екі фазаның тепе-теңдікте болуы нені көрсетеді:
* 1,2,3 өрістері.
* үштік нүкте О.
*+АО, ВО, СО сызығы.
* АВ сызығы.
* ВС сызығы.
! Q=∆H формуласы:
* Лавуазье-Лаплас заңы.
* термодинамиканың бірінші заңы.
* Гесс заңынан шығатын бірінші салдар.
*+изобаралық процестің жылулық эффектісі.
* изохоралық процестің жылулық эффектісі.
! Q=∆U формуласы:
* Лавуазье-Лаплас заңы.
* термодинамиканың бірінші заңы.
* Гесс заңынан шығатын бірінші салдар.
* изобаралық процестің жылулық эффектісі.
*+изохоралық процестің жылулық эффектісі.
! Жылу суық денеден ыстық денеге өте алмайды:
* термодинамиканың нөлінші заңы.
* Лавуазье-Лаплас заңы.
* +термодинамиканың екінші заңы.
* термодинамиканың бірінші заңы.
* Гесс заңынан шығатын бірінші салдар.
! Термодинамиканың жүйенің бір түрінен екінші түріне өтуінде энергия жоқ болып кете алмайды, жоқтан пайда бола алмайды, тек бір күйден 2-шіге ауысқанда қатаң эквивалентті қатынас жүреді:
* +термодинамиканың бірінші заңы.
* Лавуазье-Лаплас заңы.
* термодинамиканың екінші заңы.
* Гесс заңы.
* термодинамиканың нөлінші заңы.
! Реакцияның жылу эффектісі жүру жолына тәуелді емес, бастапқы және өнім заттарының күйіне және табығатына тәуелді:*термодинамиканың бірінші заңы.
*Лавуазье-Лаплас заңы.
*термодинамиканың екінші заңы.
*+Гесс заңы.
* термодинамиканың нөлінші заңы.
! Температураны өзгерткендегі реакцияның жылу эффектісінің өзгерісі жылу сыйымдылыққа тең болады:
* термодинамиканың бірінші заңы.
* Лавуазье-Лаплас заңы.
* термодинамиканың екінші заңы.
* Гесс заңы. *+Кирхгофф заңы.
!. Тепе-теңдік константасы тең парциалды қысым арқылы көрсетілген идеал газ фазасының реакциясында мольдік үлесі немесе молярлы концентрациясы сандық жағынан сәйкес келеді * 2NO2 = 2NO + O2
* N2 + 3H2 = 2NH3 * 2SO2 + O2 = 2SO3
* +CO + H2O(г) = CO2 + H2
* CH4 + H2O(г) = CO + 3H2
!. Идеал газ фазасы реакциясында, жалпы қысымды азайтқан кезде тепе-теңдік солға қарай ығысады (бастапқы заттар жағына қарай): *2NO2 = 2NO + O2
* H2 + J2(г) = 2HJ(г) *+ 2SO2 + O2 = 2SO3
* CO + H2O(г) = CO2 + H2
* CH4 + H2O(г) = CO + 3H2
!. Идеал газ фазасы реакциясында, жалпы қысымды азайтқан кезде тепе-теңдік оңға қарай ығысады (өнім жағына қарай):
* +2NO2 = 2NO + O2 * N2 + 3H2 = 2NH3
* H2 + J2(г) = 2HJ(г)
* CO + H2O(г) = CO2 + H2
* CH4 + H2O(г) = CO + 3H2
! Идеал газ фазасында реакция тепе-теңдігіне жалпы қысымның өзгеруі әсер етпейді* 2NO2 = 2NO + O2
* N2 + 3H2 = 2NH3 * 2SO2 + O2 = 2SO3
* CH4 + H2O(г) = CO + 3H
* + CO + H2O(г) = CO2 + H2
! Кейбір температурада химиялық тепе- теңдіктегі А(Г) + В(Г) ↔ С(Г) + D(Г) жүйеде, А, В, С және D заттарының концентрациясы сәйкесінше 6, 2, 4 және 3 моль/л тең. Берілген температурада тепе-теңдік константасы қанша* +1 * 2 * 4
!. Дұрыс тұжырымдаманы табыңыз: Химиялық реакцияның реті – бұл
* тура молекулярлығы секілді
* стехиометриялық коэффициенттің қосындысы
* +кинетикалық теңдіктегі дәреже көрсеткіштерінің қосындысы
* элементарлы актіге қатысатын бөлшектер саны
* стехиометриялық коэффициенттер саны
!. Дұрыс тұжырымдаманы табыңыз
* ΔG > 0 - бұл химиялық тепе- теңдіктің белгісі
*+ ΔG = 0 - бұл химиялық тепе- теңдіктің белгісі
* ΔG < 0 - бұл химиялық тепе- теңдіктің белгісі
* ΔG ≥ 0 - бұл химиялық тепе- теңдіктің белгісі
* ΔG ≤ 0 – бұл химиялық тепе- теңдіктің белгісі
!. Бір уақытта бірдей заттар әртүрлі өнім түзуге әсер ететін реакцияны атайды
* +параллельді * кезектес * қатарлы
* тізбекті * фотохимиялық
! Дұрыс тұжырымдаманы табыңыз: химиялық реакцияның молекулярлығы – бұл: *тура реакцияның реті секілді
*стехиометриялық коэффициенттің қосындысы
* +кинетикалық тепе- теңдіктегі дәреже көрсеткіштерінің қосындысы
* элементарлық актіге қатысатын бөлшектер саны
* әсерлесуші заттардың концентрацияларының қосындысы
! Қате тұжырымдаманы табыңыз
* тура және кері реакцияның жылдамдық тепе- теңдігі – бұл химиялық тепе- теңдік белгісі
*ΔG = 0 – бұл химиялық тепе- теңдік белгісі
* +қайтымсыз реакция – бұл химиялық тепе- теңдік белгісі
* ΔG = ΔH-TΔS * ΔF = ΔU-TΔS
! Егер сыртқы факторлардан тек температура мен қысым әсер ететін болса, екі фазалы бір компонентті жүйедегі еркіндік дәрежесінің санын көрсетіңіз
* +1 * 2 * 3 * 4 * 5
! Тепе теңдік күйіндегі жүйе 2SO2(Г) + О2(Г) = 2SO3(Г)*гетерогенді *+бір фазалы
*екі фазалы *үш фазалы *төрт фазалы
! К компонеттен және Ф фазадан тұратын, сыртқы факторлардан тек қысым мен температура әсер ететін жүйенің еркіндік дәрежесінің санын (күйдің варианттылығы) анықтаңыз* К+Ф+2
* К-Ф-2 * К+Ф-2 *Ф-К+2 *+ К-Ф+2
! К компонеттен және Ф фазадан тұратын, сыртқы факторлардан тек температура әсер ететін (қысым тұрақты) жүйенің еркіндік дәрежесінің санын (вариантты күйінде) анықтаңыз* К+Ф+1 * К-Ф-1
* К+Ф-1 * Ф-К+1 * +К-Ф+1
!. 2 моль азот және 5 моль аммиакты араластырған кезде, N2(Г) + 2H2(Г) = 2NH3(Г), жүйедегі тәуелсіз компоненттер саны * 1
*+2 * 3 * 4 * 5
! NH4Cl(К) = NH3(Г) + HСl(Г) мына тепе теңдік жүйедегі фазалар саны
* 1 *+2 * 3 * 4 * 5
!. Егер сыртқы факторлардан тек температура мен қысым әсер етсе, екі фазалы бір компонентті жүйедегі еркіндік дәрежесінің саны*+1 * 2 * 3 * 4 * 5
!. сыртқы факторлардан тек температура мен қысым әсер ететін, тепе теңдікте бола алатын гетерогенді екі компонентті жүйенің әртүрлі фазалардың көптеген саны* 1 * 2 * 3 *+4 * 5
! Ерітінділерді тұрақты қысымда бастапқы ерітіндінің қайнау температурасы мен еріткіштің қайнау температурасын салыстыра отырып зерттеуге негізделген әдіс:* калориметрия * криоскопия
* тензиметрия * фотометрия
*+эбулиоскопия
!.Компонент – бұл
* жүйені құрайтын бөлігі
* берілген жүйені құраушы молекулалар мен иондар
* +жүйе компонентінің санын өзгертпей ақ мөлшерін өзгертуге болатын жүйенің құрам бөлігі
* жүйенің фазалық құрамын анықтайтын зат
* элементарлы актіге қатысатын бөлшектер саны
! Айдау температурасы бұл – қатты зат...
* Буға айналады
*+Өз бумен тепе-теңдікте болады
* Буының қысымы сыртқы қысымға тең болады
*Конденсацияланады
*Сублимацияланады
! Көп компонентті жүйелер – құралады:
*Компоненттердің үлкен санымен
*Екі компонентпен
*Бір компоненттен көбірек
*+Екі компоненттен көбірек
*Бір компоненттен
!. Фаза – бұл
*Гетерогенді жүйенің гомогенді бөлігі
* жүйенің бірдей агрегаттық күйдегі бөліктерінің жиынтығы
* жүйенің химиялық құрамы бірдей бөлігі
*+жүйенің химиялық құрамы мен физикалық қасиеттері бірдей болатын гомогенді бөліктерінің жиынтығы
* гетерогенді жүйе
!. Мына келтірілген заттардың қайсысының түзілу жылуы нольге тең болады:* С2Н4 * СО* * СН4 * +Н2
!. Энтропиясының өзгерісі
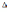
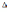 S>0 болатын рекацияны көрсетіңіз
S>0 болатын рекацияны көрсетіңіз*+2Н20 = 2Н2+ О2 * N2+ ЗН2 = 2NН3
* J2 + H2 = 2HJ * Сl2 + Н2 = 2НС1
* 2NO + 02= 2N02
!.Энтропияның өлшем бірлігін көрсетіңіз
*+Дж/мольК *Дж/моль *Кал/град
* Кал∙моль∙град * Дж/град
!. Жеке кристалды заттың энтропиясы абсолютті нөлде тең 0-ге"
* Термодинамиканың нөлінші заңы
* Темродинамиканың бірінші заңы
* Термодинамиканың екінші заңы
* +Термодинамиканың үшінші заңы
* Кирхгоф заңы
!. Қайтымды изобаралық-изотермиялық процестегі максималды жұмысты жасай алатын жүйе, абсолютті түрде тең:
* Энтропияға * +Гиббс энергиясына
* Энтальнпияға
* Ихозора-изотермиялық потенциалға
* Гельмгольц энергиясына
!. кдж/мольмен өлшенетін шама
* S * V *+
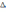
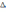 H *
H * 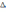
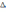 S * P
S * P! химиялық жүйенің реакциялық қабілеттілігінің мөлшері болып табылатын шама *Ішкі энергия
*Жүйенің температурасы
* Өнімнің түзілу жылуы
*+Гиббс энергиясы
* Қоршаған орта температурасы
!. Q=
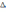
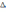 H формуласын тап:
H формуласын тап:* +Изобаралық процесстің жылу эффектісі
* Термодинамиканың бірінші заңы
* Гестің бірінші заңының салдары
* Лавуазье-Лапласа заңы
* изохоралық процесстің жылу эффектісі
! Q =
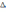
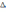 U Формуласы қандай:
U Формуласы қандай:* Лавуазье-Лаплас заңы
* Термодинамиканың бірінші заңы
* +изохоралық процесстің жылу эффектісі
* Изобаралық процесстің жылу эффектісі
* Гестің бірінші заңының салдары
! Суығырақ денеден жылырақ денеге жылу өте алмайды
*Термодинамиканың нөлінші заңы
* Лавуазье-Лаплас заңы
*+Термодинамиканың екінші заңы
* Термодинамиканың бірінші заңы
* Гесс заңының салдары
! Термодинамикалық жүйенің бір күйден екінші күйге өтуі кезінде, энергия өздігінен пайда болмайды әрі жоғалып кетпейді, ол бір түрден екінші түрге қатаң эквивалентті түрде өзгереді
*+Термодинамиканың бірінші заңы
*Лавуазье-Лаплас заңы
*Термодинамиканың екінші заңы
* Гесс заңы
*Термодинамиканың нөлінші заңы
!. реакцияның жылу эффектісі реакцияның жүру жолына тәуелсіз, реакция түсетін заттардың және түзілетін өнімнің табиғатына байланысты:
* +Гесс заңы * Лавуазье-Лаплас заңы
* Термодинамиканың екінші заңы
* Кирхгоф заңы
* Термодинамиканың нөлінші заңы
! реакцияның жылу эффектісінің өзгеруі температура өзгергенде әртүрлі жылу сыйымдылыққа тең
* Термодинамиканың бірінші заңы
* Лавуазье-Лаплас заңы
* Термодинамиканың екінші заңы
* Гесс заңы *+Кирхгоф заңы
!. Тепе – теңдік константасының өлшемі тәуелді:
*+ химиялық реакцияның жүру жылдамдығына
*Сұйықтық тепе – теңдігі – қайнау диаграммасының буы
*экстракцияның эффективтілігі
*Сұйықтық тепе – теңдігі
*сұйықтық тепе-теңдігі – балқу диаграммасына
! Жоғары температурада тепе-теңдік реакциясы қай жаққа қарай ығысады:
2H2S ↔ 2H2 + S2; ∆Н = 41,9 кДж
*тура және кері бағытқа *+оңға
*солға *ығыспайды
*қорытындыға келмейді
! Жоғары қысымда тепе-теңдік реакциясы қай жаққа қарай ығысады:
H2 + J2 ↔ 2HJ*оңға *+әсер етпейді
*солға *тура және кері бағытқа
*барлық жауап дұрыс
!. Тепе – теңдікті оң жақ реакцияға қарай ығыстыру үшін қай фактордың өзгеруімен жүзеге асыруға болады: 2SO2 + O2 ↔ 2 SO3; ∆Н = - 176 кДж*Т жоғарлауымен
*қысымның төмендеуімен
*+Т төмендеуімен
*катализатордың қатысымен
*қысымның жоғарлауымен
!. ∆Н = 0 химиялық реакция үшін Кр температураға қалай әсер етеді?
*жоғарлайды *+тәуелді емес
*төмендейді *Кр = 0 **Кр< 1
!. Өздігінен жүретін реакция үшін Кр және Пр қалай өзара байланысты?*Кр < Пр
*Кр = Пр *+Кр > Пр *Кр = 1 *Кр ≥ Пр
! Химиялық реакцияның изотермиялық теңсіздігі қай жағдайда тепе-теңдік жағдайға көшеді?*Кр < Пр, ∆G>0
*+Кр = Пр, ∆G = 0 *Кр > Пр, ∆G<0
*Кр < Пр, ∆G<0 *Кр ≥ Пр, ∆G>0
!. Қай функцияның стандартты өлшемі химиялық теңдікпен сипатталада:
*+Гиббс энергиясы *химиялық потенциал
*энтальпия *энтропия
*Гиббс-Гельмгольц энергиясы
!. Ле-Шателье принципі бойынша 3Н2 + N2 ↔NH3 реакция үшін тепе-теңдік ығысуы егер ∆H0298 = - 92,3/8 кДж болса, өнім түзілген жаққа міндетті түрде:
*қысымды жоғарлату керек
*+температураны төмендету керек
*аммиакты реакциялық сферадан шығару керек
*реакциялық қоспаға бастапқы затты қосу керек
*қысымды төмендету керек
!. Әсер ететін заттың стандартты химиялық тепе-теңдік өлшемі :*∆S
*∆H *+∆G *химиялық ауыспалы
*химиялық ауыспалы емес
!. Егер реакция жылу жұтылумен (∆Н>0) өтетін болса, температураны жоғарлатқанда тепе-теңдік константасы :
*төмендейді *+жоғарлайды
*өзгермейді *басында жоғарлайды, содан кейін төмендейді
*қорытындыға келмейді
!. СаСО3 ↔ СаО + СО2 жүйесінде қысымды жоғарлату үшін:
*тепе-теңдікті оңға ығыстырады
*+тепе-теңдікті солға ығыстырады
*ештеңке өзгермейді
*тепе-теңдік константасы жоғарлатады
*барлық жауап дұрыс
!. А + 2В = АВ2 жүйесіне А компонентін қосқанда:
*+тепе-теңдік өнім реакциясына қарай ығысады
*жылдамдатылғанАВ2 диссоциациясы басталады
*реакция тоқталады
*А компонентін қосу реакцияға әсер етпейді
*В компонентін қосу реакцияға әсер етпейді
!. Химиялық реакцияның изотермиялық теңдеуі қолданылады:
*бастапқы заттың жылулық жануын анықтау
*өнім реакцияларының жылулық түзілуін есептеу
*+берілген шарт бойынша химиялық реакцияның бағытын орнату
*әсерлесетін өнімнің құрамын анықтау
*барлық жауап дұрыс
! Фаза дегеніміз не? Фаза – бірдей сипатталатын фазаның бөлігі:
*барлық нүктеде химиялық потенциал болып келеді
*барлық нүкте параметрлеріндегі химиялық, физикалық және термодинамикалық қасиеттерімен сипатталады
*+ барлық нүктедегі қасиеттермен сипатталады
*барлық нүктеде
*барлық нүкте параметрлері физикалық қасиеттермен сипатталады
!. Фазалы диаграмма нені сипаттайды?
*жүйелік құрамын
*фазалық тепе – теңдікті
*фазалық құрамының сыртқы ортаға тәуелділігін
*+аймағы мен тепе – теңдік фазаны
*фазаның құрамын
! Гиббс ережесі бойынша тәуелсіз көрсеткіші неге байланысты?
*табиғатына және фазалық санына
*санына және фазаның табиғатына, компоненттен
*компоненттің саны мен табиғатына және ауыспалы тәуелсіздігіне
*+компоненттер санына, фазаның табиғаты мен ауыспалы тәуелсіздігіне
*фазаның табиғатына
!. Бір – біріне тәуелсіз Т және Р еркіндік дәреже кезінде, бір компоненттік жүйе үшін С санының еркіндік дәрежесі қандай теңдеумен сипатталады?*С = к – Ф + 1
*+С = к – Ф + 2 *С = к – Ф + 3
*С = к – Ф *C= Ф-к
!. Эвтектикалық нүктеде тәуелсіздік дәреже саны:*+0 *2 *3 *1
*барлық жауабы дұрыс емес
!. Бір мезгілде гетерогенді жүйенің тепе – теңдік күйінде болатын фазалық саны:
*термодинамиканың бірінші заңы
*Рауль заңы
*Кирхгофф заңы
*+Гиббстың фазалық ережесі
*Клайперон-Клаузиус теңдеуі
!. Фазалық ауысуда жылулық эффект реакциясы кімнің теңдеуімен анықталады?
*Гиббс – Гельмгольц *Аррениус
*+Клайперон – Клаузиус
*Кирхгофф
*Барлық жауап дұрыс
! Компоненттің ликвидус қисығы нені көрсетеді:
*+қосындының кристаллизация сызығын көрсетеді
*сұйық пен будың тепе – теңдік сызығын
*компоненттік құрғақ айдау сызығын
*сұйық пен сұықтықтың тепе –теңдік сызығы
*kомпоненттердің тепе-теңдік сызығын
!. Бір эвтетикалық балқу диаграммасындағы гомогенді аймақтың санымен агрегаттық күйі неге тең?
*екі аймақтан: сұйық және қатты
*+бір, сұйық балқымадан
*бір, қатты ерітіндіден
*үш аймақтан: екі сұйық және екі қатты
*төрт аймақ; екі сұйық және екі қатты
! Гиббстың 100 % әдісі арқылы үш компонентті жүйенің құрамын анықтау үшін нені қолданады?
*үшбұрыштың қабырғасын
*+үшбұрыш биіктігін
*перпендикуляр ұзындығын, үшбұрыштың кез – келген төбесінен түсірілген
*үшбұрыштың ауданын
*төртбұрыштың бір қабырғасын
! Рауль заңына қандай еріткіштер бағынады?*концентрлі *+идеалды
*полярлы *органикалық *неорганикалық
! Идеалды ерітінді неге тәуелді?
*Коновалов заңына *Алексеев ережесіне
*+Рауль заңына *Гесс заңына
*Массаға әсер беруші заң теңдеуіне
!. Коноваловтың I заңы қандай? Будың құрамында компонент артық болса:
*+ қайнау температурасын төмендетеді немесе ерітіндіге қаныққан будың қысымын арттырады
*ерітіндідегі қайнау температурасын арттырады
*ерітіндідегі қаныққан будың жалпы қосымын кемітеді
*Мах қисықтың пайда болуы
*минималды қисықтың пайда болуы
! Коноваловтың II заңының дұрыс анықтамасы? Жалпы булы қысымның (немесе қайнау температурасы) қисықты mах және min нүктесі екі компонентті жүйенің ерітіндісімен анықталады, оның құрамы:*Т және Р байланысты өзгермейді
*Тепе – теңдік булы құрамнан үлкен
*Тепе – теңдік булы құрамнан кіші
*Т және Р байланысты өзгереді
*+Тепе – теңдік булы құраммен бірдей
!. Қандай сұйықтық шектелген ерітінді деп аталады? Сұйықтар, анықталған концентрация мен температура шегінде берілсе:*+бір гомогенді фаза түзеді
*барлық қатынаста ериді
*Гомогенді және гетерогенді фаза түзеді
*өзара әрекеттеспейді
*тек қана гетрогенді фаза түзеді
!. Шегерілген екі сұйықтық бір – бірінде ерісе, олар мынадай диаграмма түзеді:
*балқымалы бір эвтектика
*+ерітіндінің жоғарғы және төменгі аумалы күйдегі температурасы
*Bайнау, Коноваловтың бірінші заңы
*максимумды балқу
*Минимумды балқу
!. Еріткіш қасиеттері немесе еріген заттар эбуллиоскопиялық тұрақтылықпен анықталады:*+еріткіште *еріген затта
*еріткіште және еріген затта
*еріген затта және ерітіндінің қайнау Т
*Дұрыс жауабы жоқ
II тарау: Химиялық термодинамика
!. "Дәнекерленген ампуладағы глюкозаның сұйытылған ерітіндісі» термодинамикалық жүйесі: * Оңашаланған, гомогенді.
*+Жабық, гомогенді. * Ашық.
* Оңашаланған, гетерогенді. *Гетерогенді.
! «Жабық ампуладағы изотоникалық ерітінді» термодинамикалық жүйесі:
* Оңашаланған. * Жабық.
*+Ашық, гомогенді. * Гетерогенді.
* Гомогенді, оңашаланған.
!. Изокинетикалық процесс барысында жүйедегі температура өзгермейтін жүйе:
* Изохоралық. * Изобаралық.
*+Изобаро-изотермиялық.
* Изохорo-изобаралық. * Изотермиялық
!. Изобаралық термодинамикалық процесске тән:* Көлем тұрақтылығы.
* Температура тұрақтылығы.
*+QP=0>
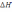
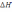 . * QP=
. * QP=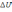
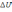 . * QP=
. * QP=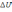
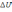 .
. !. Изохоралық термодинамикалық процесске тән:
*Температура тұрақтылығы.
* Қысым тұрақтылығы.
* Qv =

 G. *+Qv =
G. *+Qv = 
 U. * Qv =
U. * Qv = 
 Н.
Н. !. Изобаралық-изотермиялық потенциал:
* Изобаралық-изотермиялық жағдайда термодинамикалық жүйенің энергия қорын сипаттайды.
* Изобаралық-изотермиялық жағдайда термодинамикалық жүйе сыртқы күшке қарсы атқара алатын максимальды жұмысты сипаттайды.
* Tермодинамикалық жүйеде ретсіздік шамасы болып табылады.
*+Бос энергияның шамасы болып табылады.
* Ішкі және потенциальды энергияның қосындысы.
!. Изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері:
* Сстандартты түзілу жылуы.
*+Энтальпия.
* Иизобаралық-изотермиялық потенциал.
* Реакцияның жылу эффектісі.
* Меншікті жылу сыйымдылық.
!. Стандартты жағдайда реакция нәтижесінде жай заттардан 1моль күрделі зат түзілгенде бөлінетін немесе сіңірілетін жылу мөлшері:
* Стандартты түзілу жылуы.
* Түзілу энтальпиясы.
*+Стандартты түзілу энтальпиясы.
* Реакцияның жылу эффектісі.
* Меншікті жылу сыйымдылық.
! Стандартты жағдайда реакция нәтижесінде 1моль күрделі зат жай заттарға ыдырағанда бөлінетін немесе сіңірілетін жылу мөлшері
* Стандартты ыдырау жылуы.
* Реакция энтальпиясы.
*+Стандартты ыдырау энтальпиясы.
* Реакцияның жылу эффектісі.
* Меншікті жылу сыйымдылық.
!. С+О2=СО2 +393,5 кДж термохимиялық теңдеуі бойынша көміртек оксидінің (IV) стандартты түзілу жылуын көрсетіңіз:
* +393,5 кДж/моль. * + -393,5 кДж/моль.
* -786,4 кДж/моль. * +786,4 кДж/моль.
* +120,8 кДж/моль.
! Глюкозаның СО2 және Н2О-ға дейін тотығу үшін ∆Gт=-2879,01 кДж/моль; ∆Н
т=-2801,69 кДж/моль, сондықтан:
* Реакция өздігінен жүреді.
* Реакция өздігінен жүрмейді.
* Жылу бөлінеді.
*+Экзотермиялық реакция.
* Эндотермиялық реакция.
! Тепе-теңдік күйінде:* ∆G=0.
* ∆Н=Т∆S. *+Тура және кері процестердің жылдамдығына тең.
* ∆G<0. * ∆Н>Т∆S.
!. С+О2=СО2+Q1
C+1/2 О2=СО2+Q2
CO+1/2 О2=СО2+Q3
Реакциялары үшін дұрыс пікірлерді таңдаңыз:*+Q1=Q2+Q3. * Q1=Q2-Q3.
* Q3=Q1-Q2. * Q3=Q1+Q2. * Q2=Q1-Q3.
!. N2+O2=2NO+Q1
2NO+O2=2NO2+Q2
N2+2O2=2NO2+Q3
Реакциялары үшін дұрыс пікірлерді таңдаңыз:* Q1=Q2+Q3. * Q1=Q3-Q2.
* Q3=Q1-Q2. *+Q3=Q1+Q2. * Q2=Q3-Q1
!. S+O2=SO2+Q1
SO2+1/2O2=SO3+Q2
S+3/2O2=SO3+Q3
Реакциялары үшін дұрыс емес пікірлерді таңдаңыз:* Q1=Q2+Q3. * Q1=Q3-Q2.
* Q3=Q1-Q2. *+Q3=Q1+Q2. *Q2=Q3+Q1.
!.
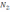
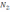 +3H2
+3H2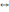
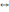 2NH3 теңдеуі үшін тепе-теңдік константасын көрсетіңіз:
2NH3 теңдеуі үшін тепе-теңдік константасын көрсетіңіз:*+K=
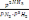
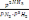 . * K=
. * K= 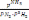
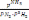 .
.* K=
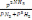
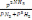 . * K=
. * K= 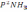
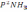 .
.* K=
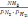
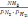 .
.!. Энтропия артады:
*+Газ тәріздес өнімдердің көлемі өсуімен жүретін реакцияларда.
* Газ тәріздес өнімдердің көлемі азаюмен жүретін реакцияларда.
* Газ тәріздес өнімдердің көлемі өзгермейтін реакцияларда.
* Сұйықтықтардың булану процестерінде.
* Сұйық заттардың кристаллдану процестерінде.
!. Энтропия азаяды:
* Газ тәріздес өнімдердің көлемі өсуімен жүретін реакцияларда.
*+Газ тәріздес өнімдердің көлемі азаюмен жүретін реакцияларда.
* Газ тәріздес өнімдердің көлемі өзгермейтін реакцияларда
* Сұйықтықтардың булану процестерінде.
* Сұйық заттардың конденсациялау процестерінде
!. Энтропия шамасы кемитін процесс:
* Сұйықтықтардың конденсациясы.
* Сублимация. *+Кристалдардың балқуы.
* Кристалдардың булануы.
* Сұйық заттардың кристалдануы.
! Энтропия шамасы кемитін процесс:
*+Сұйықтықтардың конденсациясы.
* Сублимация. * Балқу.
* Кристалдардың булануы.
* Сұйық заттардың кристалдануы.
!. Гиббстың бос энергиясы G- жүйе күйінің термодинамикалық функциясы:
* Изохоралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды.
*+Изобаралық- изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды.
* Абсолютті мәні бойынша жүйенің сыртқы күшке қарсы атқара алатын жұмысқа тең.
* Өздігінен жүретін процестер үшін мәні теріс болады
* Жүйеде ретсіздік шамасы болып табылады.
!. Изобаралық- изотермиялық потенциал G-жүйе күйінің термодинамикалық функциясы:
*+Бос энергияның шамасы болып табылады.
* Изобаралық- изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды.
* Абсолютті мәні бойынша жүйенің сыртқы күшке қарсы атқара алатын жұмысқа тең.
* Өздігінен жүретін процестер үшін мәні оң болады.
* Егер жүйе термодинамикалық тепе-теңдік күйінде болса,мәні 0-ге тең.
!. Гельмгольц бос энергиясы F-жүйе күйінің термодинамикалық функциясы:
*+Изохоралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды.
* Изобаралық- изотермиялық жағдайда процестің өздігінен жүру мүмкіндігін сипаттайды.
* Абсолютті мәні бойынша жүйенің сыртқы күшке қарсы атқара алатын жұмысқа тең.
* Процестің өздігінен жүруі мүмкін болмаған жағдайда мәні оң болады.
* Байланысқан энергияның шамасы болып табылады.
! Стандартты жағдайда жүретін 2С+3Н2+1/2О2=С2Н5ОН реакция эффектісі аталады:
* Көміртектің стандартты жану жылуы.
* Сутектің стандартты жану жылуы.
* Стандартты тотығу жылуы.
*+Этанолдың түзілу жылуы.
* Этанолдың стандартты түзілу жылуы.
! Гиббс энергиясын есептеу үшін қолданылатын теңдеу:
*
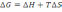
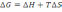 .
.*
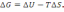
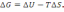
*
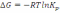

*
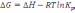
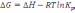 .
.*
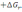
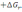 =
=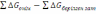
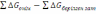
!. Изохоралық-изотермиялық потенциалды есептеуге болатын теңдеу:
*
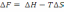
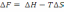 .
.*
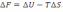
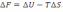
*
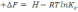
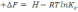 .
. *
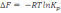
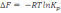 .
.*
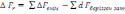
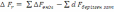 .
.!. Химиялық реакцияның изобаралық теңдеуін көрсетіңіз:
*+
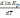
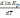 =
= 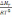
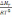 . *
. * 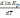
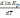 =
= 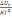
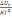 .
.*
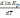
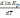 =
= 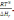
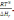 *
* 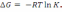
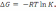
*
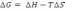
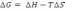 .
.! Химиялық реакцияның изохоралық теңдеуін көрсетіңіз:
*
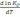
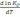 =
=