Файл: Термодинамика, фазалы тепетедіктер. ! Химиялы термодинамика зерттейді.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 59
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
*арасында жылулық алмасу болып тұратын жүйе
!. Қоршаған ортамен жылу алмасуы болып, бірақ масса алмасуы болмайтын жүйе. Бұл жүйе:*ашық *+ жабық
*бөлектенген *тұйықталған
*индукцияланған
! Термохимия негізі болып табылады:
*химиялық тепе-теңдік заңы
*термодинамиканың екінші заңы
*идеалды ерітінді заңы
*термодинамиканың үшінші заңы
*+термодинамикнаың бірінші заңы және оның нәтижесі
!. Қандай мөлшерлер функция күйі болып табылады?*+
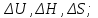
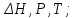 *
*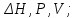 *
*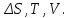 *
*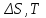
! Келтірілген теңдеулердің қайсысы термодинамиканың I заңын сипаттайды?
*+
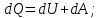 *
*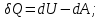
*
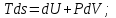
*
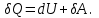
*
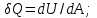
! Термодинамиканың бірінші заңы:
*+ Ішкі энергиялық жүйенің жұмысы мен жүйе арасындағы байланысты орнатады
*Жылу машинасының ПӘК-ін есептеуді көрсетеді
*Экзотермиялық реакция өздігінен жүретінін көрсетеді
*Эндотермиялық процесі қайтымсыз екенін көрсетеді
*эндотермиялық реакция өздігінен жүретінін көрсетеді
!. Гесс заңының қай тұжырымдамасы дұрыс. Химиялық реакцияның жылу эффектісі тәуелді тек қана:
*+бастапқы және соңғы күйінен, бірақ өту жолына тәуелді емес
*аралық реакцияға
*реакция процесінде бөлініп шығатын жылу мөлшеріне
*реакцияға түсетін зат концентрациясына
*реакция процесінде сіңіретін жылу мөлшеріне
! Изобаралық процесс үшін термодинамиканың I заңының формуласын көрсет:
*+
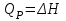 *
* 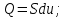
*
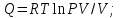 *
*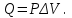 *
*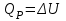
! Егер жылу сиымдылық өзгерісі оң болса, онда температураның өсуімен реакцияның жылу эффектісі – ΔН0 өзгереді:
*органикалық заттар үшін өседі, ал бейорганикалық үшін кемиді
*әсер ететін заттың табиғатына байланысты *кемиді
*+ өседі *тұрақты
! Жылу эффектісінің температураға тәуелділігі көрсетеді:*Рауль заңын
*+Кирхгофф заңын *Аррениус теңсіздігін
*Гиббс-Гельмгольц теңсіздігін
*Менделеев-Клайперон заңын
! Келтірілген тұжырымдардың қайсысы термодинамиканың II заңы болады?
*+ аналитикалық форма постулаты бойынша II типтегі мәңгі двигательдің болуы
*химиялық тепе-теңдіктің зерттеу нәтижесін теориялық талдап қорыту
*заттың агрегаттық өзгеру анализ негізін теориялық көрсеткен
*идеалды ерітіндінің теориялық нәтижесін талдап қорыту
*барлығы дұрыс жауап
!. Қайтымды процесс үшін термодинамиканың II заңының аналитикалық түрін көрсет?
*
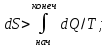 *+
*+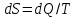
*
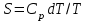 *
*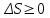 *ΔS=U
*ΔS=U! Изобар-изотермиялық (Гиббс энергиясы) потенциалды сипаттайтын теңсіздікті көрсет:*+
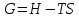 *
*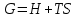
*
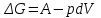 *
*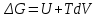
*
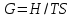
!. Изохор-изотермиялық (Гельмгольц энергиясы) потенциалды сипаттайтын теңсіздікті көрсет:*+
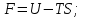
*
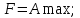 *
*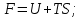
*
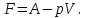 *
*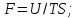
! Өздігінен жүретін процесс үшін
*+изабаро-изотермиялық потенциал
*изохора – изотермиялық потенциал
*энтропияны *ішкі энергияны
*сыртқы энергияны
!. Өздігінен жүретін процесс үшін
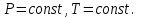 болғанда Гиббс энергиясы қалай өзгереді?*
болғанда Гиббс энергиясы қалай өзгереді?*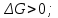 *+
*+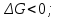
*
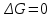 ;
; *өзгермейді *
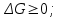
! Келтірілген жағдайлардың қайсысында кез-келген температурада реакция жүруі мүмкін емес?*+
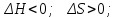
*
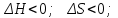 *
*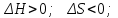
*
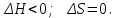
*
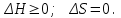
!. Ашық жүйе үшін қай функция процестің бағыттылық критериі болып табылады?
*энтропия *Гиббс энергиясы *энтальпия
*Гиббс-Гельмгольц энергиясы
*+ химиялық потенциал
! Қай функция бос энергияны сипаттайды?
*энтропия *+ Гиббс энергиясы
*энтальпия *ішкі энергия
*Гельмгольц энергиясы
! Жүйеде тепе-теңдік күйі қай Гиббс энергиясының мәніне сәйкес келеді?
*∆G >0 *∆G <0 *+∆G =0
*ондай функция жоқ *∆G≥0
!. Компоненттің химиялық потенциалы бұл:*(dG/dP)T *(dF/dT)V *(dS/dT)V
*+(dG/dTi)P,T, n1 *Н = О
IІI тарау. Ерітінділер. Буферлік ерітінділер
!. Коллигативтік қасиеттерге жатады:
*+ерітінді бетіндегі еріткіштің қаныққан бу қысымының төмендеуі, ерітіндінің қайнау температурасының жоғарылауы, ерітіндінің қату температурасының төмендеуі.
* ерітіндінің қайнау температурасының төмендеуі.
* ерітіндінің қату температурасының жоғарылауы.
* ерітіндінің қату температурасы және қайнау температурасы немесе ерітіндінің қатуы.
* ерітінді бетіндегі еріткіштің қаныққан бу қысымының жоғарылауы.
! Таза еріткішпен салыстырғанда ерітіндінің айырмашылығы:
* қаныққан бу қысымы жоғарылайды.
* қайнау температурасы төмендейді.
* қаныққан бу қысымы жоғарыламайды.
* қату температурасы жоғарылайды.
*+қату температурасы төмендейді.
! «Таза еріткішке қарағанда бейэлектролит ерітіндісі бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік үлесіне тең»:
* Гиббс-Коноваловтың бірінші заңы.
* Гиббс-Коноваловтың екінші заңы.
* Вант-Гофф заңы.
*+Раульдің бірінші заңы.
* Рауль заңынан шығатын салдар.
! Қай теңдеу Вант- Гофф заңына сәйкес келеді: * ∆Тқай=Еm2. * ∆Тқат=Кm2. *∆Р/Р1=х2. *+ π=CRT. * p1=p10x1 .
! Эбулиоскопиялық константа Е:
*+еріткіш табиғатына тәуелді.
* еріген зат табиғатына тәуелді.
* еріткіш табиғатына тәуелсіз.
* еріген зат температураға тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
!. Криоскопиялық константа К:
* еріткіш табиғатына тәуелсіз.
* еріген зат табиғатына тәуелді.
*+еріткіш табиғатына тәуелсіз.
* еріген зат температурасына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
!. Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс:*+плазмолиз. * Гемолиз.
* судың плазмадан жасушаға өтуі.
* Эндоосмос.
* жасуша қабының жарылуы.
!. Вена ішіне жіберілетін препарат ретінде қолданылатын дәрілік зат ерітіндісі қан плазмасымен салыстырғанда болу керек:
*+изотонды. * Гипертонды. * Гипотонды.
* Қаныққан. * Қанықпаған.
!. Жоғары осмостық қысымның әсерінен жасушаның осмотикалық серпімділік күйі аталады:* Эндоосмос. * Плазмолиз.
* Гемолиз. *+тургор. * Экзоосмос.
!. Дәрілік заттардың изотондық концентрациясын есептеуге болады:
* Аррениус заңы бойынша.
* фазалардың орналасуы бойынша.
* термодинамикалық әдіс бойынша.
*+Раульдің екінші заңы бойынша.
* кинетикалық әдіс бойынша.
!. Теңіз суына шомылғанда көздің қызарып, аздаған ауру белгілерінің сезілуі байланысты:
*+көз алмасынан судың осмосына.
* көз алмасының ішіне қарай судың осмосына.
* суда еріген заттардың көз алмасының ішіне қарай өтуіне.
* еріген заттардың көз алмасынан теңіз суына қарай өтуіне.
* Плазмолизге.
! Ащы суда шомылғанда көздің кенеттен ашып, ауру белгілерінің сезілуі байланысты:
* көз алмасынан судың осмосына.
*+көз алмасының ішіне қарай судың осмосына.
* суда еріген заттардың көз алмасының ішіне қарай өтуіне.
* еріген заттардың көз алмасынан теңіз суына қарай өтуіне.
* Плазмолизге.
!. Егер 2 литр суда 2 моль фруктозаны ерітсе, судың қату температурасы қалай өзгереді? Судың криоскопиялық константасы 1.860:* Өзгермейді.
* 1.86 есе артады. * 1.86 есе азаяды.
* 1.86 градусқа өседі.
*+1.86 градусқа азаяды.
!. Ерітінділері үшін изотонды коэффициенті үшке тең болатын заттарды көрсетіңіз:*С12Н22О11. * NaCl. * KNO3.
* CuSO4. *+CuCl2.
!. Ерітінділері үшін изотонды коэффициенті бірден ерекшеленетін болатын заттарды көрсетіңіз:* Лактоза.
* Глюкоза. * Фруктоза. * Галактоза.
*+натрий гидрокарбонаты.
!. Буферлік ерітінді құрамында:
* күшті негіз бен оның әлсіз қышқылмен әрекеттесуінен түзілген тұзынан.
*+әлсіз негіз бен оның күшті қышқылмен әрекеттесуінен түзілген тұзынан.
* күшті қышқыл және оның күшті негізбен әрекеттесуінен түзілген тұзынан.
* күшті қышқыл және оның күшті негізбен әрекеттесуінен түзілген тұзынан.
* әлсіз қышқылмен әлсіз негіз.
! Сутектік көрсеткіш рН анықталатын формула:* рН=+lgCH+. *+рН=-lgCH+.
* рН=-lnCH+. * рН=+lnCH+. * рН=-lnCOH-.
!. Қышқылдық орта*+pH<7.
!. Бейтарап орта:*+рН=7.
!. Концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісі үшін рН мәні:*+1.
* 7. * 0,1. * 13. * 5.
! Концентрациясы 0,01 моль/л және иондану дәрежесі α=0,001 болатын сірке қышқылы ерітіндісі үшін рН мәні:
* 11. * 12. * 2. * 10-4. *+4.
!. Молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісі үшін рН мәні:
* 10-2. * 10-12. * 7. *+12. * 2.
! Молярлық концентрациясы 0,01 моль/л ж2не иондану ережесі α=0,001 болатын аммоний гидроксиді ерітіндісі үшін рН мәні:*+9. * 10-10. * 2. * 10-5. * 5.
! 250С температурада судың иондық көбейтіндісі*10. *10-7. *1014 *+10-14.
!. Қышқылдық буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:* рН=pKklg (CkVk/CCVC).
* рН=pKk-lg (CcVc/CkVk).
* рН=14-pKo+lg (CkVk/CCVC).
*+рН=pKk+lg (CkVk/CCVC).
* рН=pKk-lg (CkVс/CCVк).
! Негіздік буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:* рН=pKklg (CоVо/CCVC).
*+рН=14-pKо+lg (CоVо/CсVс).
* рН=14-pKк+lg (CkVk/CCVC).
* рН=pKо+lg (CоVо/CCVC).
* рН=pKо-lg (CсVс/CоVо).
!. Фосфатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
* H3PO4+Na2PO4. * H3PO4+NaH2PO4.
* Na2HPO4+Na3PO4. *+NaH2PO4+Na2HPO4.
* H3PO4+Na2HPO4.
! Гидрокарбонатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
* H2СO3+Na2СO3. * Na2CO3+CO2.
*+H2CO3+NaHCO3. * H2CO3+NaOH.
* NaHCO3+NaOH.
!. Егер рН 3-ке тең болса:
* сутек иондарының концентрациясы 0,1моль/л.
* сутек иондарының концентрациясы 0,01моль/л.
* гидроксил иондарының концентрациясы 0,001моль/л.
* pOH=4. *+pOH=11.
!. Егер рОН=3, онда:
* гидроксил иондарының концентрациясы 0,2моль/л.
* гидроксил иондарының концентрациясы 0,1моль/л.
* сутек иондарының концентрациясы 0,001.
*+рН=11. * рН=10.
!. Вант-Гофф заңына сәйкес берілген температурада ерітіндінің осмостық қысымы тура пропорциональды болады:
