Добавлен: 10.04.2024
Просмотров: 2763
Скачиваний: 29
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
3.Как происходит оценка качества инъекционных растворов до и после стерилизации?
Оценка качества инъекционных и инфузионных растворов до стерилизации проводится ПОЛНЫЙ ХИМИЧЕСКИЙ КОНТРОЛЬ по внешнему виду, отсутствию механических включений, значению pH, подлинности и количественному содержанию ЛС, содержанию изотонирующих и стабилизирующих веществ.
Оценка качества инъекционных и инфузионных растворов после стерилизации проводится ВЫБОРОЧНО по внешнему виду, отсутствию механических включений, проверке номинального объѐма при розливе во флаконы, значению pH, подлинности и количественному содержанию лекарственных средств, отклонению от номинального объѐма, фиксированности укупорки, стерильности, пирогенности или содержанию бактериальных эндотоксинов.
При несоответствии одному из перечисленных требований растворы являются недоброкачественными.
4.Санитарные требования к помещениям и оборудованию асептического блока.
Санитарные требования к помещениям и оборудованию асептического блока утверждены приказом МЗ РФ от 21.10.1997 г. № 309 «Об утверждении инструкции по санитарному режиму аптечных организаций». Помещения асептического блока должны размещаться в изолированном отсеке и исключать перекрещивание «чистых» и «грязных» потоков.
Асептический блок должен иметь отдельный вход или отделяться от других помещений производства шлюзами. Перед входом в асептический блок должны лежать резиновые коврики или коврики из пористого материала, смоченные дезинфицирующими средствами. В шлюзе должны быть предусмотрены: скамья для переобувания с ячейками для спецобуви, шкаф для халата и биксов с комплектами стерильной одежды, раковина (кран с локтевым приводом), воздушная электросушилка и зеркало, гигиенический набор для обработки рук, инструкции о порядке переодевания и обработке рук, правила поведения в асептическом блоке.
В ассистентской-асептической не допускается подводка воды и канализации. Трубопроводы для воды очищенной следует прокладывать таким образом, чтобы можно было легко проводить уборку. Рекомендуется с помощью специального оборудования создание горизонтальных или вертикальных ламинарных потоков чистого воздуха во всѐм помещении или в отдельных локальных зонах для защиты наиболее ответственных участков или операций (чистые камеры). Чистые камеры или столы с ламинарным потоком воздуха должны иметь рабочие поверхности и колпак из гладкого прочного материала. Для дезинфекции воздуха и различных поверхностей в асептических помещениях устанавливают бактерицидные лампы (стационарные и передвижные облучатели) с открытыми или экранированными лампами
5.Какие организации имеют право на изготовление ЛП? Какие субстанции могут быть использованы при изготовлении ЛП в аптеках?
Изготовление ЛП осуществляется АО, ветеринарными аптечными организациями, ИП, имеющими лицензию на фармацевтическую деятельность, по рецептам на ЛП, по требованиям медицинских организаций, ветеринарных организаций в соответствии с правилами изготовления и отпуска ЛП, утверждѐнными уполномоченным федеральным органом исполнительной власти.
При изготовлении ЛП используются фармацевтические субстанции, включѐнные в государственный реестр ЛС для медицинского применения. Не допускается изготовление аптечными организациями лекарственных препаратов, НЕ зарегистрированных в РФ.
СИТУАЦИОННАЯ ЗАДАЧА № 63
Основная часть
Многопрофильная медицинская организация имеет в своем составе аптеку, в задачу которой входит обеспечение пациентов клиники лекарственными препаратами и перевязочными средствами, медицинскими изделиями, средствами гигиены и ухода за больными.
В аптеку обратилась старшая медицинская сестра травматологического отделения с двумя требованиями-накладными, выписанными на получение 5 упаковок Верапамила (р-р д/в/в введения 5 мг/2 мл: амп. 10, производитель ALKALOID, AD (Македония)) и 12 упаковок ф0а (таблетки 100 мг № 20, производитель ОАО «Органика», Россия) для оказания медицинской помощи в отделении.
На одном требовании выписан Верапамил, а на другом – Трамадол. Требования выписаны на русском языке и имеют все необходимые реквизиты. Однако провизор отказал старшей медицинской сестре в выдаче указанных препаратов.
Вопросы:
1.Укажите правила оформления требований-накладных на лекарственные препараты.
-
Требования-накладные выписываются согласно приказу МЗ РФ № 110 (Приложение 13, п. 3.1). -
Для обеспечения лечебно-диагностического процесса медицинские организации получают ЛП из аптечной организации по требованиям-накладным, утверждѐнным в установленном порядке. -
Требование-накладная на получение из аптечных организаций лекарственных препаратов должна иметь штамп, круглую печать медицинской организации, подпись еѐ руководителя или его заместителя по лечебной части. -
В требовании-накладной указывается номер, дата составления документа, отправитель и получатель ЛП, наименование ЛП (с указанием дозировки, формы выпуска (таблетки, ампулы, мази, суппозитории и т.п.), вид упаковки (коробки, флаконы, тубы и т.п.), способ применения (для инъекций, для наружного применения, приѐма внутрь, глазные капли и т.п.), количество затребованных ЛП, количество и стоимость отпущенных ЛП. -
Наименования ЛП пишутся на латинском языке. -
Требования-накладные на ЛС, подлежащие ПКУ, выписываются на отдельных бланках требований-накладных для каждой группы препаратов. -
Медицинские организации при составлении заявок на НС и ПВ списков II и III должны руководствоваться расчѐтными нормативами, утверждѐнными в установленном порядке.
-
Почему провизор отказал старшей медицинской сестре в выдаче указанных препаратов?
-
Трамадол – сильнодействующее вещество (ПП РФ от 29 декабря 2007 г. № 964 «Об утверждении списков сильнодействующих и ядовитых веществ -
Трамадол подлежит ПКУ (приказ Минздрава России от 22.04.2014 г. № 183н «Об утверждении перечня ЛС для мед. применения, подлежащих ПКУ»). -
При оформлении требования-накладной не соблюдены требования приказа Минздравсоцразвития России от 12.02.2007 г. № 110 (ред. от 26.02.2013 г.) «О порядке назначения и выписывания ЛП, изделий медицинского назначения и специализированных продуктов лечебного питания» в части: наименования ЛП пишутся на латинском языке. -
Требования-накладные на ЛС, подлежащие ПКУ(Трамадол), выписываются на отдельных бланках требований-накладных для каждой группы препаратов. -
Кроме того, превышен крупный размер сильнодействующих веществ для целей статьи 234 УК РФ (утв. ПП РФ 964): крупный размер оборота Трамадола составляет 10 г и выше. -
Чтобы выяснить, превышен ли особо крупный размер в задаче, необходимо рассчитать количество Трамадола в 12 упаковках:
100 мг = 0,1 г
0,1 × 20 × 12 = 24 г, что больше 10 г.
3.Каковы особенности проведения приёмочного контроля Трамадола при поступлении его в аптечную организацию от поставщика?
-
Трамадол входит в перечень ЖНВЛП (Распоряжение Правительства РФ от 12 октября 2019 г. № 2406-р «Об утверждении перечня ЖНВЛП для медицинского применения на 2020 год….»). -
Протокол согласования цен – обязательный сопроводительный документ при реализации ЛП из перечня ЖНВЛП препаратов (ПП РФ от 29.10.2010 г. № 865 «О государственном регулировании цен на ЛП, включѐнные в перечень ЖНВЛП»). -
Приѐмочный контроль заключается в проверке поступающих ЛС на соответствие требованиям по показателям: «Описание», «Упаковка», «Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество ЛС.
-
Форма протокола согласования цен поставки ЖНВЛП установлена ПП РФ от 08.08.2009 г. № 654 «О совершенствовании государственного регулирования цен на ЛП, включѐнные в Перечень ЖНВЛП».
4.Каковы особенности предметно-количественного учёта Трамадола в аптечных организациях?
-
Производятся записи в «Журнале учѐта операций, связанных с обращением ЛС для медицинского применения». -
Правила ведения Журнала – приказ Минздрава России от 17.06.2013 г. № 378н «Об утверждении правил регистрации операций, связанных с обращением ЛС для медицинского применения, включѐнных в перечень ЛС для медицинского применения, подлежащих ПКУ, в специальных журналах учѐта операций, связанных с обращением ЛС для медицинского применения, и правил ведения и хранения специальных журналов учѐта операций, связанных с обращением ЛС для медицинского применения». -
Журналы учѐта, заполняемые на бумажном носителе, сброшюровываются, пронумеровываются и скрепляются подписью руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя) перед началом их ведения. -
Журналы учѐта оформляются на календарный год. -
Листы журналов учѐта, заполняемых в электронной форме, ежемесячно распечатываются, нумеруются, подписываются лицом, уполномоченным на ведение и хранение журналов учѐта, и брошюруются по наименованиям лекарственного средства, дозировке, лекарственной форме. -
По истечении календарного года сброшюрованные листы оформляются в журнал, опечатываются с указанием количества листов и заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта, руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя). -
Записи в журналах учѐта производятся лицом, уполномоченным на ведение и хранение журнала учѐта, шариковой ручкой (чернилами) в конце рабочего дня на основании документов, подтверждающих совершение приходных и расходных операций с ЛС. -
Поступление ЛС отражается в журнале учѐта по каждому приходному документу в отдельности с указанием номера и даты. Расход ЛС записывается ежедневно. Аптечные организации и индивидуальные предприниматели, имеющие лицензии на фармацевтическую деятельность, записывают ежедневный расход лекарственного средства с указанием отдельно по рецептам, выписанным медицинским работникам, и по требованиям медицинских организаций. -
Исправления в журналах учѐта заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта. Подчистки и незаверенные исправления в журналах учѐта не допускаются. -
На последнее число каждого месяца лицо, уполномоченное на ведение и хранение журналов учѐта, проводит сверку фактического наличия лекарственных средств с их остатком по журналу учѐта и вносит соответствующие записи в журнал учѐта. -
Журнал учѐта хранится в металлическом шкафу (сейфе), ключи от которого находятся у лица, уполномоченного на ведение и хранение журнала учѐта. -
Приходные и расходные документы (их копии) подшиваются в порядке их поступления по датам и хранятся вместе с журналом учѐта. Заполненные журналы учѐта хранятся в архиве юридического лица (индивидуального предпринимателя). -
Срок хранения журнала – 3 года. -
Срок хранения требования-накладной на Трамадол – 3 года (приказ 403)
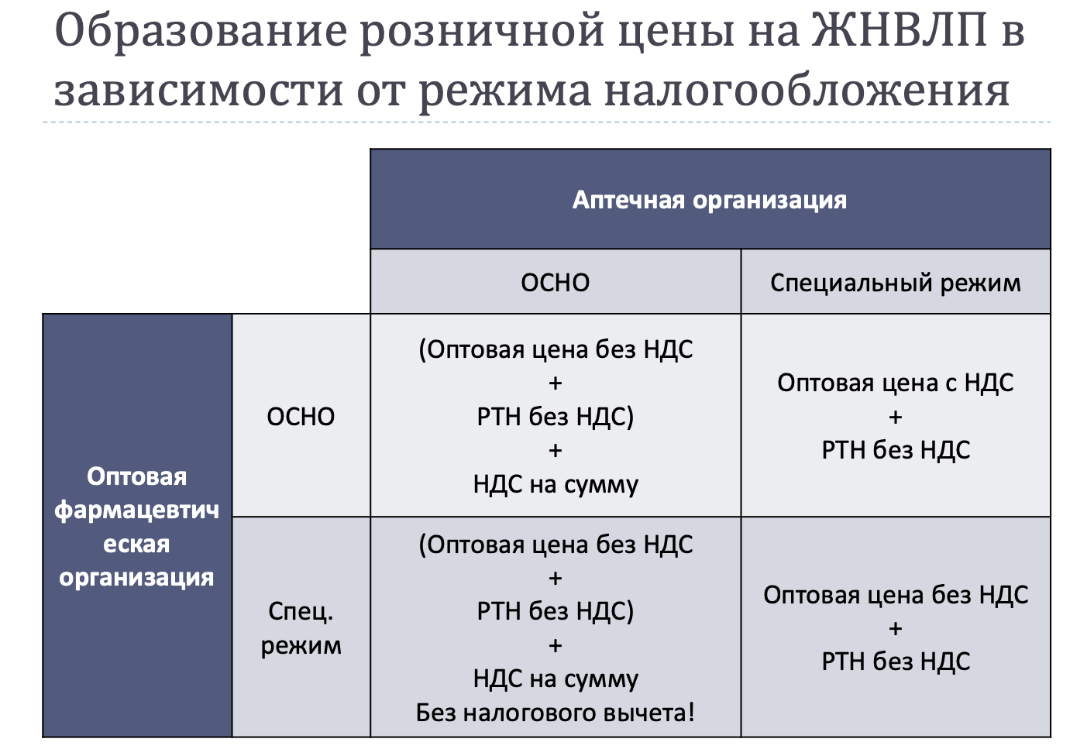
5.Каков порядок формирования розничной цены на Трамадол?
Нормативные документы.
-
Постановление Правительства РФ от 29.10.2010 г. № 865 «О государственном регулировании цен на ЛП, включѐнные в перечень ЖНВЛП». -
Постановление Правительства РФ от 08.08.2009 г. № 654 «О совершенствовании государственного регулирования цен на ЛП, включѐнные в перечень ЖНВЛП» -
Распоряжение Правительства РФ 2406р «Об утверждении перечня ЖНВЛП». -
Действующими Правилами установления предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам производителей на ЛП, включѐнные в перечень ЖНВЛП, в субъектах РФ, утверждѐнных ПП РФ от 29.10.2010 г. № 865, предусмотрен расчѐт оптовой и (или) розничной надбавки к фактической отпускной цене производителя на ЖНВЛП без НДС. -
В связи с этим: ОСНО-общая система налогообложения; РТН-розничная торг надбавка
СИТУАЦИОННАЯ ЗАДАЧА № 64
Основная часть
При контроле за хранением наркотических средств, требующих защиты от повышенной температуры, в аптечной организации было установлено, что «Омнопон» ампулы и «Промедол» таблетки хранятся в сейфе на одной полке в технически укрепленном помещении. В том же сейфе хранились ампулы «Промедола» с истекшим сроком годности.
Вопросы:
1.Какие нарушения при организации хранения наркотических средств Вы заметили?
В соответствии с Приказом МЗ РФ от 24 июля 2015 г. N 484н «Об утверждении специальных требований к условиям хранения НС и ПВ, зарегистрированных в установленном порядке в качестве ЛС, предназначенных для мед. применения в аптечных, медицинских, научно-исследовательских, образовательных организациях и организациях оптовой торговли ЛС»
В аптечной организации НС для парентерального и внутреннего применения должны храниться раздельно, на отдельной полке или в отдельном отделении сейфа или металлического шкафа. В аптечных организациях на внутренних сторонах дверец сейфов или металлических шкафов, в которых осуществляется хранение НС, должны вывешиваться списки хранящихся НС с указанием их высших разовых и высших суточных доз.
Хранение НС и ПВ, требующих защиты от повышенной температуры (в данном случае Омнопон, который следует хранить при температуре не выше 15°С), в аптечных организациях осуществляется в помещениях, специально оборудованных инженерными и техническими средствами охраны в запирающихся холодильниках или в специальной зоне для размещения холодильников, отделѐнной от основного места хранения металлической решѐткой с запирающейся решѐтчатой дверью. Места хранения НС и ПВ, требующих защиты от повышенной температуры (холодильник), необходимо оборудовать приборами для регистрации температуры.

