Файл: Экзамен по химии. 1 семестр. Теория химического строения органических соединений А. М. Бутлерова. Основные положения теории химического строения.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.04.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Экзамен по химии. 1 семестр.
1. Теория химического строения органических соединений А.М. Бутлерова. Основные положения теории химического строения.
Первое положение: Атомы в молекулах органических веществ соединены между собой в строго определенной последовательности согласно их валентности.
Второе положение: Свойства веществ зависят не только от качественного и количественного состава вещества, но и от порядка расположения атомов в молекуле (явление изомерии).
Третье положение: Свойства органических веществ зависят не только от состава вещества и порядка соединения атомов, но и от взаимного влияния атомов друг на друга.
2. Классификация органических реакций: реакции замещения, разложения.
1. Реакции замещения – реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов.
а) радикальное замещение
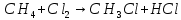 неполное замещение
неполное замещение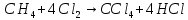 полное замещение
полное замещениеб) электрофильное замещение
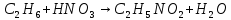 (нитроэтан)
(нитроэтан)в) нуклеофильное замещение
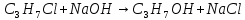 (хлорпропан → пропанол)
(хлорпропан → пропанол)2. Реакции разложения – реакции образования новых веществ более простого строения.
а) полное
C
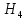 → C + 2
→ C + 2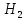
б) неполное
2C
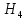 →
→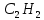 + 3
+ 3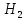
в) крекинг
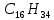 →
→ 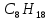 +
+ 
3. Классификация органических реакций: реакции присоединения, отщепления.
3. Реакции присоединения – реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну.
а) гидрирование (+
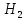 )
)

H к наиболее гидрированному
OH к наименее гидрированному
б) галогенирование (+галогены)
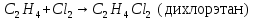
в) гидратация (
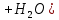
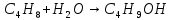

H к наиболее гидрированному
Сl к наименее гидрированному
г) гидрогалогенирование
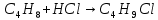
д) полимеризация – соединение многих молекул низкомолекулярного вещества (мономеров) в крупные молекулы (макромолекулы) полимеры.
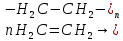
е) окисление по типу присоединения




OH
OH
H2C=CH–CH3 + [O] + HOH → CH2–CH–CH3
4. Реакции отщепления – реакции, в результате которых из молекулы одного вещества образуются молекулы нескольких новых веществ.
а) дегидрирование (-
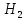 )
)C3H8 → C3H6 + H2
б) дегидратация (
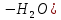
C2H5OH
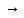 C2H4↑ + H2O
C2H4↑ + H2Oв) дегидрогалогенирование
C3H7Cl + KOH
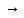 C3H6 + KCl + H2O
C3H6 + KCl + H2Oг) дегалогенирование
C2H4Cl2 + Zn
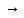 C2H4 + ZnCl2
C2H4 + ZnCl2Нет в вопросах!
5. Реакции поликонденсации
– реакции получения полимеров с выделением побочного продукта (H2O, NH3, HCl).






R
R
NH2 – CH – COOH + NH2–CH–COOH → NH2–CH–CO–NH–CH–COOH + H2O


R
R
6. Реакции изомеризации – получение изомеров.
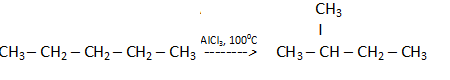
4. Классификация органических соединений по строению.
Ациклические:
1) Насыщенные (предельные)
- Алканы CnH2n+2 H3C – CH3 (одинарная связь)
2) Ненасыщенные (непредельные)
- Алкены CnH2n H2С = СH2 (двойная связь)
- Алкины CnH2n-2 HС ≡ СH (тройная связь)
- Алкадиены CnH2n H2С = С = СH2 (две двойные связи)


CH2
Циклические:


CH2
CH2
1) Циклоалканы СnH2n (C3H6 - циклопропан)
2) Арены CnH2n-6 (C6H6 - бензол)
3) Гетероциклические
5. Классификация органических соединений по наличию функциональной группы.
Кислородсодержащие:
- Спирты
R – OH
- Альдегиды
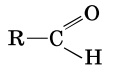 (RCHO)
(RCHO)- Кетоны
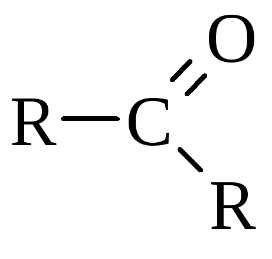
- Карбоновые кислоты
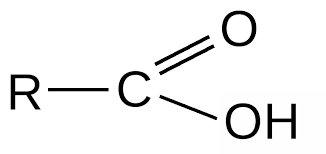 (RCOOH)
(RCOOH)- Эфиры:
1. Простые эфиры
R – O – R
2. Сложные эфиры
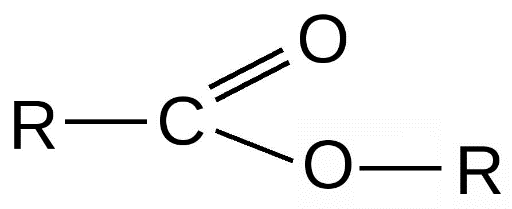
Азотсодержащие:
- Амины
R – NH2
- Аминокислоты
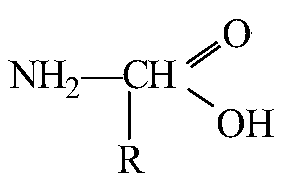
6. Строение атома углерода. Первое валентное состояние атома углерода
(sp3–гибридизация).
CH4 - метан
В процессе sp3-гибридизации происходит смешение одной s- и трёх p-орбиталей. В результате образуются четыре одинаковые гибридные орбитали, имеющие форму неправильного друг друга восьмёрки, расположенные относительно под углом 109°28', при котором достигается их максимальное удаление друг от друга.
Таким образом, атом углерода образует одинаковые четыре σ-связи, которые к углам тетраэдра, в котором находится атом углерода.
Вsp3-гибридном состоянии находятся все атомы углерода в метане и остальных алканах, в алмазе.
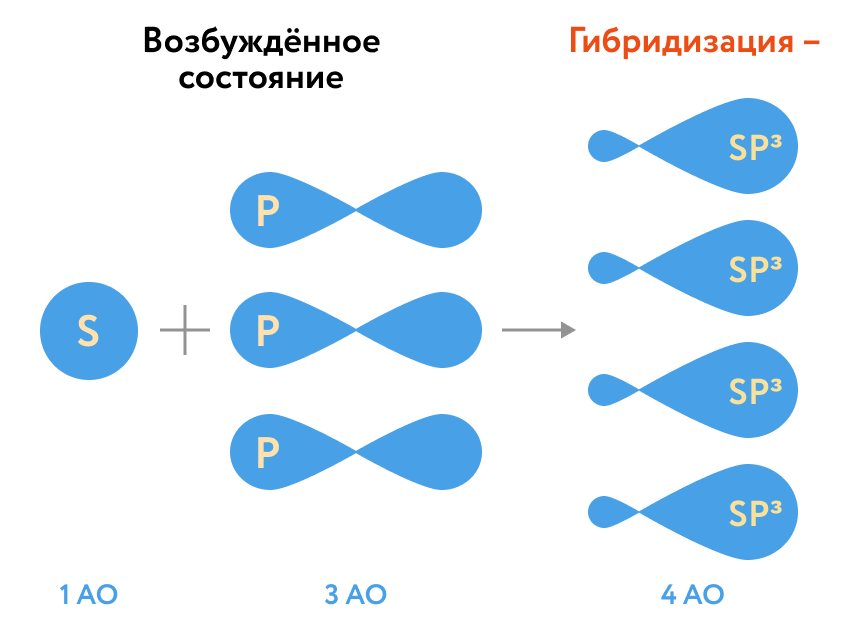
sp3- гибридизация атома углерода в молекуле, если он связан с 4-мя атомами.
7. Строение атома углерода. Второе валентное состояние атома углерода
(sp2–гибридизация).
С2H4 – этилен
В процессе sp2 -гибридизации происходит смешение одной s- и двух p-орбиталей. Образуются три одинаковые гибридные орбитали, расположенные относительно друг друга под углом 120°C, лежат в одной плоскости и перемещении к вершинам треугольника. Атом углерода образует три σ- и одну π-связь, которая перпендикулярна плоскости σ-связь. В sp2–гибридном состоянии находятся атомы углерода в графите, бензоле, атомы углерода, соединённые двойными связями, в алкенах, атом углерода, связанный с карбонильным кислородом.
sp2-гибридизация атома углерода при связях с 3-мя атомами.
8. Строение атома углерода. Третье валентное состояние атома углерода
(sp–гибридизация).
C₂H₂ - ацетилен
В процессе sp–гибридизациипроисходит смешение одной s- и одной р-орбитали. Образуются две одинаковые гибридные орбитали, которые расположены относительно друг друга под углом 180°C и лежат на одной линии. Атом образует две σ-связи и две π-связи, расположенные в двух перпендикулярных плоскостях. В sp-гибридном состоянии находятся атомы углерода, соединённые тройной связью в молекулах алкинов, атом углерода в оксиде углерода (IV) и др.
sp-гибридизация атома углерода, если он образует связи с 2-мя атомами.
9. Алканы. Определение, изомерия и номенклатура алканов.
Алканы – предельные углеводороды (парафины), в молекулах которых атомы углерода связаны между собой одинарной сигма связью с общей формулой CnH2n+2.
C6H14 – гексан
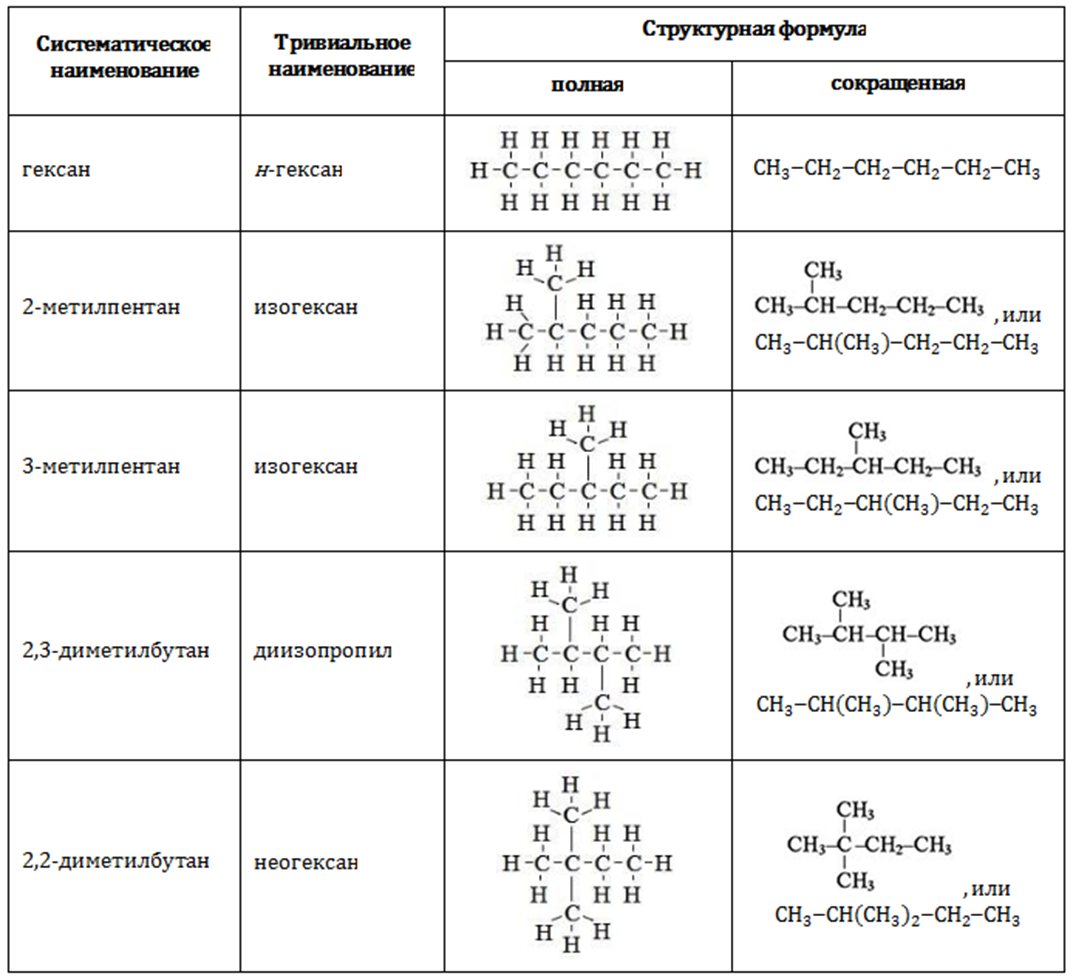
10. Алканы. Определение, состав и получение алканов.
Получение в промышленности.
-
Выделением из природных источников нефти и газа. -
Гидрированием алгенов.
СН2=CH2+H2 → CH3–CH3
-
Крекингом нефтепродуктов.
C16H 34→ C8H16+C8H18
-
Гидрированием угля.
nC+nH2 → CnH2n+2
Получение в лаборатории.
-
Гидрированием алкенов или алкинов.
СН2=CH2+H2 → CH3–CH3
-
Реакция Вюрца – из галогенпроизводных соединений с натрием.
СН3Сl+CH3Cl+2Na → C2H6+2NaCl
C2H5Cl+C3H7Cl+2Na → C5H12+2NaCl
-
Сплавлением солей карбоновых кислот со щелочами.
CH3COONa+NaOH → CH4+Na2CO3
-
Гидролиз карбидов (+H2O)
Al4C3+12H2O → 3CH4+4Al(OH)3
-
Реакция восстановления галогенпроизводных соединений.
СH3Cl+H2 → CH4+HCl
11. Алканы. Определение, химические свойства алканов.
1) Реакция замещения c разрывом связи С-H
CH4 + Cl2 → CH3Cl + HCl
СH3Cl+Cl2 → CH2Cl2+HCl
2) Реакция нитрирования (реакция Коновалова)
CH4 + HNO3 → CH3NO2 + H2O
3) Реакция сульфирования с высшими алканами (c серной кислотой)
C17H36 + H2SO4 → C17H35SO3H + H2O
4) Реакции отщепления
а) Реакция дегидрирования
C2H6→C2H4+H2
б) Термическое разложение- крекинг
C16H34→C8H18+C8H16
в) Пиролиз метана
2CH4→ [1500°] C2H2+3H2
5) Реакция изомеризации
6) Реакции окисления
a. Реакция горения
CH4+2O2→CO2+H2O
2C2H6+7O2→4CO2+6H2O
б. При недостатке кислорода металл образует альдегид.
CH4+O2→HCHO+H2O
в. Конверсия метана
CH4+H2О → CO2+3H2и
12. Алкены. Определение, изомерия и номенклатура алкенов.
Алкены (этилены) – вещества, в молекулах которых атомы углерода связаны между собой двойной связью, с общей формулой C


