Файл: Экзамен по химии. 1 семестр. Теория химического строения органических соединений А. М. Бутлерова. Основные положения теории химического строения.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.04.2024
Просмотров: 14
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
nH2n. Гомологический ряд начинается с этена (C2H4).
C5H10 - пентен

13. Алкены. Определение, состав и получение алкенов.
1) В лаборатории этилен получают реакцией дегидратации этанола:
t, H2SO4 (к)
CH3-CH2-OH → CH2=CH2+H2O
C2H5OH → C2H4+H2O
2) В промышленности получают реакцией дегидрирования алканов:
C2H6 → C2H4+H2
14. Алкены. Определение, химические свойства алкенов.
I. Реакции присоединения
1. Гидрирование.
CH2=CH-CH3+H-H → CH3-CH2-CH3
C3H6 + H2 → C3H8
2. Галогенирование.
CH2=CH-CH3+Br-Br → CH2Br-CHBr-CH3
C3H6 + Br2 → CH3H6Br2
3. Гидрогалогенирование.
CH2=CH-CH3+H-Cl → CH3-CHCl-CH3
C3H6 + HCl → C3H7Cl
4. Гидратация.
C2H4 + H2O → C2H5OH
5. Полимеризация.
nH2С= CH2 → n(– H2C– H2C–)
II. Реакции окисления
1. Горение
C2H4 + 3O2 → 2CO2 + 2H2O
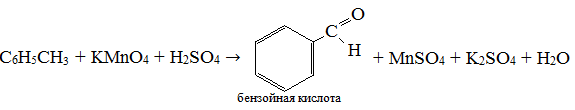
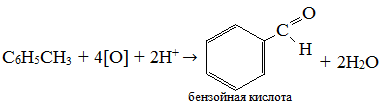
2. Качественная реакция на непредельные углеводороды – обесцвечивание раствора перманганата калия (KMnO4).
CH2=CH2 + [O] + H2O →KMnO4 CH2OH – CH2OH этиленгликоль
15. Алкадиены. Определение, изомерия и номенклатура алкадиенов.
Алкадиены – вещества, в молекулах которых атомы углерода связаны между собой двумя двойными связями, с общей формулой СnH2n-2.
С5H8
H2C=C=CH-CH2-CH3 пентадиен-1,2
H3C-CH=C=CH-CH3 пентадиен-2,3
H2C=CH-CH2-CH=CH2 пентадиен-1,4
16. Алкадиены. Определение, состав и получение алкадиенов.
7. Алкины. Определение, состав и химические свойства алкинов.
Алкины (ацетиленовые) – вещества, в молекулах которых атомы углерода связаны между собой тройной связью, с общей формулой CnH2n-2.
I. Реакции присоединения
1. Гидрирование
C3H4 + H2 → C3H6
2. Галогенирование
C2H2 + Br2 → C2H2Br2
3. Гидратация
C2H2 + H2O →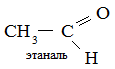
4. Гидрогалогенирование
C3H4 + HCl → C3H5Cl
5. Полимеризация
3C2H2 → C6H6 (бензол)
II. Реакции окисления
1. Горение
2C2H2 + 5O2 → 4CO2 + 2H2O
8. Арены. Определение, состав и химические свойства аренов.
Углеводороды, в молекулах которых содержится бензольное кольцо, называют ароматическими углеводородами (или аренами).
R – бензол
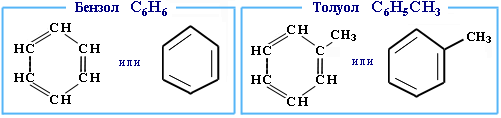
Изомерия:
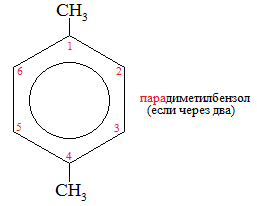
I. Реакции замещения
1. Реакция галогенирования
C6H6 + Br2 → FeBr3 C6H5Br + HBr
2. Реакция нитрирования
C6H6 + HNO3 →H2SO4 (к), t H2O + C6H5 – NO2
3. Реакция сульфирования
C6H6 + H2SO4 →H2SO4 (к), t H2O + C6H5 – SO3H
4. Реакция алкилирования (атом водорода на алкильный радикал)
C6H6 + CH3Cl →AlCl3 C6H5CH3 + HCl
II. Реакции присоединения
1. Гидрирование
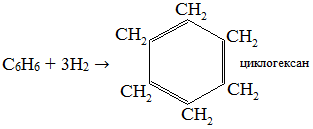
2. Галогенирование
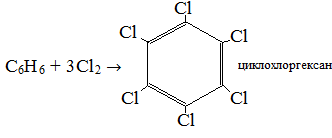
III. Реакции окисления
1. Горение
2C6H6 + 5O2 → 12CO2 + 6H2O
2.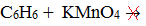
9. Природные источники углеводородов.
Природный газ встречается повсеместно. Нефть и попутный газ залегают в недрах Земли между породами. Над нефтью находятся попутные газы.
Каменный уголь. Полезное ископаемое, образовалось из отмерших остатков растений.
10. Нефть, нахождение в природе, состав и свойства нефти, переработка нефти.
Нефть и попутный газ залегают в недрах Земли между породами. Нефть – маслянистая жидкость темно-бурого цвета, практически нерастворима в воде. Легче воды. В ней 900 различных соединений. Основные – алканы от 6 до 50 атомов С. Необработанная нефть – сырая. Она проходит ректификацию (разделение на отдельные компоненты). Нефть подают в нижнюю часть колонны, нагревают до 340-360. Газообразные углеводороды поднимаются вверх и расслаиваются по тарелкам. Чем выше тарелка, тем ниже темп кипения.
11. Природный и попутный нефтяные газы, каменный уголь. Их практическое использование.
Природный газ – эффективное и дешевое топливо для ТЭС, котельных установок, доменных и стекловаренных печей. Фракция попутного газа, содержащая пропан, используется как топливо для двигателей, работающих на сжиженном газе. Сухой газ – топливо и химическое сырье.
12. Спирты и фенолы. Определение, состав и химические свойства спиртов и фенолов.
Спирты – органические вещества, состоящие из одной или нескольких гидроксильных групп, соединенных с водородным радикалом.
R – OH (_ол)
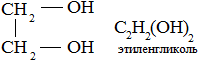
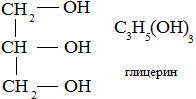
Фенолы – производные ароматических углеводородов, содержащие в молекуле гидроксильную группу, соединенную с бензольным кольцом.
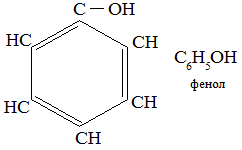
I. Кислотные свойства
1. Спирты взаимодействуют с щелочными и щелочноземельными металлами.
2CH3OH + 2Na → 2CH3ONa + H2
2. Многоатомные спирты и фенол взаимодействуют с щелочами
C6H5OH + 2NaOH → C6H5ONa + 2H2O
3. Многоатомные спирты взаимодействуют с нерастворимыми основаниями – качественная реакция на глицерин взаимодействием Cu(OH)2
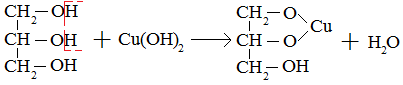
II. Реакции замещения
1. Взаимодействие спиртов с галогенводородными соединениями.
C2H5OH + HBr → C2H5Br + H2O
2. Взаимодействие спиртов с карбоновыми кислотами

метиловый эфир уксусной кислоты
CH3OH + CH3COOH → CH3COOCH3 + H2O
3. Взаимодействие спиртов и фенола с неорганическими кислотами
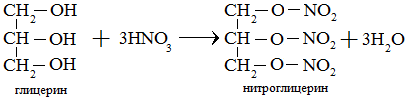
III. Реакции дегидратации спиртов
1. C2H5OH → C2H4 + H2O
2. CH3OH + CH3OH → CH3 – O – CH3 + H2O
IV. Реакциигорения
1. C2H5OH + 3O2 → 2CO2 + 3H2O
V. Качественная реакция на фенол – взаимодействие с FeCl3
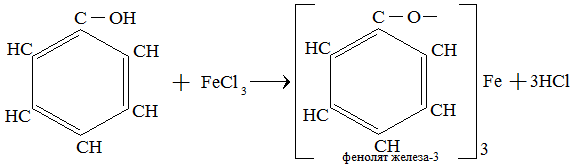
13. Альдегиды. Определение, состав и химические свойства альдегидов.
Альдегиды – органические вещества, молекулы которых содержат альдегидную группу CHO, общая формула RCHO.
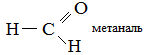
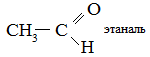
1. Реакция серебряного зеркала – качественная реакция на альдегиды.
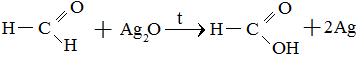
2. Реакция с Cu(OH)2
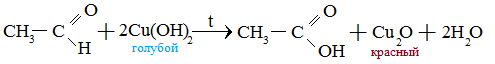
3. Реакция гидрирования с образованием спиртов
HCHO + H2 → CH3OH
14. Карбоновые кислоты. Определение, состав и химические свойства карбоновых кислот.
Карбоновые кислоты – сложные органические кислородсодержащие вещества, молекулы которых содержат карбоксильную группу COOH, соединенную с углеводородным радикалом. Общая формула RCOOH.
HCOOH – метановая (муравьиная) кислота
CH3COOH – этановая (уксусная) кислота
C2H5COOH – пропановая (пропионовая) кислота
1. Диссоциируют на ионы
CH3COOH → CH2COO- + H+
2. Взаимодействуют с активными металлами
2CH3COOH + 2Na → 2CH3COONa + H2
3. Взаимодействуют с оксидами металлов
2CH3COOH + MgO → (CH3
COO)2Mg + H2O
4. Взаимодействуют с основаниями
2CH3COOH + Zn(OH)2 → (CH2COO)Zn + 2H2O
5. Взаимодействуютссолямислабыхкислот
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
6. Взаимодействуют со спиртами с образованием сложных эфиров
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
7. Реакция галогенирования.
CH3COOH + Cl2 → CH2ClCOOH + HCl
Углеводы – сложные органические вещества с общей формулой Cx(H2O)y
Классификация:
- Простые (моносахариды)
- Сложные (дисахариды и т.д.)
Моносахариды – простые углеводы, которые не способны гидролизоваться с образованием более простых углеводов, с общей формулой CnH2*nOn
CH4
1. Реакция галогенирования
CH4 + Cl2 → CH3Cl + HCl
2. Реакция нитрирования (реакция Коновалова)
CH4 + HNO3 → CH3NO2 + H2O
3. Пиролиз метана
2CH4→ [1500°] C2H2+3H2
4. Реакция горения
CH4+2O2→CO2+H2O
5. При недостатке кислорода металл образует альдегид.
CH4+O2→HCHO+H2O
6. Конверсия метана
CH4+H2О → CO2+3H2
C2H6
1. Реакция галогенирования
C2H6 + Cl2 → CH5Cl + HCl
2. Реакция нитрирования (реакция Коновалова)
C2H6 + HNO3 → CH5NO2 + H2O
3. Реакция гидрирования
C2
C5H10 - пентен

13. Алкены. Определение, состав и получение алкенов.
1) В лаборатории этилен получают реакцией дегидратации этанола:
t, H2SO4 (к)
CH3-CH2-OH → CH2=CH2+H2O
C2H5OH → C2H4+H2O
2) В промышленности получают реакцией дегидрирования алканов:
C2H6 → C2H4+H2
14. Алкены. Определение, химические свойства алкенов.
I. Реакции присоединения
1. Гидрирование.
CH2=CH-CH3+H-H → CH3-CH2-CH3
C3H6 + H2 → C3H8
2. Галогенирование.
CH2=CH-CH3+Br-Br → CH2Br-CHBr-CH3
C3H6 + Br2 → CH3H6Br2
3. Гидрогалогенирование.
CH2=CH-CH3+H-Cl → CH3-CHCl-CH3
C3H6 + HCl → C3H7Cl
4. Гидратация.
C2H4 + H2O → C2H5OH
5. Полимеризация.
nH2С= CH2 → n(– H2C– H2C–)
II. Реакции окисления
1. Горение
C2H4 + 3O2 → 2CO2 + 2H2O
2. Качественная реакция на непредельные углеводороды – обесцвечивание раствора перманганата калия (KMnO4).
CH2=CH2 + [O] + H2O →KMnO4 CH2OH – CH2OH этиленгликоль
15. Алкадиены. Определение, изомерия и номенклатура алкадиенов.
Алкадиены – вещества, в молекулах которых атомы углерода связаны между собой двумя двойными связями, с общей формулой СnH2n-2.
С5H8
H2C=C=CH-CH2-CH3 пентадиен-1,2
H3C-CH=C=CH-CH3 пентадиен-2,3
H2C=CH-CH2-CH=CH2 пентадиен-1,4
16. Алкадиены. Определение, состав и получение алкадиенов.
7. Алкины. Определение, состав и химические свойства алкинов.
Алкины (ацетиленовые) – вещества, в молекулах которых атомы углерода связаны между собой тройной связью, с общей формулой CnH2n-2.
I. Реакции присоединения
1. Гидрирование
C3H4 + H2 → C3H6
2. Галогенирование
C2H2 + Br2 → C2H2Br2
3. Гидратация
C2H2 + H2O →
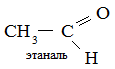
4. Гидрогалогенирование
C3H4 + HCl → C3H5Cl
5. Полимеризация
3C2H2 → C6H6 (бензол)
II. Реакции окисления
1. Горение
2C2H2 + 5O2 → 4CO2 + 2H2O
8. Арены. Определение, состав и химические свойства аренов.
Углеводороды, в молекулах которых содержится бензольное кольцо, называют ароматическими углеводородами (или аренами).
R – бензол

Изомерия:



I. Реакции замещения
1. Реакция галогенирования
C6H6 + Br2 → FeBr3 C6H5Br + HBr
2. Реакция нитрирования
C6H6 + HNO3 →H2SO4 (к), t H2O + C6H5 – NO2
3. Реакция сульфирования
C6H6 + H2SO4 →H2SO4 (к), t H2O + C6H5 – SO3H
4. Реакция алкилирования (атом водорода на алкильный радикал)
C6H6 + CH3Cl →AlCl3 C6H5CH3 + HCl
II. Реакции присоединения
1. Гидрирование

2. Галогенирование

III. Реакции окисления
1. Горение
2C6H6 + 5O2 → 12CO2 + 6H2O
2.


9. Природные источники углеводородов.
Природный газ встречается повсеместно. Нефть и попутный газ залегают в недрах Земли между породами. Над нефтью находятся попутные газы.
Каменный уголь. Полезное ископаемое, образовалось из отмерших остатков растений.
10. Нефть, нахождение в природе, состав и свойства нефти, переработка нефти.
Нефть и попутный газ залегают в недрах Земли между породами. Нефть – маслянистая жидкость темно-бурого цвета, практически нерастворима в воде. Легче воды. В ней 900 различных соединений. Основные – алканы от 6 до 50 атомов С. Необработанная нефть – сырая. Она проходит ректификацию (разделение на отдельные компоненты). Нефть подают в нижнюю часть колонны, нагревают до 340-360. Газообразные углеводороды поднимаются вверх и расслаиваются по тарелкам. Чем выше тарелка, тем ниже темп кипения.
11. Природный и попутный нефтяные газы, каменный уголь. Их практическое использование.
Природный газ – эффективное и дешевое топливо для ТЭС, котельных установок, доменных и стекловаренных печей. Фракция попутного газа, содержащая пропан, используется как топливо для двигателей, работающих на сжиженном газе. Сухой газ – топливо и химическое сырье.
12. Спирты и фенолы. Определение, состав и химические свойства спиртов и фенолов.
Спирты – органические вещества, состоящие из одной или нескольких гидроксильных групп, соединенных с водородным радикалом.
R – OH (_ол)
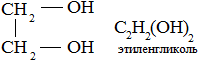
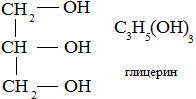
Фенолы – производные ароматических углеводородов, содержащие в молекуле гидроксильную группу, соединенную с бензольным кольцом.

I. Кислотные свойства
1. Спирты взаимодействуют с щелочными и щелочноземельными металлами.
2CH3OH + 2Na → 2CH3ONa + H2
2. Многоатомные спирты и фенол взаимодействуют с щелочами
C6H5OH + 2NaOH → C6H5ONa + 2H2O
3. Многоатомные спирты взаимодействуют с нерастворимыми основаниями – качественная реакция на глицерин взаимодействием Cu(OH)2
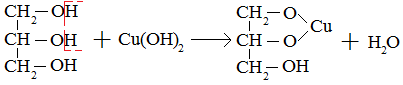
II. Реакции замещения
1. Взаимодействие спиртов с галогенводородными соединениями.
C2H5OH + HBr → C2H5Br + H2O
2. Взаимодействие спиртов с карбоновыми кислотами

метиловый эфир уксусной кислоты
CH3OH + CH3COOH → CH3COOCH3 + H2O
3. Взаимодействие спиртов и фенола с неорганическими кислотами

III. Реакции дегидратации спиртов
1. C2H5OH → C2H4 + H2O
2. CH3OH + CH3OH → CH3 – O – CH3 + H2O
IV. Реакциигорения
1. C2H5OH + 3O2 → 2CO2 + 3H2O
V. Качественная реакция на фенол – взаимодействие с FeCl3

13. Альдегиды. Определение, состав и химические свойства альдегидов.
Альдегиды – органические вещества, молекулы которых содержат альдегидную группу CHO, общая формула RCHO.


1. Реакция серебряного зеркала – качественная реакция на альдегиды.
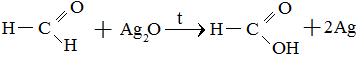
2. Реакция с Cu(OH)2
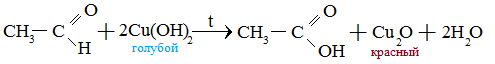
3. Реакция гидрирования с образованием спиртов
HCHO + H2 → CH3OH
14. Карбоновые кислоты. Определение, состав и химические свойства карбоновых кислот.
Карбоновые кислоты – сложные органические кислородсодержащие вещества, молекулы которых содержат карбоксильную группу COOH, соединенную с углеводородным радикалом. Общая формула RCOOH.
HCOOH – метановая (муравьиная) кислота
CH3COOH – этановая (уксусная) кислота
C2H5COOH – пропановая (пропионовая) кислота
1. Диссоциируют на ионы
CH3COOH → CH2COO- + H+
2. Взаимодействуют с активными металлами
2CH3COOH + 2Na → 2CH3COONa + H2
3. Взаимодействуют с оксидами металлов
2CH3COOH + MgO → (CH3
COO)2Mg + H2O
4. Взаимодействуют с основаниями
2CH3COOH + Zn(OH)2 → (CH2COO)Zn + 2H2O
5. Взаимодействуютссолямислабыхкислот
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
6. Взаимодействуют со спиртами с образованием сложных эфиров
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
7. Реакция галогенирования.
CH3COOH + Cl2 → CH2ClCOOH + HCl
-
Сложные эфиры. Определение, состав и химические свойства сложных эфиров.
-
Жиры. Определение, состав и химические свойства жиров.
-
Углеводы. Определение. Классификация, нахождение в природе, получение углеводов.
Углеводы – сложные органические вещества с общей формулой Cx(H2O)y
Классификация:
- Простые (моносахариды)
- Сложные (дисахариды и т.д.)
-
Моносахариды. Определение, состав и химические свойства моносахариды.
Моносахариды – простые углеводы, которые не способны гидролизоваться с образованием более простых углеводов, с общей формулой CnH2*nOn
-
Крахмал. Состав, нахождение в природе и свойства крахмала.
-
Целлюлоза. Состав, нахождение в природе и свойства целлюлозы.
-
Белки. Определение, состав и строение белков.
-
Белки. Определение, функции и свойства белков.
-
Ферменты и витамины.
-
Метан. Состав и химические свойства метана.
CH4
1. Реакция галогенирования
CH4 + Cl2 → CH3Cl + HCl
2. Реакция нитрирования (реакция Коновалова)
CH4 + HNO3 → CH3NO2 + H2O
3. Пиролиз метана
2CH4→ [1500°] C2H2+3H2
4. Реакция горения
CH4+2O2→CO2+H2O
5. При недостатке кислорода металл образует альдегид.
CH4+O2→HCHO+H2O
6. Конверсия метана
CH4+H2О → CO2+3H2
-
Этан. Состав и химические свойства этана.
C2H6
1. Реакция галогенирования
C2H6 + Cl2 → CH5Cl + HCl
2. Реакция нитрирования (реакция Коновалова)
C2H6 + HNO3 → CH5NO2 + H2O
3. Реакция гидрирования
C2


