ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 32
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
11 Современная классификация ферментов. Классы ферментов. Примеры ферментативных реакций каждого класса ферментов.
В основе классификации ферментов лежит специфичность их действия .
Примеры
Лиазы
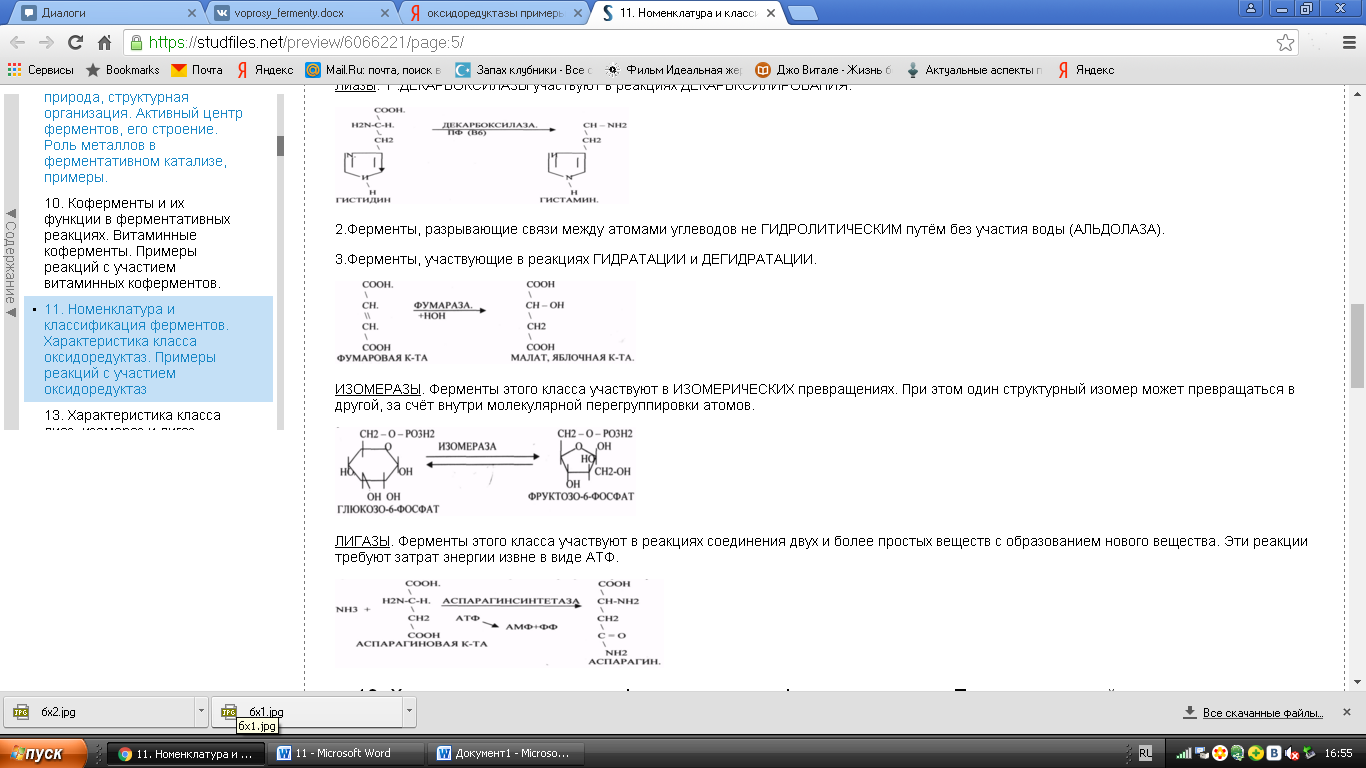
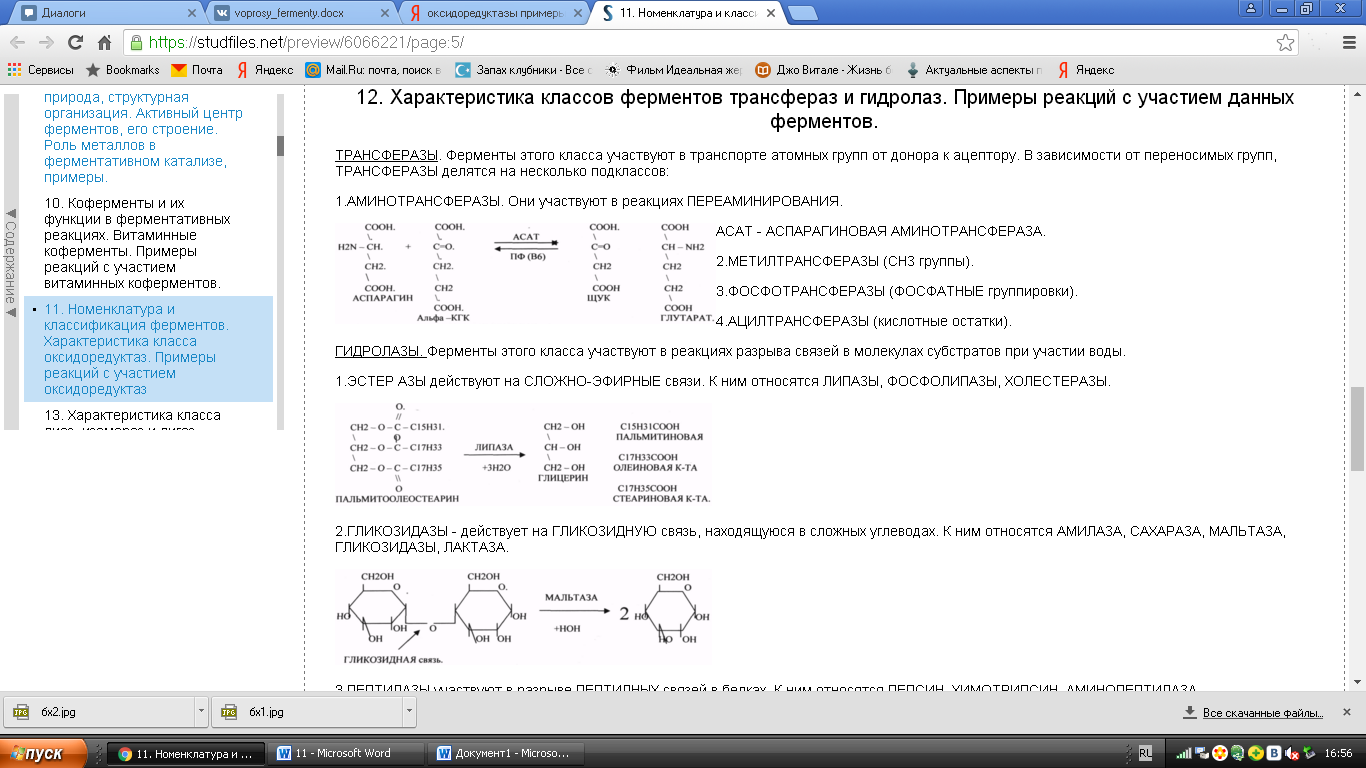
12 Виды специфичности ферментов. Привести примеры.
Субстратная специфичность – когда активный центр ферментов , как и других белков , образован боковыми группами аминокислотных остатков пептидной цепи и структура активного центра фермента комплементарна структуре его субстрата , вследствие чего данный фермент из множества веществ , имеющихся в живой клетке , присоединяет только свой субстрат .
Пример
Структура актив центра фермента гистидазы комплементарна структуре АК гистидина , поэтому возможно образование фермент- субстратного комплекса гистидаза-гистидин
Свойство специфичности пути превращения –когда каждый фермент катализирует не любое из всех возможных химических превращений субстрата , а какое-либо одно .
Например , гистидаза и гистидиндекарбоксилаза имеют одинаковою субстратную специфичность , но катализирует разные превращения гистидина . При действии гистадазы отщепляется аминогруппа , а при действии гистидинкарбоксилазы – карбоксильная группа .
Различают АБСОЛЮТНУЮ и ГРУППОВУЮ специфичность ферментов .
Фермент с абсолютной специфичностью катализирует превращение какого- либо одного субстрата .
Например , фумараза катализирует только реакцию только фумаровой кислоты с водой .
Ферменты с групповой специфичностью катализируют однотипные превращения сходных по строению веществ .
Например , липаза ускоряет гидролиз жиров на глицерин и жирные кислоты .
Стереоспецефичность- пространственная структура стереоизомеров вещества различна , поэтому активный центр фермента , комплементарный одному стереоизомеру , не обязательно будет комплементарен и дрстериоизомерам , поэтому многие ферменты катализируют превращение лишь одного из стереоизомеров.
Например , малеиновая кислота , являющаяся цис-изомером фумаровой кислоты не может быть субстратом фумаразы .
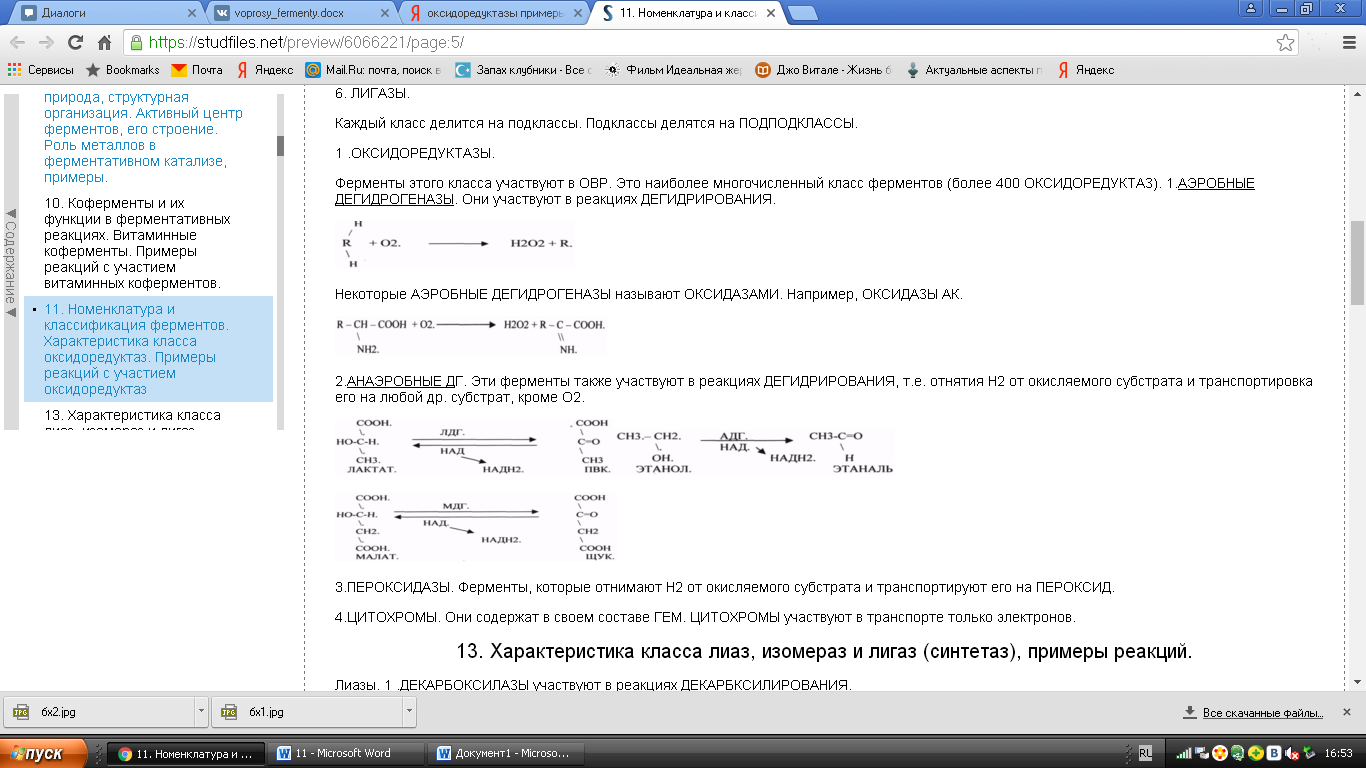
13. Характеристика ферментов, катализирующие окислительно-восстановительные реакции. Показать на примере цитохромоксидазы.
Оксиредуктазы это ферменты, катализирующие реакции окисления и восстановления, т.е. переносэлектронов от донора к акцептору. Окисление представляет собой отнятие атомов водорода от субстрата, а восстановление это присоединение атомов водорода к акцептору.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe2+ в состояние Fe3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Катализирует 4-х электронное восстановление молекулярного кислорода(О2) к воде( Н2о):
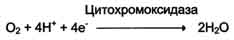
14. Строение молекулы фермента – холофермент, апофермент, кофермент, кофактор, простетическая группа. Какова химическая природа ферментов? Доказательства этой природы. Какова связь между ферментами и витаминами?
Большинство природных ферментов - сложные белки – протеиды. Протеиды состоят из:
Апофермент, белковая часть + кофактор, небелковая часть (коферменты и простетические группы) = холофермент (активный комплекс).
Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента при диссоциации.
Простетическая группа– ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Кроме этого, роль кофактора могут выполнять металлы: Mg2+, Мn2+, Са2+и др.
По химической природе ферменты являются белками и подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза.
Многие витамины входят в состав ферментов в качестве простетической группы.
15. Назвать и объяснить единицы ферментативной активности.
Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете из количества материала, содержащего фермент.
Активность фермента=
В практике обычно используют:
единицы количества вещества- моль(и его производные ммоль, мкмоль),грамм(кг, мг)
единицы времени- минута, час, секунда
единицы массы или объема-грамма(кг, мг),литр(мл)
Активно используются и другие производные - катал(моль/г) и международная единица активности(мкмоль/мин)
16 Дать определение ферментам и привести примеры их действия в организме, в практической деятельности человека и в медицине.
Ферменты - это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства.
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).Креатинкиназа (КК)
которая катализирует реакцию образования креатинфосфата.
Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Ферменты также используются в качестве специфических реактивовдля определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д.
Применение ферментов в качестве лекарственных препаратов активно развивают в следующих направлениях:
• заместительная терапия - использование ферментов в случае их недостаточности;
• элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций.Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает рост этих клеток.
17 Ферменты и неорганические катализаторы, какие имеются сходства и различия?
Сходство ферментов с небиологическими катализаторами заключается в том, что:
Отличия ферментов от небиологических катализаторов заключаются в том, что:
18 Объяснить понятия, относящиеся к ферментам: «энергия активации», «фермент-субстратный комплекс», «специфичность к субстрату» и «специфичность пути реакции», «профермент», «субстрат» и «продукт». Как объясняется специфичность действия ферментов?
Энергией активации– дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата.
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами.
Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения.
Вещество, химическое превращение которого катализируется ферментом – субстрат (S).(Лиганд, взаимодействующий с активным центром фермента, называют субстратом.)
Профермент — неактивный предшественник фермента.
Продукт – новое вещество, которое утрачивает способность удерживаться в активном центре фермента. Образуется в результате химических реакций превращения субстрата.
Специфичность действия фермента – это способность ускорять протекание одной определенной реакции, не влияя на скорость остальных, даже очень похожих. Специфичность ферментов обусловлена их уникальной аминокислотной последовательностью, от которой зависит конформация активного центра, взаимодействующего с компонентами реакции.Высокой специфичность действия ферментов, объясняется гипотезой, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт.
19. Какие заболевания и как можно выявить по измерению активности ферментов?Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму. Пример: альбинизм
20. Строение ферментной молекулы. Какие в ней выделяют участки, какие они несут функции?ферментная молекула-это обычно белковые молекулы или молекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. 1) Энзим ускоряет биохимическую реакцию, но при этом не расходуется. 2) Величина константы равновесия не меняется, а лишь ускоряется достижение этого значения.
В основе классификации ферментов лежит специфичность их действия .
-
Класс ферментов
Оксидоредуктазы - ускоряют реакции окисления - восстановления. -
Трансферазы - ускоряют реакции переноса функциональных групп и молекулярных остатков. -
Гидролазы - ускоряют реакции гидролитического распада. -
Лиазы - ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). -
Изомеразы - ускоряют пространственные или структурные перестройки в пределах одной молекулы. -
Лигазы - ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей.
Примеры

Лиазы


12 Виды специфичности ферментов. Привести примеры.
Субстратная специфичность – когда активный центр ферментов , как и других белков , образован боковыми группами аминокислотных остатков пептидной цепи и структура активного центра фермента комплементарна структуре его субстрата , вследствие чего данный фермент из множества веществ , имеющихся в живой клетке , присоединяет только свой субстрат .
Пример
Структура актив центра фермента гистидазы комплементарна структуре АК гистидина , поэтому возможно образование фермент- субстратного комплекса гистидаза-гистидин
Свойство специфичности пути превращения –когда каждый фермент катализирует не любое из всех возможных химических превращений субстрата , а какое-либо одно .
Например , гистидаза и гистидиндекарбоксилаза имеют одинаковою субстратную специфичность , но катализирует разные превращения гистидина . При действии гистадазы отщепляется аминогруппа , а при действии гистидинкарбоксилазы – карбоксильная группа .
Различают АБСОЛЮТНУЮ и ГРУППОВУЮ специфичность ферментов .
Фермент с абсолютной специфичностью катализирует превращение какого- либо одного субстрата .
Например , фумараза катализирует только реакцию только фумаровой кислоты с водой .
Ферменты с групповой специфичностью катализируют однотипные превращения сходных по строению веществ .
Например , липаза ускоряет гидролиз жиров на глицерин и жирные кислоты .
Стереоспецефичность- пространственная структура стереоизомеров вещества различна , поэтому активный центр фермента , комплементарный одному стереоизомеру , не обязательно будет комплементарен и дрстериоизомерам , поэтому многие ферменты катализируют превращение лишь одного из стереоизомеров.
Например , малеиновая кислота , являющаяся цис-изомером фумаровой кислоты не может быть субстратом фумаразы .
13. Характеристика ферментов, катализирующие окислительно-восстановительные реакции. Показать на примере цитохромоксидазы.
Оксиредуктазы это ферменты, катализирующие реакции окисления и восстановления, т.е. переносэлектронов от донора к акцептору. Окисление представляет собой отнятие атомов водорода от субстрата, а восстановление это присоединение атомов водорода к акцептору.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe2+ в состояние Fe3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Катализирует 4-х электронное восстановление молекулярного кислорода(О2) к воде( Н2о):
14. Строение молекулы фермента – холофермент, апофермент, кофермент, кофактор, простетическая группа. Какова химическая природа ферментов? Доказательства этой природы. Какова связь между ферментами и витаминами?
Большинство природных ферментов - сложные белки – протеиды. Протеиды состоят из:
Апофермент, белковая часть + кофактор, небелковая часть (коферменты и простетические группы) = холофермент (активный комплекс).
Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента при диссоциации.
Простетическая группа– ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Кроме этого, роль кофактора могут выполнять металлы: Mg2+, Мn2+, Са2+и др.
По химической природе ферменты являются белками и подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза.
Многие витамины входят в состав ферментов в качестве простетической группы.
15. Назвать и объяснить единицы ферментативной активности.
Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете из количества материала, содержащего фермент.
Активность фермента=

В практике обычно используют:
единицы количества вещества- моль(и его производные ммоль, мкмоль),грамм(кг, мг)
единицы времени- минута, час, секунда
единицы массы или объема-грамма(кг, мг),литр(мл)
Активно используются и другие производные - катал(моль/г) и международная единица активности(мкмоль/мин)
16 Дать определение ферментам и привести примеры их действия в организме, в практической деятельности человека и в медицине.
Ферменты - это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства.
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).Креатинкиназа (КК)
которая катализирует реакцию образования креатинфосфата.
Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Ферменты также используются в качестве специфических реактивовдля определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д.
Применение ферментов в качестве лекарственных препаратов активно развивают в следующих направлениях:
• заместительная терапия - использование ферментов в случае их недостаточности;
• элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций.Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает рост этих клеток.
17 Ферменты и неорганические катализаторы, какие имеются сходства и различия?
Сходство ферментов с небиологическими катализаторами заключается в том, что:
-
ферменты катализируют энергетически возможные реакции; -
энергия химической системы остаётся постоянной; -
в ходе катализа направление реакции не изменяется; -
ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
-
скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами; -
ферменты обладают высокой специфичностью; -
ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН; -
скорость ферментативной реакции может регулироваться.
18 Объяснить понятия, относящиеся к ферментам: «энергия активации», «фермент-субстратный комплекс», «специфичность к субстрату» и «специфичность пути реакции», «профермент», «субстрат» и «продукт». Как объясняется специфичность действия ферментов?
Энергией активации– дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата.
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами.
Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения.
Вещество, химическое превращение которого катализируется ферментом – субстрат (S).(Лиганд, взаимодействующий с активным центром фермента, называют субстратом.)
Профермент — неактивный предшественник фермента.
Продукт – новое вещество, которое утрачивает способность удерживаться в активном центре фермента. Образуется в результате химических реакций превращения субстрата.
Специфичность действия фермента – это способность ускорять протекание одной определенной реакции, не влияя на скорость остальных, даже очень похожих. Специфичность ферментов обусловлена их уникальной аминокислотной последовательностью, от которой зависит конформация активного центра, взаимодействующего с компонентами реакции.Высокой специфичность действия ферментов, объясняется гипотезой, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт.
19. Какие заболевания и как можно выявить по измерению активности ферментов?Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму. Пример: альбинизм
20. Строение ферментной молекулы. Какие в ней выделяют участки, какие они несут функции?ферментная молекула-это обычно белковые молекулы или молекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. 1) Энзим ускоряет биохимическую реакцию, но при этом не расходуется. 2) Величина константы равновесия не меняется, а лишь ускоряется достижение этого значения.


