ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 34
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Что такое сериновые протеазы, приведите примеры?
Сериновые протеазы — группа ферментов, катализирующие процесс деградации (протеолиз) белков, на составлющие их молекулы α-аминокислот, посредством гидролиза пептидной связи. В поджелудочной железе человека и млекопитающих животных синтезируются сериновыё протеиназы – трипсин, химотрипсины А и В , химотрипсин С
21. Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов. Первое число грубо описывает механизм реакции, катализируемой ферментом:
• EC 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
• EC 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
• EC 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
• EC 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
• EC 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
• EC 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ.
22. Ингибирование ферментативных реакций. Виды ингибирования и механизм действия ингибиторов. Как можно различить виды ингибирования по изменениям параметров Km и Vmax уравнения Михаэлиса-Ментен? Примеры применения ингибиторов.
К ингибиторам относятся вещества, вызывающие снижение активности фермента.
И
 нгибирование
нгибированиеОбратимое Необратимое.
-Связываются с ферментом слабыми -Образуются ковалентные стабильные связи
Н

 ековалентными связями и легко могут отделиться Сюда относят ионы тяжелых Ме(Hg).
ековалентными связями и легко могут отделиться Сюда относят ионы тяжелых Ме(Hg).Конкурентные Неконкурентные
-вещ-ва имеющие структуру, - Вещество не похоже на субстра. Связываются не с
Похожую на субстрат. Такое активным центром, а в другом месте молекулы
Ингибирование основано на фермента.
Связывание ингибитора с активным
Центром.
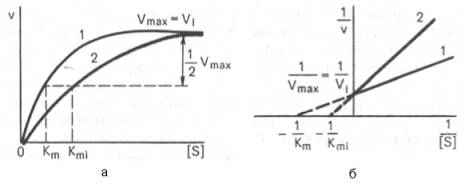
А) При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax
Б) При неконкурентном ингибировании (рис. 4.22) ингибитор снижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании.
С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями синильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга.
2
V
При повышении температуры до 40 градусов, скорость реакции увеличивается, а затем, при еще более повышенной температуре происходит тепловая денатурация и скорость реакции уменьшается.
3)График зависимости скорости ферментативной реакции от температуры. И объяснить его.
Опт. t

t


Тепловая
денатурация
2
При постоянной концентрации субстрата, будет увеличиваться и скорость и концентрация действующего энзима. График имеет прямопропорциональную зависимость.
4) График зависимости скорости ферментативной реакции от концентрации действующего энзима. Объяснить его.
V

[E]

При [S] const.
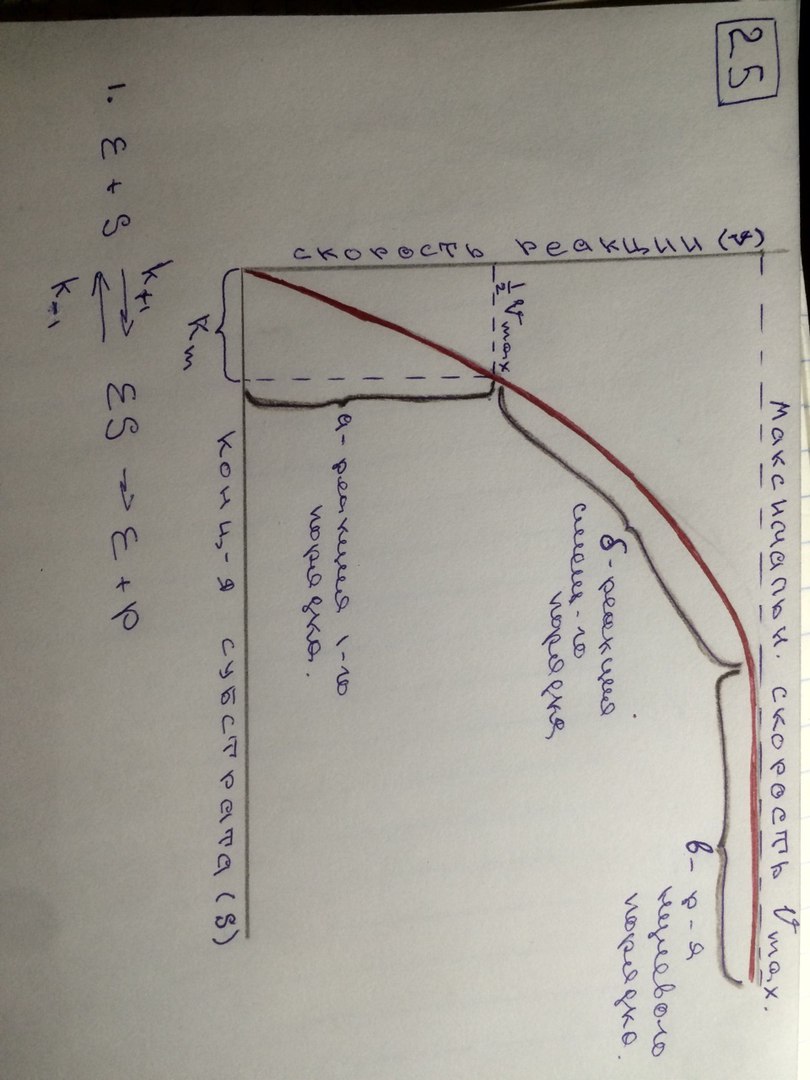
25. График зависимости скорости ферментативной реакции от концентрации субстрата. Объяснить.
Важной особенностью ферментативных реакций, связанных с явлением насыщения фермента субстратом является то,что при низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (см рисунок) является почти линейной и это есть реакция первого порядка (скорость реакции S -> P(продукт)прямо пропорциональна концентрации субстрата).
При высокой концентрации субстрата скорость реакции максимальна, становится постоянной и не зависит от концентрации субстрата. Реакция соответствует реакции нулевого порядка (полное насыщение фермента субстратом) и определяется концентрацией фермента.
Также имеются реакции второго порядка, их скорости пропорциональны произведению концентраций двух реагирующих веществ. При нарушении этой пропорциональности возникает реакция смешанного порядка (На рисунке "б").
При постоянной концентрации фермента скорость реакции увеличивается, достигая максимума ( см рис ), тогда дальнейшее увеличение количества субстрата почти не оказывает влияния на скорость ферментативной реакции. То есть субстрат находится в избытке и фермент насыщен полностью, значит все молекулы фермента связаны с субстратом.
А фермент-это одна из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который потом распадается на продукт и свободный фермент (см реакцию 1)
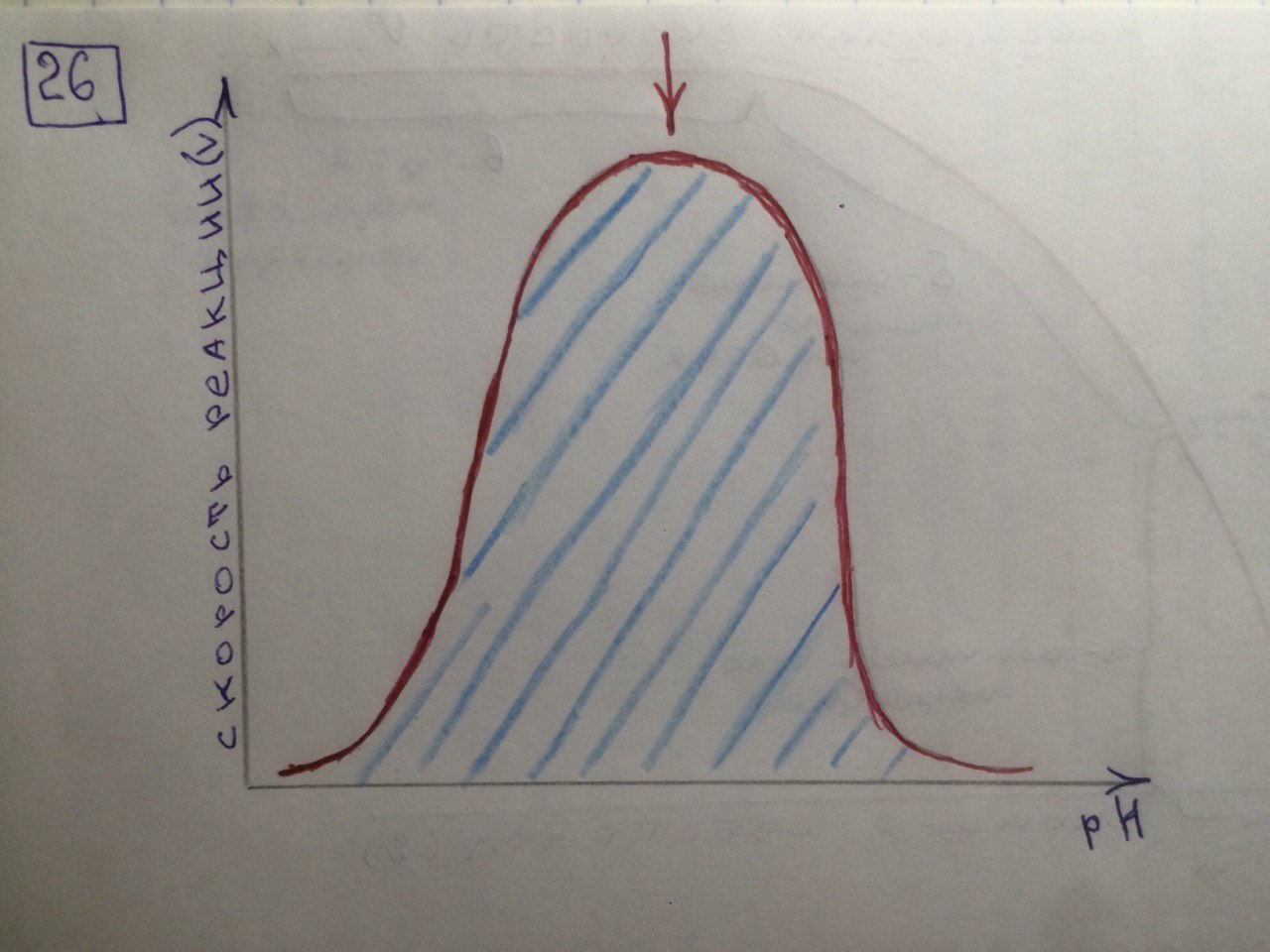
26. График зависимости скорости ферментативной реакции от рН среды. Объяснить.
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Обычно ферменты более активны в пределах зоны концентрации ионов водорода (узкая зона), соответствующей значениям pH среды 6,0-8,0. На графике представлена колоколообразной формы кривая, где имеется опр точка, где фермент проявляет наибольшую активность-точка оптимума (стрелочка на рисунке).
***Влияние изменений pH среды на фермент заключается в воздействии на состояние и степень ионизации кислотных и основных групп ( COOH; SH группы цистеина,NH2 гр лизина и др.). При резких сдвигах от оптимума pH среды ферменты могут подвергаться конфирмационным изменениям и это приведёт к потере активности из за денатурации или изменения заряда молекулы фермента. При разных значениях pH среды активный центр фермента может находиться в частично ионизированной или неионизированной форме, а это сказывается на третичной структуре белка, а значит и на формировании активного фермент-субстратного комплекса ( смвопр 25).
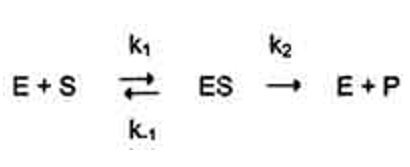
· 27 уравнение ферментативной кинетики - уравнение Михаэлиса-Ментен, привести график к нему и уравнение катализируемой химической реакции. Объяснить, что означают входящие в него величины, для чего служит это уравнение.
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен.
Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
Уравнение имеет вид:
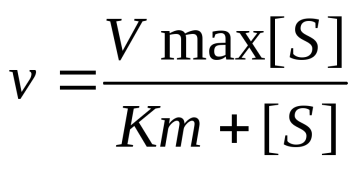
где
-
v – наблюдаемая скорость реакции при данной концентрации субстрата [S] -
Ks – константа Михаэлиса. По определению , где к-1 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, к1 есть константа скорости реакции образования фермент-субстратного комплекса и к2 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной
, где к-1 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, к1 есть константа скорости реакции образования фермент-субстратного комплекса и к2 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной -
Vmax – максимальная скорость реакции при полном насыщении фермента субстратом
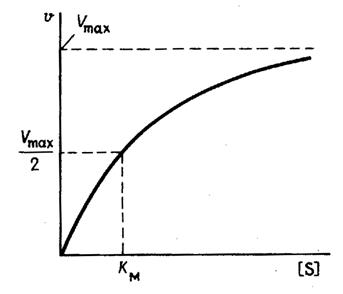
Км – характеризует сродство фермента к субстрату: чем меньше значение К.М., тем сильнее связывание фермента с субстратом. Определение константы Михаэлиса имеет важное значение при выяснении механизма действия эффекторов на активность ферментов
28. Формула восстановленного KoQ (убихинона). Какова его роль в митохондриальном окислении? К какому классу веществ относится КоQ?
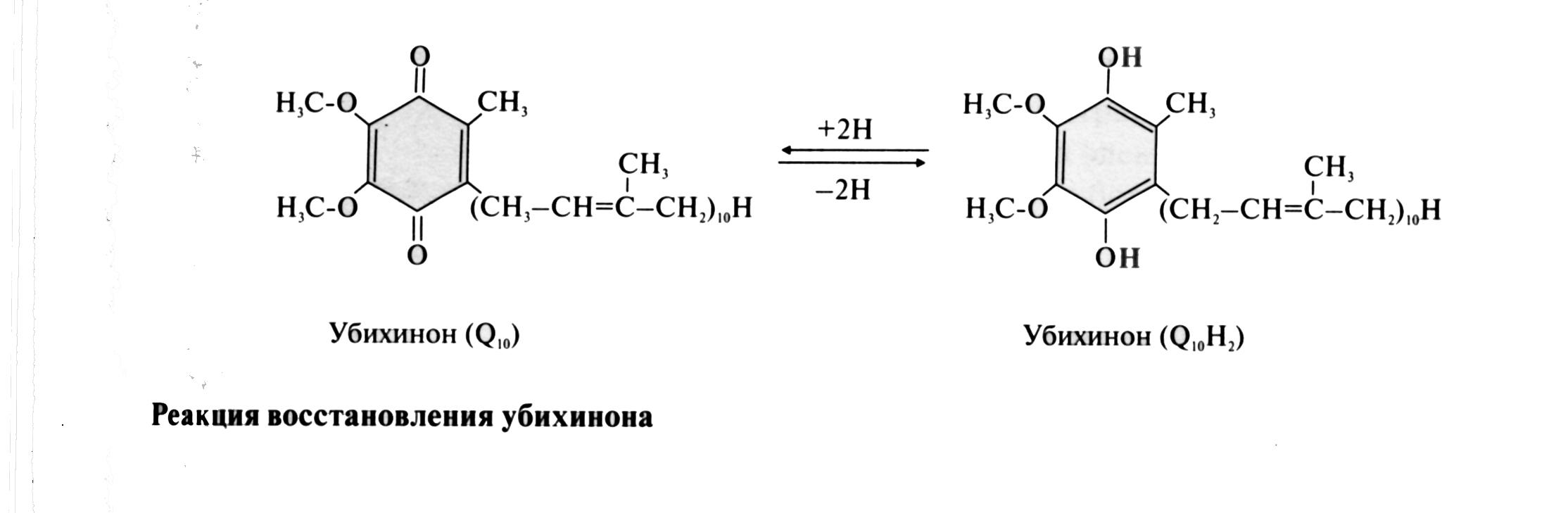
Убихиноны — это жирорастворимые коферменты, представленные преимущественно в митохондриях эукариотических клеток. Убихинон является компонентом цепи переноса электронов и принимает участие в окислительном фосфорилировании. Функции убихинола как переносчика электронов и антиоксиданта основаны на возможности отдавать и вновь присоединять два электрона,окисляясь до убихинона и восстанавливаясь до убихинола
29.
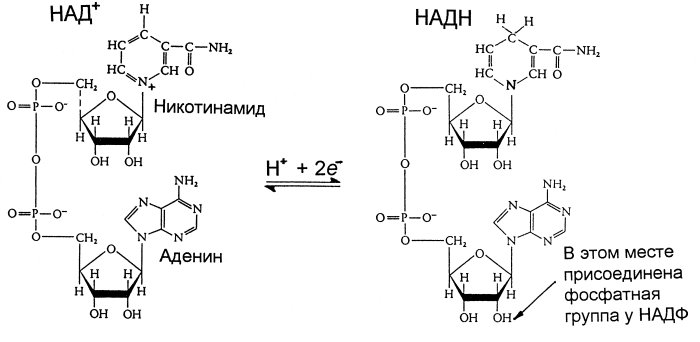
В состав НАД Н входит витамин никотинамид (Витамин РР).
В митохондриальном окислении выполняет роль промежуточного переносчика электронов и протонов между окисленным субстратом и флавиновыми ферментами.
30.


