ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 31
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
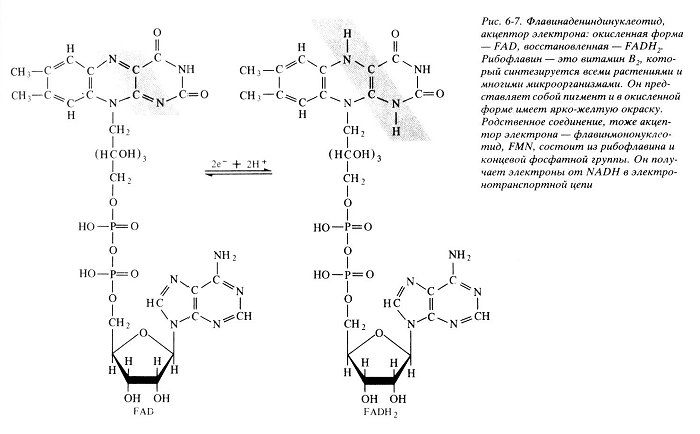 В состав входит витамин рибофлавин (B2)
В состав входит витамин рибофлавин (B2) Молекула FADH2 - основной переносчик электронов при окислении. является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии.
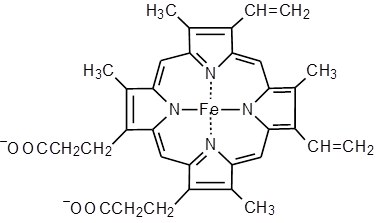
31. Простетической группы цитохрома. Какова его роль в митохондриальном окислении?
Цитохром представляет собой гемопротеин, он осуществляет перенос электронов. Комплекс I II, включающий цитохромы b, c 1 функционирует как QH2-дегидрогеназа :он осуществляет перенос электронов с QH2 на Цитохром с, комплекс цитохромов переносит электроны с цитохрома с на кислород. Кислород, поступающий в митохондрии из крови, связывается с атомом железа в цитохрома а3, в форме молекулы О2.
32. Написать формулу окисленного ФМН. Какова его роль в митохондриальном окислении? Какой витамин входит в его состав?Коферментная группировка ФМН представляет собой витамин рибофлавин, фосфорилированный по спиртовой группе пятого углеродного атома рибита, а в составе ФАД к ФМН путем взаимодействия фосфатных остатков присоединяется нуклеотидный радикал аденозин-монофосфата (АМФ).
33. Записать формулу АТФ. Какова ее роль в митохондриальном окислении?
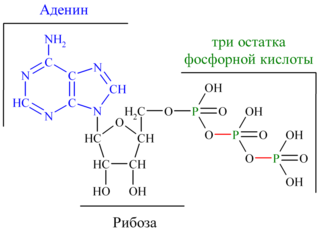
Основная роль АТФ в митохондриальной окислении -
обеспечение энергией процесса синтеза АТФ.
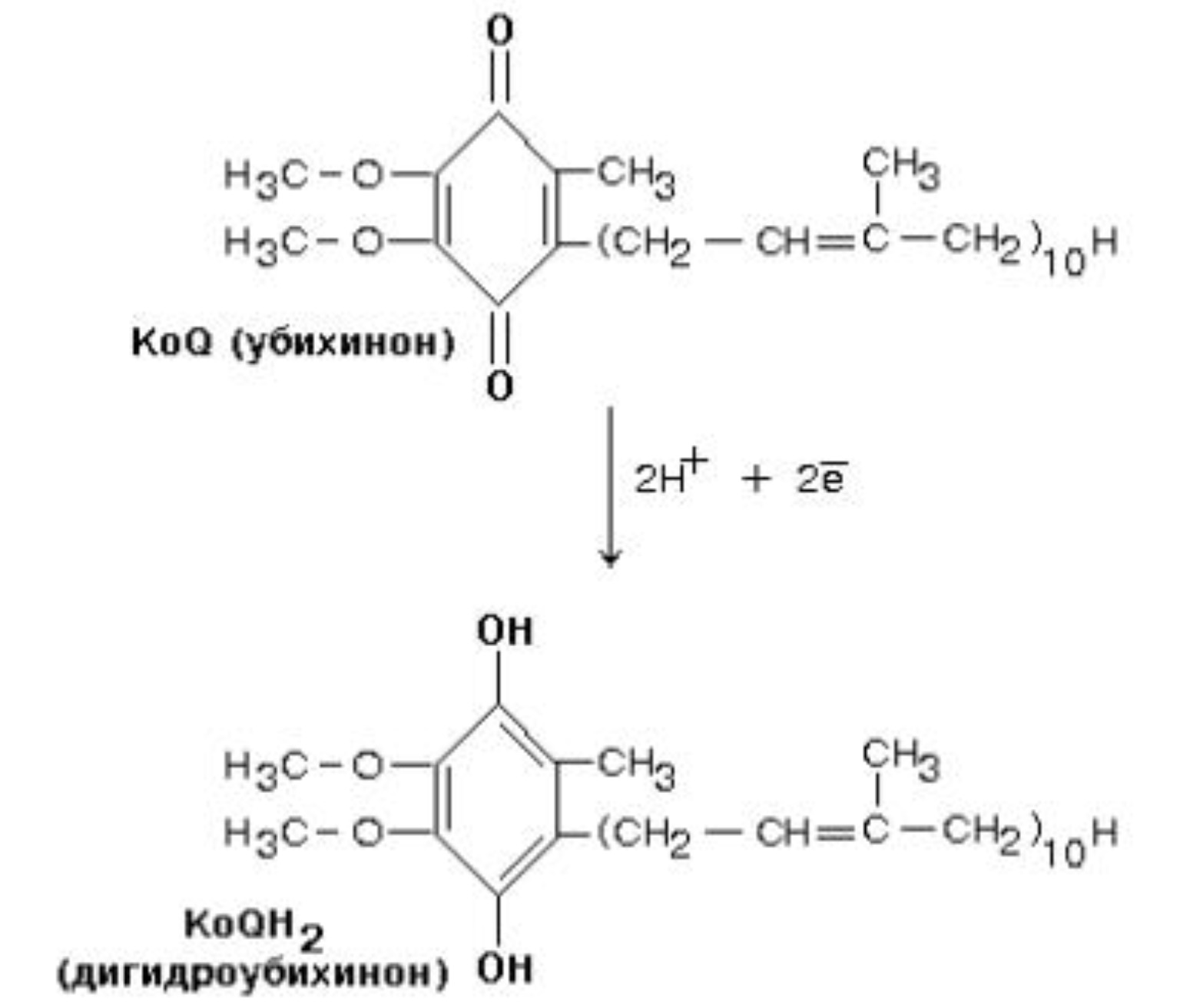
34. Записать формулу ативной части КоQ в переносе атомов водорода (напишите формулы и их превращения).
35. Формула НАДФ. Какой витамин входит в его состав?
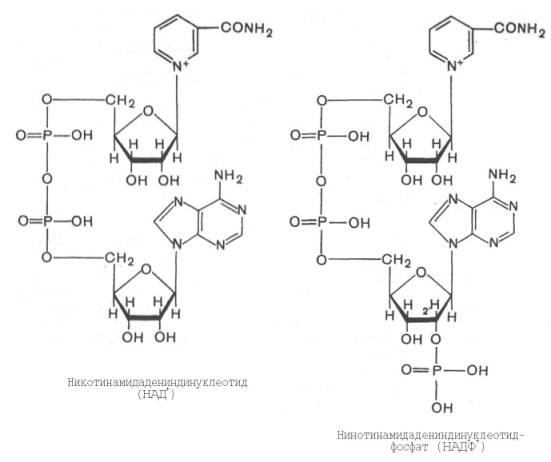
Витамин РР (В3).
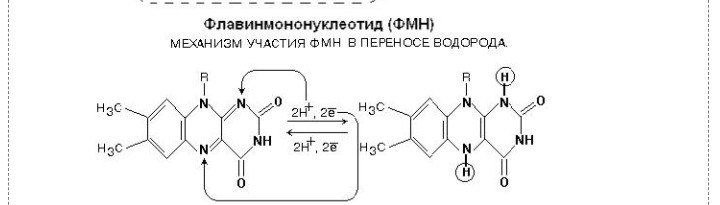
36. Рабочая часть ФМН а окис. И вост-ом виде. Ферменты дыхательной цепи, коферментом которого является ФМН. Лекарственные препараты ингибиующие этот фермент??
1. Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6).
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2),
где Е - белковая часть фермента.
2. NADH-дегидрогеназа (I ферментный комплекс)
3. Транквилищаторы и нейролептики (тизерцин, метеразин, аминазин, пропазин, терален)
37. К какому классу ферментов относится каталаза крови? Какую реакцию она катализирует? Какова ее биологическая роль? Чему равны показатель каталазы и каталазное число в норме?
К классу оксидоредуктаз. Она катализирует разложение образовавшегося в процессе биологического окисления пероксида водорода на воду и молекулрный кислород. Биологическая роль заключается в разрушении этого пероксида водорода, образующийся в клетках при воздействии флавопротеиновых оксидаз, который может разрушить клеточные структуры.
В норме показатель каталазы в пределах от 2,96 до 4, 97, а каталазное число в норме от 12 до 22.
38 Принцип количественного определения активности каталазы крови по Баху и Зубковой. Записать реакцию каталазы, к какому классу ферментов она относится?
Принцип основан на измерении количества пероксида водорода, которое может быть разрушено ферментов в определённых условиях за заданное время. Доля разложившейся перекиси водорода определяется по разности между количеством ее, взятым для опыта(контрольная проба) и оставшимся после действия каталазы(опытная проба) путём титрования перманганатом калия в кислой среде. Относится к классу оксидоредуктаз.
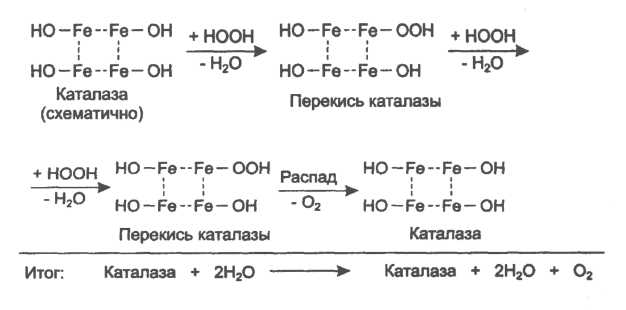
это из учебника

упрощённо так
39.Как можно доказать специфичность действия альфа-амилазы слюны?
Специфический субстрат для а-амилазы -полисахариды: крахмал (и гликоген).
Доказательство:
1.проба Троммера с крахмалом отрицательна, т.к. нет свободных кетонных и альдегидных групп.
2.р-р крахмала+разбавл.р-р слюны, Т=37'С на 10 минут.
3.+проба Троммера. Положительная. Происходит восстановление гидрата окиси меди, можно сделать вывод, что крахмал гидролизовался.
4. При проведении аналогичного опыта с сахарозой -проба Троммера отрицательна на начало и на конец эксперимента, т.е. под воздействием а-амилазы она не гидролизуется.
40.Что лежит в основе количественного определения активности альфа-амилазы слюны по Вольгемуту и в чем она выражается?
Вольгемута метод — определение активности амилазы в биологических жидкостях (слюне, моче, крови и др.). Активность фермента измеряется амилазными единицами, т. е. числом миллилитров 0,1% раствора крахмала, расщепленного в течение 30 мин. при t° 45 1 мл исследуемого раствора. Например, в норме активность амилазы в моче равна 16—64. Повышенные значения наблюдаются при панкреатите, заболеваниях желчных путей и др., пониженные значения вплоть до нуля — при почечной недостаточности.
За выработку альфа-амилазы отвечают поджелудочная железа (этот тип амилазы является одним из компонентов пищеварительного сока) и слюнные железы.
Амилаза активна только в ЖКТ и условиях узкого оптимума рН.
Основная функция амилазы заключается в гидролизе крахмала.
41 Каким опытом можно обнаружить ферментативную активность амилазы слюны (из практики)?
Гидролиз крахмала α-амилазой слюны. Она гидролизует α-1,4-глюкановые связи в крахмале, гликогене, олигосахаридах. Нерасщепленный крахмал дает синее окрашивание. Постепенно при гидролизе идет его распад до амилодекстринов(синее окрашивание), эритродекстринов (красно-бурое окрашивание), ахро- и мальтодекстрины(йодом не окрашиваются). Также о гидролизе можно судить по пробе Троммера. С крахмалом она отрицательная, начиная с амилодекстринов – положительная. Это свидетельствует о гидролизе крахмала и появлении альдегидных групп, которые в крахмале недоступны.
42 Как можно доказать термолабильность фермента сахаразы дрожжей? Какую реакцию она катализирует? К какому классу относится этот фермент?
Сахараза относится к классу гидролаз. Она катализирует гидролиз сахарозы, разлагая ее до глюкозы и фруктозы. Прокипяченный раствор сахаразы дрожжей не сможет гидролизовать сахарозу, проба Троммера будет отрицательной, т к при повышении температуры фермент теряет свою структуры и не может разложить сахарозу до мономеров с альдегидными и кетонными группами. Этим доказывается термолабильность сахаразы. После повышения температуры она не может выполнять гидролиз, т е свои функции
43 К какому классу ферментов относится сахараза? Какую реакцию она катализирует? Как можно доказать термолабильность этого фермента?
Сахараза относится к классу гидролаз. Она катализирует гидролиз сахарозы, разлагая ее до глюкозы и фруктозы. Прокипяченный раствор сахаразы дрожжей не сможет гидролизовать сахарозу, проба Троммера будет отрицательной, т к при повышении температуры фермент теряет свою структуры и не может разложить сахарозу до мономеров с альдегидными и кетонными группами. Этим доказывается термолабильность сахаразы. После повышения температуры она не может выполнять гидролиз, т е свои функции
-
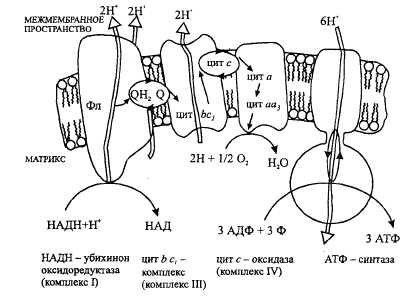
ЦЕПЬ ДЫХАНИЯ:
44 А.Изобразить полную схему митохондриальной цепи переноса электронов с указанием отдельных ее звеньев и пунктов сопряжения с фосфорилированием. Какие ферменты (названия) и какого класса по классификации ферментов работают в ней? Какие используются коферменты, производными каких витаминов являются эти коферменты? Чем обусловлено движение протонов и электронов в дыхательной цепи?
ОТВЕТ:
КАКИЕ ФЕРМЕНТЫ ?Ферментные комплексы дыхательной цепи (обозначены участки сопряжения окисления и фосфорилирования):
Дыхательная цепь включает множество белков-переносчиков
Всего цепь переноса электронов (англ. electron transport chain) включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
Блок-схема дыхательной цепи
Строение ферментативных комплексов дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
Функция
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
3 комплекс. КоQ-цитохром с-оксидоредуктаза
По другому данный комплекс называется цитохром с редуктаза. В его составе имеются цитохром b и цитохром c1, 2 железо-серных белка. Всего в нем насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кДа.
Функция
1. Принимает электроны от коэнзима Q и передает их на цитохром с.
2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди.
Функция
1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
* одна группа формирует субъединицу Fо(произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
* другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+используется для транспорта неорганического фосфата в матрикс митохондрии. -
14.1.3. В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с.
Убихинон (KoQ) – жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q – перенос электронов в дыхательной цепи от флавопротеинов (комплексы I и II) к цитохромам (комплекс III).
Цитохром с – сложный белок, хромопротеин, простетическая группа которого – гем – содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с – перенос электронов в дыхательной цепи от комплекса III к комплексу IV.
Коферменты - Промежуточными переносчиками в дыхательной цепи у высших организмов являются коферменты: NAD+ (никотинамид-адениндинуклеотид), FAD и FMN (флавинадениндинуклеотид и флавинмононуклеотид), кофермент Q (CoQ), семейство гемсодержащих белков - цитохромов (обозначаемых как цитохромы b, С1, С, А, А3) и белки, содержащие негеминовое железо. Все участники этой цепи разделены на четыре окислительно-восстановительные системы, связанные убихиноном (CoQ) и цитохромом С. Процесс начинается с переноса протонов и электронов от окисляемого субстрата на коферменты NAD+ или FAD. Это определяется тем, является ли дегидрогеназа, катализирующая первую стадию, NAD - зависимой или FAD - зависимой. Если процесс начинается с NAD+ , то следующим переносчиком будет FMN.
Полный процесс представляет собой цепь последовательных окислительно-восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает электроны кислороду, который затем восстанавливается до воды.
ЧЕМ ОБУСЛ ДВИЖ ПРОТ И ЭЛ - В электроно-транспортной цепи происходит движение как электронов, перемещающихся от донора к акцептору, так и протонов, движущихся через мембрану. В этих процессах участвуют и растворимые, и связанные с белками транспортные молекулы. В митохондриях перенос электронов в межмембранном пространстве осуществляется водорастворимым белком-переносчиком цитохромом с[10]. Этот белок переносит исключительно электроны, а перенос осуществляется за счёт окисления и восстановления атома железа, который располагается в гемовой группе белка.
Перенос электронов между белками обусловлен их переносом между флавиновыми кофакторами, железо-серными кластерами. -
45 Б.В чем заключается современная теория, объясняющая образование АТФ в результате функционирования митохондриальной дыхательной цепи, кто ее автор? Указать величину коэффициента полезного действия при этом процессе. Напишите полную схему цепи переноса электронов, укажите все возможные пункты ее сопряжения с фосфорилированием. Сколько H+ передается в межмембранное пространство митохондрии при переносе 2-х КоQH2 на внешнюю сторону внутренней мембраны?
ОТВЕТ : СМ ВОПРОС 44+ кто ее автор? Указать величину коэффициента полезного действия при этом процессе.
Автор - Окислительное фосфорилирование открыл в 1931 г. выдающийся русский биохимик В.А. Энгельгардт . А вообще автор новой теории Вроде - МИТЧЕЛЛ !!?
Количество синтезированных молей АТФ на моль окисленного субстрата зависит от его вида (белка, жира, углевода) и от величины коэффициента фосфорилирования. Этот коэффициент, обозначаемый как Р/О, равен количеству синтезированных молекул АТФ в расчете на один атом кислорода, потребленный при окислении восстановленных органических соединений в процессе дыхания. При переносе каждой пары электронов по дыхательной цепи от НАД • Н до 02 величина Р/О = 2. Для субстратов, окисляемых НАД • Н2-зависимыми ферментами, Р/О = 1,3. Эти соотношения Р/О отражают энергетические затраты клетки на синтез АТФ в митохондриях и транспорт макроэрга против химического градиента из митохондрий к местам потребления. Таким образом, одна часть аккумулированной как я поняла, это)
При полном окислении 1 г смеси углеводов пищи выделяется 4 ккал тепла. В процессе окисления в организме 1 г углеводов синтезируется 0,13 моля АТФ. Если считать, что энергия пирофосфатной связи в АТФ равна 7 ккал/моль, то при окислении 1 г углеводов лишь 0,91 (0,13 х 7) ккал энергии будет запасено в организме в синтезированной АТФ. Остальные 3,09 ккал будут рассеяны в виде тепла (первичная теплота). Отсюда можно рассчитать коэффициент полезного действия синтеза АТФ и аккумулирования в ней энергии химических связей глюкозы: к.п.д. = (0,91 : 4,0) х 100 = 22,7 %. Из приведенного расчета видно, что только 22,7 % энергии химических связей глюкозы в процессе ее биологического окисления используется на синтез АТФ и вновь запасается в виде химической макроэргической связи, 77,3 % энергии химических связей глюкозы превращается в первичную теплоту и рассеивается в тканях. -
46 В.Что такое биологическое окисление и каковы его отличия от окисления в неживой природе? Где оно происходит, что в нем окисляется и для чего используется высвобождающаяся энергия? Кто является отечественным основоположником теории окислительного фосфорилирования и в чем она заключается НЕ НАШЛА ОТВЕТ ? Дайте определение термину «окислительное фосфорилирование». Привести схему митохонд-риальной дыхательной цепи с учетом группировки ферментов и коферментов в комплексы. Сколько молей АТФ фактически образуется при переносе протонов и электронов с НАДН2 на кислород?
ОТВЕТ ; 44+
Биологическое оскисление это - окислительно-восстановительные реакции, протекающие в клетках организма, в результате которых сложные органические вещества окисляются при участии специфических ферментов кислородом, доставляемым кровью. Конечными продуктами биологического окисления являются вода и двуокись углерода. Освобождающаяся в процессе биологического окисления энергия частично выделяется в виде тепла, основная же ее часть идет на образование молекул сложных фосфорорганических соединений (главным образом аденозинтрифосфата — АТФ), которые являются источниками энергии, необходимой для жизнедеятельности организма.
Различие: между био окисл и в неживой природе.
2) био ло ги че ское окисление про ис хо дит медленно, по сле до ва тель но в про цес се нескольких реакций, а го ре ние – быст рый процесс в виде одной реакции;
3) при го ре нии вся энер гия выделяется в виде тепла, а при био ло ги че ском окислении часть энер гии аккумулируется в мо ле ку лах АТФ в виде энер гии химических связей.
Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клетокв виде АТФ.
Сколько молей АТФ фактически образуется при переносе протонов и электронов с НАДН2 на кислород? Не точно.....
Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3.