Файл: Учебнометодический комплекс дисциплины Для специальности 050102. 65 Биология с дополнительной специальностью Химия.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 35
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
6)
№14. Свойства химического потенциала компонента системы в общем случае:
1) функция состояния системы;
2) функция процесса;
3) экстенсивная функция;
4) интенсивная функция;
5) функция, равная теплоте процесса;
6) функция, равная работе процесса;
7) абсолютное значение функции равно парциальной мольной энергии Гиббса.
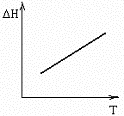
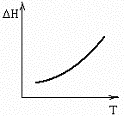
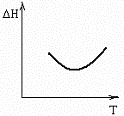
№15. В некоторой химической реакции суммарная теплоемкость CP продуктов меньше теплоемкости исходных веществ, причем соответствующая разность теплоемкостей уменьшается с ростом температуры. Укажите номер графика, соответствующего температурной зависимости изменения энтальпии в реакции.
-
1)
4)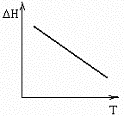 3)
3)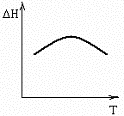 2)
2)
5)
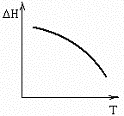 6)
6)
Фазовое и химическое равновесие
№1. Реакции в идеальной газовой фазе, равновесие которых при уменьшении общего давления смещается влево (в сторону исходных веществ):
1) 2NO2 = 2NO + O2;
2) N2 + 3H2 = 2NH3;
3) H2 + I2(г) = 2HI(г);
4) 2SO2 + O2 = 2SO3;
5) CO + H2O(г) = CO2 + H2;
6) CH4 + H2O(г) = CO + 3H2;
7) CH4 + CO2 = 2CO + 2H2.
№2. Реакции в идеальной газовой фазе, равновесие которых при уменьшении общего давления смещается вправо (в сторону продуктов):
1) 2NO2 = 2NO + O2;
2) N2 + 3H2 = 2NH3;
3) H2 + I2(г) = 2HI(г);
4) 2SO2 + O2 = 2SO3;
5) CO + H2O(г) = CO2 + H2;
6) CH4 + H2O(г) = CO + 3H2;
7) CH4 + CO2 = 2CO + 2H2.
№3. Реакции в идеальной газовой фазе, на равновесие которых не влияет изменение общего давления:
1) 2NO2 = 2NO + O2;
2) N2 + 3H2 = 2NH3;
3) H2 + I2(г) = 2HI(г);
4) 2SO2 + O2 = 2SO3;
5) CO + H2O(г) = CO2 + H2;
6) CH4 + H2O(г) = CO + 3H2;
7) CH4 + CO2 = 2CO + 2H2.
№4. Реакции в идеальной газовой фазе, для которых константы равновесия, выраженные через равновесные парциальные давления, мольные доли или молярные концентрации численно совпадают:
1) 2NO2 = 2NO + O2;
2) N2 + 3H2 = 2NH3;
3) H2 + I2(г) = 2HI(г);
4) 2SO2 + O2 = 2SO3;
5) CO + H2O(г) = CO2 + H2;
6) CH4 + H2O(г) = CO + 3H2;
7) CH4 + CO2 = 2CO + 2H2.
5.Уравнения, справедливые для констант равновесия, выраженных через равновесные парциальные давления (P), мольные доли (x) или молярные концентрации (c), для химических реакций в идеальной газовой фазе:
-
1)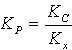
4)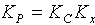 3)
3) 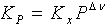 2)
2) 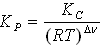
5)
№6. Уравнение Клапейрона-Клаузиуса описывает зависимость равновесного давления от температуры для:
1) однокомпонентной однофазной системы;
2) однокомпонентной двухфазной системы;
3) двухкомпонентной однофазной системы;
4) двухкомпонентной двухфазной системы;
5) двухкомпонентной трехфазной системы.
№7. На диаграмме состояния чистого вещества имеются точки:
1) эвтектики;
2) азеотропа;
3) тройная точка;
4) точка кипения;
5) точка перитектики.
№8. Взаимные переходы кристаллических модификаций чистого вещества, которые могут протекать как в прямом, так и в обратном направлениях в условиях равновесия:
1) монотропные;
2) энантиотропные;
3) необратимые;
4) обратимые.
№9. Находящаяся в состоянии равновесия система 2SO2(г) + О2(г) = 2SO3(г):
1) гомогенная;
2) гетерогенная;
3) однофазная;
4) двухфазная;
5) трехфазная;
6) четырехфазная.
№10. Число степеней свободы (вариантность состояния) системы, состоящей из К компонентов и Ф фаз, на которую из внешних условий влияют только давление и температура
-
1) К+Ф+2;
2) К+Ф-2;
3) К-Ф+2;
4) К-Ф-2;
5) Ф-К+2;
6) Ф-К-2.
№11. Число степеней свободы (вариантность состояния) системы, состоящей из К компонентов и Ф фаз, на которую из внешних условий влияет только температура (давление постоянно):
-
1) К+Ф+1;
2) К+Ф-1;
3) К-Ф+1;
4) К-Ф-1;
5) Ф-К+1;
6) Ф-К-1.
№12. Диаграмма состояния воды при невысоких давлениях:
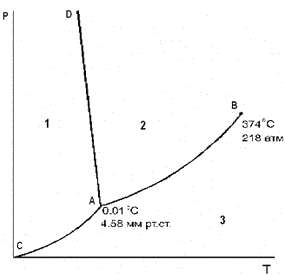
Выберите номер области существования жидкости на фазовой диаграмме воды.
№13. Линии ликвидус на диаграмме плавкости системы AB:
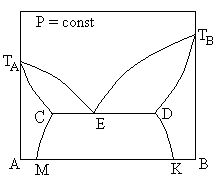
1) CM и DK;
2) ТАC и ТBD;
3) ТАЕ и ТBЕ;
4) ТАЕ и ТAC;
5) ТBЕ и ТBD.
№14. Фазовая диаграмма двухкомпонентной системы с одним химическим соединением АхВу, плавящимся конгруэнтно:
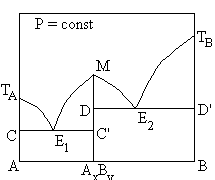
В эвтектическом равновесии, представленном коннодой DЕ2D’ сосуществуют фазы:
1) кристаллы А, кристаллы В и жидкость;
2) кристаллы А, кристаллы В и кристаллы АхВу ;
3) кристаллы А, кристаллы АхВу и жидкость;
4) кристаллы B, кристаллы АхВу и жидкость;
5) кристаллы А и кристаллы АхВу;
6) кристаллы B и кристаллы АхВу;
7) только кристаллы А;
8) только кристаллы В;
9) только кристаллы Ах
Ву.
№15. На диаграмме состояния для чистого вещества имеются линии
1) для равновесия жидкостьпар;
2) для равновесия трех фаз;
3) для равновесия двух газообразных фаз;
4) для равновесия кристаллыпар;
5) для равновесия жидкостькристаллы.
Растворы
№1. Метод исследования разбавленных растворов, основанный на сравнении температуры начала кипения раствора и температуры кипения растворителя при постоянном давлении:
1) калориметрия;
2) криоскопия;
3) осмометрия;
4) тензиметрия;
5) эбуллиоскопия;
6) фотометрия.
№2. Повышение температуры начала кипения разбавленного раствора нелетучего растворенного вещества в летучем растворителе по сравнению с температурой кипения растворителя выражается формулой ΔT = iEm. Буквой m в этой формуле обозначена:
1) масса растворителя;
2) масса растворенного вещества;
3) масса раствора;
4) молярная концентрация растворенного вещества;
5) моляльная концентрация растворенного вещества;
6) число моль растворенного вещества в растворе.
№3. Утверждения, справедливые для эбуллиоскопической константы:
1) зависит только от свойств растворителя;
2) зависит от свойств растворителя и растворенного вещества;
3) зависит от свойств растворителя и концентрации раствора;
4) зависит от температуры и концентрации раствора;
5) увеличивается с ростом соотношения удельной теплоты испарения к квадрату температуры кипения;
6) уменьшается с ростом соотношения удельной теплоты испарения к квадрату температуры кипения.
№4. Изотонический коэффициент Вант-Гоффа это поправка, учитывающая:
1) увеличение равновесного давления пара над чистым растворителем при нагревании;
2) непостоянство давления при нагревании или охлаждении раствора;
3) различие молярных масс растворителя и растворенного вещества;
4) изменение числа частиц в растворе при диссоциации или ассоциации молекул;
5) изменение плотности раствора при диссоциации или ассоциации молекул;
6) изменение изотопного состава молекул растворенного вещества.
№5. Ионная сила раствора выражается через моляльности ионов mi и их заряды zi формулой:
-
1) ∑mizi;
2) 1/2∑mizi;
3) ∑(mizi)2;
4) 1/2∑(mizi)2;
5) ∑mizi2;
6) 1/2∑mizi2.
№6. Уменьшение эквивалентной проводимости водного раствора уксусной кислоты при повышении концентрации электролита обусловлено главным образом:
1) электрофоретическим эффектом;
2) релаксационным эффектом;
3) уменьшением вязкости раствора;
4) снижением степени диссоциации;
5) увеличением степени диссоциации;
6) увеличением кинетической энергии ионов.
№7. При бесконечном разведении эквивалентная электропроводность водного раствора электролита равна:
1) нулю;
2) электропроводности воды;
3) сумме предельных подвижностей ионов;
4) разности предельных подвижностей ионов;
5) произведению предельных подвижностей ионов.
№8. Эквивалентная электропроводность водного раствора электролита максимальна:
1) в его насыщенном растворе;
2) в его пересыщенном растворе;
3) при бесконечном разведении;
4) в его разбавленном растворе;
5) в его концентрированном растворе.
№9. С увеличением концентрации растворённого вещества температура кристаллизации раствора:
1) убывает;
2) растет пропорционально квадрату концентрации;
3) не меняется;
4) убывает по экспоненциальному закону;
5) растет по экспоненциальному закону.
№10. Для расчёта криоскопической постоянной необходимо знать:
1) мольную массу растворенного вещества;
2) мольную массу растворителя;
3) универсальную газовую постоянную;
4) температуру кристаллизации чистого растворителя;
5) постоянную Планка.
№11. Азеотропный раствор – это раствор:
1) пар над которым имеет тот же состав, что и жидкость;
2) пар над которым более обогащен легколетучим компонентом;
3) имеющий самую большую мольную массу;
4) нелетучего вещества;
5) соответствующий точке эвтектики.
№12. Для измерения электропроводности растворов используется:
1) мост постоянного тока;
2) мост переменного тока;
3) мост Кольрауша;
4) потенциометр;
5) потенциостат.
№13. Резкое падение электропроводности раствора при нейтрализации щёлочью связано:
1) с уменьшением суммарной концентрации ионов;
2) с уменьшением концентрации очень подвижных ионов гидроксония;
3) с накоплением в системе ионов гидроксила;
4) с образованием осадка;
5) с разбавлением раствора.
№14. Буферный раствор это:
1) раствор соли сильного основания и слабой кислоты и соответствующего основания;


