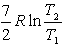Файл: Учебнометодический комплекс дисциплины Для специальности 050102. 65 Биология с дополнительной специальностью Химия.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 41
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задачи
-
Пероксид водорода в водном растворе разлагается по уравнению: 2H2O2 = 2Н2O + O2. Кинетику этой реакции исследовали титрованием проб одинакового объема раствором КMnО4. Определите порядок реакции всеми возможными способами и вычислите значения константы скорости этой реакции, пользуясь приведенными данными:
Время от начала опыта, мин.
0
5
10
15
20
30
40
Объем 0,0015 КMnО4, израсходованного на титрование 2 см3 пробы
23,6
18,1
14,8
12,1
9,4
5,8
3,7
-
Во сколько раз увеличится скорость химической реакции при повышении температуры на 100С, если температурный коэффициент скорости равен 3? -
Определите порядок реакции А (г) = В (г) + Д (г) по изучению давления в ходе реакции. Вычислите среднее значение константы скорости (V = const, 298 К).
Время, мин.
0
6,5
13,0
19,9
Р · 10–3 Па
41,6
54,5
63,7
74,2
-
Во сколько раз увеличится скорость химической реакции при повышении температуры от 250 до 650С, если температурный коэффициент скорости реакции равен 2? -
Бимолекулярная реакция, для которой СА = СВ, протекает за 10 минут на 25%. Сколько потребуется времени, чтобы реакция прошла на 50% при той же температуре. -
При 140С реакция заканчивается за 30 мин. Рассчитайте, через сколько минут закончилась бы реакция, если температурный коэффициент скорости этой реакции равен 1,7? -
Рассчитайте константу скорости (с/(моль · л); л/(моль · с); л/(моль · мин)), если скорость реакции второго порядка 4,5 · 10–7 моль/(см3 · с) при концентрации одного реагента 1,5·10–3 моль/л и другого 2,5·10–3 моль/л. -
Скорость реакции при увеличении температуры на 35С увеличилась в 7,3 раза. Чему равен температурный коэффициент этой реакции? -
В результате реакции формальдегида с пероксидом водорода образуется муравьиная кислота и вода (реакция второго порядка):
НСОН + Н2О2 = НСООН + Н2О.
Если смешать равные объемы молярных растворов пероксида водорода и формальдегида, то через 2 часа при 333,2 К концентрация НСОН становится равной 0,215 моль/л. Вычислите константу скорости реакции и определите через сколько времени прореагирует 90% исходных веществ. Сколько времени потребуется, чтобы реакция дошла до той же глубины, если исходные растворы Н2О2 и НСОН разбавить в 10 раз, а затем смешать.
-
Скорость реакции при температуре 100С равна 0,375, а при температуре 125С – 0,467 с–1. Определите температурный коэффициент реакции. -
Температурный коэффициент реакции равен 3. При какой температуре следует проводить реакцию, если нужно скорость реакции, проводимой при температуре 80С, увеличить в 2,5 раза? -
Вещество А смешано в равных объемах с веществами В и С; начальная концентрация равна 1 моль/л. По истечении 1000 с половина вещества А прореагировала. Определите количество вещества А, которое остается по истечении 2000 с, если соответствующая реакция:
а) первого порядка; б) второго порядка; в) третьего порядка; г) нулевого порядка.
Какое количество вещества прореагирует за 1000 с во всех случаях, если К реакции равна 1?
-
Как изменится скорость реакции Н2О2 + 2НI, если реагирующую смесь разбавить в 2,5 раза? -
Исследовали кинетику каталитического распада аммиака на простые вещества при 1373 К. Время, необходимое для разложения половины всего количества аммиака (причем в начале азот и водород отсутствуют), зависит от начального давления аммиака следующим образом:
-
Ро, мм рт ст.
265
130
58
Τ1/2, мин.
7,6
3,7
1,7
Определите порядок реакции, константу реакции.
-
Вычислите на сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 50 раз, если температурный коэффициент скорости равен 3?. -
О пределите порядок реакции 2СО = СО2 + С при 583,2 К, если P за 30 мин уменьшается с 1,049 · 105 Па до 0,924 · 105 Па, а затем за тот же промежуток времени до 0,714 · 105 Па (объем постоянный). -
Температурный коэффициент скорости реакции разложения иодида водорода равен 2,5. Вычислите константу скорости этой реакции при 374С, если при 365С она равна 0,0000809. -
При 583,3 К газообразный гидрид мышьяка разлагается с образованием твердого мышьяка и газообразного водорода. Во время реакции P изменялось следующим образом (давление паров мышьяка во внимание не принимается):
-
τ, ч
0,0
5,5
6,5
8,0
P · 10–5 Па
0,978
1,074
1,091
1,114
Определите порядок реакции разложения AsH3 (г) и вычислите константу скорости (объем системы постоянный).
-
Константа скорости омыления этилацетата едким натром при 9,4С равна 2,37, а при 14,4С – 3,204. Рассчитать температурный коэффициент скорости реакции в указанных приделах температур и энергию активации. -
В некоторой реакции при изменении начальной концентрации от 0,502 до 1,007 моль/л период полураспада уменьшается от 51 до 26 с. Вычислите порядок реакции и константу скорости. -
Вычислите, при какой температуре реакция закончится за 20 минут, если при температуре 20С на это требуется 3 часа. Температурный коэффициент скорости принять равным 3. -
Как изменится скорость реакции взаимодействия тиосульфата натрия с серной кислотой, если реагирующая смесь разбавится в 3 раза? -
Вычислите энергию активации и найдите константу скорости реакции COCl2 = CO + Cl2, при температуре 425С, если константы скорости реакции при 382 и 472С соответственно равны 0,5 · 10–2 и 68·10–2.
3. Тестовые задания
Химическая термодинамика
№1. Свойства внутренней энергии системы в общем случае:
1) функция состояния системы;
2) функция процесса;
3) экстенсивная функция;
4) интенсивная функция;
5) функция, равная теплоте процесса;
6) функция, равная работе процесса;
7) абсолютное значение функции неизвестно.
№2. Выражения, справедливые для изохорной теплоемкости CV одного моля идеального газа:
-
1)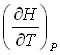
4)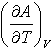 3)
3) 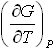 2)
2) 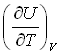
5) CP-R6) ΔU+W
№3. Выражение первого начала термодинамики, записанное с использованием работы системы W и теплоты процесса Q, имеет вид:
1) Q = ΔU – W;
2) Q = ΔU + W;
3) ΔU = Q + W;
4) ΔU = Q – W;
5) W = ΔU + Q.
№4. Выражения, справедливые для адиабатического процесса с идеальным газом (W – работа системы, Q – теплота процесса):
-
1) P = const;
2) V = const;
3) T = const;
4) PVγ = const;
5) γ=Cp/Cv;
6) ΔU = 0;
7) W = 0;
8) Q = 0;
9) ΔU = – W.
№5. Процесс обратимого расширения 1 моль идеального газа от объема V1до объема V2 , в котором изменение внутренней энергии газа будет наибольшим:
1) адиабатический;
2) изотермический;
3) изобарный;
4) изотермический до объёма V1+0,5V2, затем изобарный до V2;
5) изобарный до объёма V1+0,5V2,затем изотермический до V2.
№6. Работа системы при обратимом изобарном расширении n моль идеального газа от объёма V1до объёма V2:
1) P(V2 – V1);
2) nR(lnV2 – lnV1
);
3) 0;
4) -nCV(T2 – T1).
№7. Теплота процесса при обратимом изохорном нагревании n моль идеального газа от температуры T1 до температуры T2 выражается как:
1) nR(T2 – T1);
2) nR(lnT2 – lnT1);
3) nCV(T2 – T1);
4) nCP(T2 – T1).
№8. Условия, отличающие изолированную термодинамическую систему:
1) совокупность материальных объектов, занимающих ограниченную область пространства;
2) совокупность материальных объектов, занимающих неограниченную область пространства;
3) исключен обмен веществом и энергией с окружающей средой; возможен обмен энергией с окружающей средой, но исключен обмен веществом;
4) возможен обмен веществом с окружающей средой, но исключен обмен энергией;
5) возможен обмен веществом и энергией с окружающей средой.
№9. Укажите реакции, для которых можно пренебречь разностью между изменением энтальпии и изменением внутренней энергии:
1) Ca(OH)2(p-p) + CO2(г) = CaCO3(тв) + H2O(ж);
2) CaO(тв) + CO2(г) = CaCO3(тв);
3) 2AsH3(г) = 2As(тв) + 3H2(г);
4) Pb(тв) + PbO2(тв) = 2PbO(тв);
№10. Термохимическое уравнение Кирхгофа может выражать зависимость:
1) энтальпии вещества от температуры при постоянном давлении;
2) теплоемкости вещества от температуры при постоянном давлении;
3) энтальпии вещества от давления при постоянной температуре;
4) теплоемкости вещества от давления при постоянной температуре;
5) изменения энтальпии в процессе от температуры при постоянном давлении;
6) изменения энтальпии в процессе от давления при постоянной температуре.
№11. Математическое выражение второго начала термодинамики в наиболее общем виде:
-
1) ΔS>0;
2) ΔS=ΔH/T;
3) dS=δQ/T;
4) TdS=dU + PdV;
5) ΔS=Q/T;
6) ΔS<0;
7) dS≥δQ/T;
8) TdS=dH – VdP.
№12. При самопроизвольном приближении к равновесию энтропия изолированной системы:
1) стремится к нулю;
2) стремится к бесконечности;
3) достигает минимума;
4) достигает максимума;
5) линейно убывает.
№13. Изменение энтропии при изохорном нагревании 1 моль идеального одноатомного газа в интервале температур T1 – T2 (CV = const):
-
4)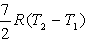 1)
1) 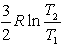
8)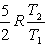 5)
5) 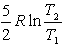 3)
3) 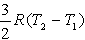 2)
2)