Файл: Учебнометодический комплекс дисциплины Для специальности 050102. 65 Биология с дополнительной специальностью Химия.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 33
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2) раствор сильной кислоты и слабого основания;
3) раствор, способный поддерживать постоянство состава при добавлении к нему других веществ;
4) раствор, способный поддерживать постоянство pH при добавлении небольших количеств кислоты или основания.
№15. Температура кристаллизации линейно зависит от концентрации второго компонента:
1) для концентрированных идеальных растворов;
2) для концентрированных реальных растворов;
3) для идеальных разбавленных растворов;
4) для неидеальных растворов;
5) для совершенных растворов.
Электрохимия
№1. Известны следующие методы измерения ЭДС гальванического элемента:
1) потенциометрический;
2) полярографический;
3) метод вольтметра с высоким внутренним сопротивлением;
4) компенсационный;
5) кондукторометрический.
№2. Для нормально разомкнутого гальванического элемента электродвижущая сила равна:
1) разности электродных потенциалов на выводах ГЭ;
2) падению напряжения на внешнем участке цепи с гальваническим элементом;
3) напряжению на выводах работающего элемента;
4) произведению тока на сумму сопротивлений;
5) полусумме произведений квадратов зарядов частиц на концентрацию.
№3. Величину гальванического элемента можно рассчитать:
1) с помощью уравнения Фарадея;
2) с помощью уравнения Фрумкина;
3) с помощью уравнения Нернста;
4) с помощью уравнения Гиббса-Дюгема;
5) как разность условных электродных потенциалов.
№4. Для расчёта ЭДС с помощью уравнения Нернста необходимо знать:
1) стандартную ЭДС элемента и температуру;
2) ЭДС нормального элемента Вестона;
3) стехиометрическое уравнение реакции в элементе;
4) электропроводность растворов, входящих в состав элемента;
5) атмосферное давление.
№5. Электрод, стандартный электродный потенциал которого при 298К в водном растворе принят равным нулю:
-
платиновый; -
серебряный; -
хлорсеребряный; -
каломельный; -
кислородный в растворе кислоты; -
кислородный в растворе щёлочи; -
водородный в растворе кислоты; -
водородный в растворе щёлочи.
№6. Химический гальванический элемент с двумя электродами первого рода:
-
Cu|Zn|ZnCl2(р-р)||CuCl2(р-р)|Cu; -
Zn|ZnCl2(р-р)||ZnCl2(р-р)|Zn; -
Ag|Zn|ZnCl2(р-р)||KCl(р-р)|AgCl(тв)|Ag; -
Ag|AgCl(тв)|KCl(р-р)||KCl(р-р)|AgCl(тв)|Ag; -
Pt|Ag|AgCl (тв)|KCl(р-р)|Cl2, Pt; -
Ag|Zn|ZnCl2(р-р)|AgCl(тв)|Ag;
№7. Концентрационным называется гальванический элемент, у которого:
1) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции;
2) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции и не зависит от концентрации реагентов и продуктов;
3) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции и зависит от концентрации реагентов и продуктов;
4) электроды содержат одни и те же фазы, величина ЭДС определяется отношением активности веществ или ионов;
5) величина ЭДС определяется только разностью температур электродов.
№8. Уравнение Нернста для потенциала хлорного электрода (E) при небольших давлениях газообразного хлора (P(Cl2), атм):
-
1)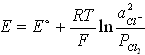
2)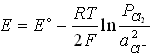 4)
4) 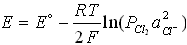
3)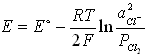 5)
5) 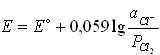
6)
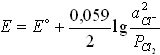
№9. Выберите гальванический элемент, по измерениям стандартной ЭДС которого возможно определить константу равновесия реакции 2Ag + Cl2 = 2AgCl:
-
Cu|Zn|ZnCl2(р-р)||CuCl2(р-р)|Cu; -
Zn|ZnCl2(р-р)||ZnCl2(р-р)|Zn; -
Ag|Zn|ZnCl2(р-р)||KCl(р-р)|AgCl(тв)|Ag; -
Ag|AgCl(тв)|KCl(р-р)||KCl(р-р)|AgCl(тв)|Ag; -
Pt|Ag|AgCl (тв)|KCl(р-р)|Cl2, Pt; -
Ag|Zn|ZnCl2(р-р)|AgCl(тв)|Ag.
№10. Электродный потенциал цинкового электрода в стандартных условиях в водном растворе при температуре 298К равен –0,763 В. Из данного электрода и стандартного водородного электрода в растворе кислоты при 298 К составлен гальванический элемент, в котором отсутствует диффузионная разность потенциалов. Выберите все справедливые утверждения, описывающие этот элемент.
1) цинковый электрод образует положительный полюс гальванического элемента;
2) цинковый электрод образует отрицательный полюс гальванического элемента;
3) в цинковом электроде самопроизвольно протекает реакция восстановления;
4) в цинковом электроде самопроизвольно протекает реакция окисления;
5) в названном гальваническом элементе самопроизвольная химическая реакция не протекает;
6) названный гальванический элемент является химическим;
7) названный гальванический элемент является концентрационным;
8) ЭДС названного гальванического элемента равна 0,763 В;
9) ЭДС названного гальванического элемента равна –0,763 В;
10) ЭДС названного гальванического элемента по условию задачи определить невозможно.
№11. Число Z, входящее в уравнение Нернста соответствует:
1) числу электронов, участвующих в реакции;
2) числу электродных реакций;
3) зарядовому числу анионов в растворе;
4) зарядовому числу ионов гидроксония;
5) произведению зарядовых чисел катионов и анионов.
№12. Используемый в хингидронном электроде хингидрон представляет собой:
1) эквимолекулярное соединение хинона и гидроксиламина;
2) легко растворимая смесь хинона и гидроокиси хрома;
3) малорастворимое соединение;
4) малорастворимое соединение хинона со следами гидрохинона;
5) эквимолекулярное соединение хинона и гидрохинона.
№13. Каломельный электрод относится к:
1) окислительновосстановительным;
2) электродам 1 рода;
3) электродам 2 рода;
4) электродам сравнения;
5) ионообменным электродам.
№14. Электролитический ключ, служащий для элиминирования диффузионного потенциала:
1) заполнен дистиллированной водой;
2) содержит ионы с одинаковой подвижностью;
3) содержит ионы в аномальной подвижностью;
4) заполнен исследуемым раствором;
5) содержит раствор хлористого калия.
№15. Металл, используемый в газовых электродах должен:
1) участвовать в электродной реакции;
2) быть инертным к электродной реакции;
3) хорошо сорбировать газы;
4) полностью исключать сорбцию газов;
5) иметь сильно развитую поверхность.
Кинетика и катализ
№1. Уравнение, соответствующее реакции первого порядка:
1) υ = кС2(А)С(В);
2) υ = кС2(А);
3) υ = кС(А)С(В);
4) υ = кС(А)С2(В).
№2. Стадия, определяющая скорость реакции:
1) медленной стадией;
2) быстрой стадией;
3) разностью скоростей всех стадий;
4) суммой скоростей всех стадий.
№3. На активность катализатора влияет:
1) наличие активных адсорбционных центров;
2) химический состав;
3) достаточно развитая поверхность;
4) характер пористости катализатора.
№4. При каталитических процессах изменяется:
1) скорость реакции;
2) состояние равновесия в реакционной системе;
3) предел протекания реакции;
4) энергия активации.
№5. Каталитическая активность имеет место, когда:
1) атомы или ионы катализатора частично связываются с молекулами реагирующих веществ;
2) расположение атомов или ионов катализатора находится в пространственном соответствии с расположением атомов в молекулах реагирующих веществ;
3) происходит частичное ослабление связей в молекулах реагирующих веществ;
4) происходит деформация связей в реагирующих молекулах.
№6. Гетерогенными каталитическими реакциями называю такие, у которых:
1) реагирующие вещества находятся в различных фазах;
2) реагирующие вещества и продукты реакции находятся в различных фазах;
3) катализатор составляет самостоятельную фазу;
4) катализатор и продукты реакции находятся в различных фазах.
№7. Радикальными реакциями являются:
1) получение HCl из Cl2 и H2;
2) образование воды из H2 и O2 ;
3) образование HI из H2 и I2;
4) окисление углеводородов.
№8. Под специфичностью катализатора понимают:
1) способность катализатора увеличивать скорость реакций, для которых одно из реагирующих веществ является общим;
2) способность катализатора влиять только на одну из реакций при наличии нескольких параллельных реакций;
3) способность катализатора изменять скорость реакции только для одного из изомеров;
4) способность катализатора увеличивать скорость реакции только между определённой парой реагирующих веществ.
№9. Значение констант скорости реакции зависит:
1) от температуры;
2) от концентрации реагентов;
3) от вида растворителя;
4) от концентрации продуктов;
5) от давления.
№10. Константа скорости реакции при увеличении температуры:
1) возрастает по экспоненциальному закону;
2) убывает по экспоненциальному закону;
3) возрастает в соответствии с уравнением Аррениуса;
4) убывает с ростом температуры;
5) растет пропорционально квадрату температуры.
№11. Размерность константы скорости реакции первого порядка:
1) м/с.
2) 1/с.
3) м3/(мольс).
4) м6/(моль2с).
5) с/м.
№12. Выберите заключения, справедливые для реакции в растворе, в случае, когда молекулы исходных веществ сольватированы, а переходное состояние не сольватировано:
1) сольватация молекул исходных веществ уменьшает энергию активации;
2) сольватация молекул исходных веществ увеличивает энергию активации;
3) сольватация молекул исходных веществ сводит энергию активации к нулю;
4) сольватация молекул исходных веществ делает энергию активации отрицательной;
5) сольватация молекул исходных веществ делает реакцию невозможной.
№13. Порядком реакции называется:
1) количество различных видов частиц исходных веществ;
2) количество различных видов частиц исходных веществ и продуктов;
3) количество частиц исходных веществ, взаимодействующих в одном элементарном акте превращения;
4) количество частиц, взаимодействующих и образующихся в одном элементарном акте превращения;
5) показатель степени при концентрации в дифференциальной форме кинетического уравнения;
6) показатель степени при концентрации в интегральной форме кинетического уравнения.
№14. Молекулярностью реакции называется:
1) количество различных видов частиц исходных веществ;
2) количество различных видов частиц исходных веществ и продуктов;
3) количество частиц исходных веществ, взаимодействующих в одном элементарном акте превращения;
4) количество частиц, взаимодействующих и образующихся в одном элементарном акте превращения;
5) показатель степени при концентрации в дифференциальной форме кинетического уравнения;
6) показатель степени при концентрации в интегральной форме кинетического уравнения.
№15. В совокупности стадий неразветвленной цепной реакции образования фосгена (CO + Cl2 = COCl2) выберите стадии развития цепи
1) Cl2 + M 2Cl• + M;
2) Cl• + X(стенка) XCl(стенка);
3) 2Cl• + M Cl2 + M;
4) Cl• + CO + M COCl• + M;
5) COCl• Cl• + CO;
6) COCl• + Cl2 COCl2 + Cl•.
- 1 2 3 4 5 6 7


