Файл: Учебнометодический комплекс кгп на пхвсмк уквмк умк экз Дата Система менеджмента качества кгп на пхвсмк уквмк умк стр из утверждаю.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 106
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Причины тиреотоксикоза
Избыток тиреоидных гормонов в крови может быть следствием заболеваний, проявляющихся гиперфункцией щитовидной железы либо ее разрушением — в этом случае тиреотоксикоз обусловлен пассивным поступлением T4 и T3 в кровь. Кроме того, могут быть и не зависимые от щитовидной железы причины — передозировка тиреоидных гормонов, T4- и T3-секретирующая тератома яичника, метастазы рака щитовидной железы (табл. 1).
Гиперфункция щитовидной железы. Первое место среди заболеваний, сопровождающихся повышенным образованием и секрецией тиреоидных гормонов, занимают диффузный токсический зоб и многоузловой токсический зоб.
Д
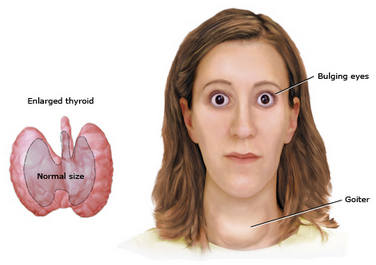 иффузный токсический зоб (ДТЗ) (болезнь Базедова–Грейвса, болезнь Пари) — системное аутоиммунное заболевание с наследственной предрасположенностью, в основе которого лежит выработка стимулирующих аутоантител к рецепторам ТТГ, расположенным на тиреоцитах. О генетической предрасположенности свидетельствует выявление циркулирующих аутоантител у 50% родственников ДТЗ, частое обнаружение у больных гаплотипа HLA DR3, нередкое сочетание с другими аутоиммунными заболеваниями. Сочетание ДТЗ с аутоиммунной хронической надпочечниковой недостаточностью, сахарным диабетом 1-го типа, а также другими аутоиммунными эндокринопатиями обозначается как аутоиммунный полигландулярный синдром 2-го типа. Примечательно, что женщины болеют в 5–10 раз чаще мужчин, манифестация заболевания приходится на молодой и средний возраст. Наследственная предрасположенность при действии триггерных факторов (вирусная инфекция, стрессы и т. д.) ведет к появлению в организме тиреоидстимулирующих иммуноглобулинов — LATS-факторов (long action thyreoid stimulator, длительно действующий тиреоидный стимулятор). Вступая во взаимодействие с рецепторами к тиреотропному гормону на тиреоцитах, тиреоидстимулирующие антитела вызывают увеличение синтеза гормонов T4 и T3, что и приводит к возникновению состояния тиреотоксикоза [2].
иффузный токсический зоб (ДТЗ) (болезнь Базедова–Грейвса, болезнь Пари) — системное аутоиммунное заболевание с наследственной предрасположенностью, в основе которого лежит выработка стимулирующих аутоантител к рецепторам ТТГ, расположенным на тиреоцитах. О генетической предрасположенности свидетельствует выявление циркулирующих аутоантител у 50% родственников ДТЗ, частое обнаружение у больных гаплотипа HLA DR3, нередкое сочетание с другими аутоиммунными заболеваниями. Сочетание ДТЗ с аутоиммунной хронической надпочечниковой недостаточностью, сахарным диабетом 1-го типа, а также другими аутоиммунными эндокринопатиями обозначается как аутоиммунный полигландулярный синдром 2-го типа. Примечательно, что женщины болеют в 5–10 раз чаще мужчин, манифестация заболевания приходится на молодой и средний возраст. Наследственная предрасположенность при действии триггерных факторов (вирусная инфекция, стрессы и т. д.) ведет к появлению в организме тиреоидстимулирующих иммуноглобулинов — LATS-факторов (long action thyreoid stimulator, длительно действующий тиреоидный стимулятор). Вступая во взаимодействие с рецепторами к тиреотропному гормону на тиреоцитах, тиреоидстимулирующие антитела вызывают увеличение синтеза гормонов T4 и T3, что и приводит к возникновению состояния тиреотоксикоза [2].Многоузловой токсический зоб — развивается при длительном хроническом недостатке йода в пище. По сути, это одно из звеньев в цепочке последовательных патологических состояний щитовидной железы, формирующихся в условиях йодного дефицита легкой и средней степени тяжести. Диффузный нетоксический зоб (ДНЗ) переходит в узловой (многоузловой) нетоксический зоб, затем развивается функциональная автономия щитовидной железы, являющаяся патофизиологической основой многоузлового токсического зоба. В условиях йодного дефицита щитовидная железа подвергается стимулирующему воздействию ТТГ и местных ростовых факторов, вызывающих гипертрофию и гиперплазию фолликулярных клеток щитовидной железы, что приводит к формированию струмы (стадия ДНЗ). Основой для развития узлов в щитовидной железе является микрогетерогенность тиреоцитов — различная функциональная и пролиферативная активность клеток щитовидной железы.
Если йодный дефицит сохраняется на протяжении многих лет, то стимуляция щитовидной железы, становясь хронической, вызывает гиперплазию и гипертрофию в тиреоцитах, обладающих наиболее выраженной пролиферативной активностью. Что и приводит со временем к возникновению очаговых скоплений тиреоцитов с той же высокой чувствительностью к стимулирующим воздействиям. В условиях продолжающейся хронической гиперстимуляции активное деление тиреоцитов и запаздывание на этом фоне репаративных процессов ведет к развитию активирующих мутаций в генетическом аппарате тиреоцитов, приводящих к автономному их функционированию. Со временем деятельность автономных тиреоцитов приводит к снижению уровня ТТГ и повышению содержания Т3 и Т4 (фаза клинически явного тиреотоксикоза). Так как процесс формирования функциональной автономии щитовидной железы растянут во времени, йодиндуцированный тиреотоксикоз проявляется в старших возрастных группах — после 50 лет [3, 4].
Тиреотоксикоз при беременности. Частота тиреотоксикоза у беременных достигает 0,1%. Основная его причина — диффузный токсический зоб. Так как тиреотоксикоз снижает фертильность, у беременных редко наблюдается тяжелая форма болезни. Нередко беременность наступает во время или после медикаментозного лечения тиреотоксикоза (поскольку это лечение восстанавливает фертильность). Чтобы избежать нежелательной беременности, молодым женщинам с тиреотоксикозом, получающим тионамиды, рекомендуется применять противозачаточные средства.
Токсическая аденома щитовидной железы (болезнь Пламмера) — доброкачественная опухоль щитовидной железы, развивающаяся из фолликулярного аппарата, автономно гиперпродуцирующая тиреоидные гормоны. Токсическая аденома может возникать в ранее существовавшем нетоксическом узле, в связи с этим узловой эутиреоидный зоб рассматривается как фактор риска развития токсической аденомы. В основе патогенеза заболевания лежит автономная гиперпродукция тиреоидных гормонов аденомой, которая не регулируется тиреотропным гормоном. Аденома секретирует в большом количестве преимущественно трийодтиронин, что приводит к подавлению продукции тиреотропного гормона. При этом снижается активность остальной ткани щитовидной железы, окружающей аденому.
ТТГ-секретирующие аденомы гипофиза встречаются редко; на их долю приходится менее 1% всех опухолей гипофиза. В типичных случаях развивается тиреотоксикоз на фоне нормального или повышенного уровня ТТГ.
Избирательная резистентность гипофиза к тиреоидным гормонам — состояние, при котором отсутствует отрицательная обратная связь между уровнем тиреоидных гормонов щитовидной железы и уровнем ТТГ гипофиза, характеризуется нормальным уровнем ТТГ, значительным повышением уровней Т4 и Т3 и тиреотоксикозом (поскольку чувствительность других тканей-мишеней к тиреоидным гормонам не нарушена). Опухоль гипофиза у таких больных не визуализируется.
Пузырный занос и хориокарцинома секретируют большие количества хорионического гонадотропина (ХГ). Хорионический гонадотропин, сходный по своей структуре с ТТГ, вызывает транзиторное подавление тиреотропной активности аденогипофиза и увеличение уровня свободного Т4. Этот гормон — слабый стимулятор рецепторов ТТГ на тиреоцитах. Когда концентрация ХГ превышает 300 000 ед/л (что в несколько раз больше максимальной концентрации ХГ при нормальной беременности), может возникнуть тиреотоксикоз. Удаление пузырного заноса или химиотерапия хориокарциномы устраняют тиреотоксикоз. Уровень ХГ может значительно повышаться и при токсикозе беременных и служить причиной тиреотоксикоза [1].
Разрушение щитовидной железы
Деструкция тиреоцитов, при которой происходит поступление тиреоидных гормонов в кровь и как следствие — развитие тиреотоксикоза, сопровождают воспалительные заболевания щитовидной железы — тиреоидиты. В основном это транзиторные аутоиммунные тиреоидиты (АИТ), к которым относятся безболевой («молчащий») АИТ, послеродовой АИТ, цитокин-индуцированный АИТ. При всех этих вариантах в щитовидной железе происходят пофазовые изменения, связанные с аутоиммунной агрессией: при наиболее типичном течении фаза деструктивного тиреотоксикоза сменяется фазой транзиторного гипотиреоза, после чего в большинстве случаев происходит восстановление функции щитовидной железы.
Послеродовой тиреоидит возникает на фоне избыточной реактивации иммунной системы после естественной гестационной иммуносупрессии (феномен рикошета). Безболевая («молчащая») форма тиреоидита проходит так же, как и послеродовая, но только провоцирующий фактор неизвестен, протекает вне связи с беременностью. Цитокин-индуцированный тиреоидит развивается после назначения по поводу различных заболеваний препаратов интереферона [2].
Развитие тиреотоксикоза возможно не только при аутоиммунном воспалении в щитовидной железе, но и при инфекционном ее повреждении, когда разивается подострый гранулематозный тиреоидит. Считается, что причиной подострого гранулематозного тиреоидита является вирусная инфекция. Предполагают, что возбудителями могут быть вирус Коксаки, аденовирусы, вирус эпидемического паротита, ECHO-вирусы, вирусы гриппа и вирус Эпштейна–Барр. Существует генетическая предрасположенность к подострому гранулематозному тиреоидиту, поскольку заболеваемость выше у лиц с антигеном HLA-Bw35. Для продромального периода (продолжается несколько недель) характерны миалгия, субфебрильная температура, общее плохое самочувствие, ларингит, иногда дисфагия. Синдром тиреотоксикоза возникает у 50% больных и появляется в стадии выраженных клинических проявлений, к которым относится боль на одной стороне передней поверхности шеи, обычно иррадиирующая в ухо или нижнюю челюсть с той же стороны.
Другие причины тиреотоксикоза
Медикаментозный тиреотоксикоз — частая причина тиреотоксикоза. Нередко врач назначает чрезмерные дозы гормонов; в других случаях больные тайком принимают излишние количества гормонов, иногда с целью похудеть.
T4- и T3-секретирующая тератома яичника (яичниковая струма) и крупные гормонально-активные метастазы фолликулярного рака щитовидной железы — очень редкие причины тиреотоксикоза.
Клиническая картина при синдроме тиреотоксикоза
Сердечно-сосудистая система. Наиболее важным органом-мишенью при нарушениях функции щитовидной железы является сердце. В 1899 г. R. Kraus ввел термин «тиреотоксическое сердце», под которым понимается симптомокомплекс нарушений деятельности сердечно-сосудистой системы, вызванных токсическим действием избытка тиреоидных гормонов, характеризующимся развитием гиперфункции, гипертрофии, дистрофии, кардиосклероза и сердечной недостаточности.
П
 атогенез сердечно-сосудистых нарушений при тиреотоксикозе связан со способностью ТГ непосредственно связываться с кардиомиоцитами, оказывая положительный инотропный эффект. Кроме того, повышая чувствительность и экспрессию адренорецепторов, тиреоидные гормоны обуславливают значительные изменения гемодинамики и развитие острой патологии сердца, особенно у больных с ишемической болезнью сердца. Происходит увеличение ЧСС, повышение ударного объема (УО) и минутного объема (МО), ускорение кровотока, снижение общего и периферического сопротивления сосудов (ОПСС), изменение артериального давления. Систолическое давление умеренно нарастает, диастолическое остается нормальным или пониженным, вследствие чего увеличивается пульсовое давление. Помимо всего перечисленного тиреотоксикоз сопровождается увеличением объема циркулирующей крови (ОЦК) и эритроцитарной массы. Причиной увеличения ОЦК является изменение сывороточного уровня эритропоэтина в соответствии с изменением сывороточного уровня тироксина, что приводит к увеличению массы эритроцитов. В результате увеличения минутного объема и массы циркулирующей крови, с одной стороны, и снижения периферического сопротивления, с другой, увеличиваются пульсовое давление и нагрузка на сердце в диастолу.
атогенез сердечно-сосудистых нарушений при тиреотоксикозе связан со способностью ТГ непосредственно связываться с кардиомиоцитами, оказывая положительный инотропный эффект. Кроме того, повышая чувствительность и экспрессию адренорецепторов, тиреоидные гормоны обуславливают значительные изменения гемодинамики и развитие острой патологии сердца, особенно у больных с ишемической болезнью сердца. Происходит увеличение ЧСС, повышение ударного объема (УО) и минутного объема (МО), ускорение кровотока, снижение общего и периферического сопротивления сосудов (ОПСС), изменение артериального давления. Систолическое давление умеренно нарастает, диастолическое остается нормальным или пониженным, вследствие чего увеличивается пульсовое давление. Помимо всего перечисленного тиреотоксикоз сопровождается увеличением объема циркулирующей крови (ОЦК) и эритроцитарной массы. Причиной увеличения ОЦК является изменение сывороточного уровня эритропоэтина в соответствии с изменением сывороточного уровня тироксина, что приводит к увеличению массы эритроцитов. В результате увеличения минутного объема и массы циркулирующей крови, с одной стороны, и снижения периферического сопротивления, с другой, увеличиваются пульсовое давление и нагрузка на сердце в диастолу.Основными клиническими проявлениями патологии сердца при тиреотоксикозе являются синусовая тахикардия, мерцание предсердий (МП), сердечная недостаточность и метаболическая форма стенокардии. В случае наличия у пациента ишемической болезни сердца (ИБС), гипертонической болезни, пороков сердца тиреотоксикоз лишь ускорит возникновение аритмий. Существует прямая зависимость МП от степени тяжести и длительности заболевания.
Основной особенностью синусовой тахикардии является то, что она не исчезает во время сна и незначительная физическая нагрузка резко увеличивает частоту сердечных сокращений. В редких случаях встречается синусовая брадикардия. Это может быть связано с врожденными изменениями либо с истощением функции синусового узла с развитием синдрома его слабости.
Мерцание предсердий встречается в 10–22% случаев, причем частота этой патологии увеличивается с возрастом. В начале заболевания мерцание предсердий носит пароксизмальный характер, а с прогрессированием тиреотоксикоза может перейти в постоянную форму. У больных молодого возраста без сопутствующей сердечно-сосудистой патологии после субтотальной резекции щитовидной железы или успешной тиреостатической терапии происходит восстановление синусового ритма. В патогенезе мерцания предсердий важную роль играет нарушение электролитного баланса, точнее, снижение уровня внутриклеточного калия в миокарде, а также истощение номотропной функции синусового узла, что приводит к его истощению и переходу на патологический ритм.
Для тиреотоксикоза более характерны предсердные нарушения ритма, а появление желудочковых аритмий характерно лишь для тяжелой формы. Это может быть связано с более высокой чувствительностью предсердий к аритмогенному действию ТТГ по сравнению с желудочками, так как плотность бета-адренорецепторов в ткани предсердий преобладает. Как правило, желудочковые аритмии встречаются при сочетании тиреотоксикоза с сердечно-сосудистыми заболеваниями. При наступлении стойкого эутиреоза они сохраняются [5].
Опорно-двигательный аппарат. Усиление катаболизма приводит к слабости и атрофии мышц (тиреотоксическая миопатия). Больные выглядят истощенными. Мышечная слабость проявляется при ходьбе, подъеме в гору, вставании с колен или поднятии тяжестей. В редких случаях встречается преходящий тиреотоксический паралич, длящийся от нескольких минут до нескольких суток.
П
 овышенный уровень тиреоидных гормонов приводит к отрицательному минеральному балансу с потерей кальция, что проявляется усиленной резорбцией кости и сниженным кишечным всасыванием этого минерала. Резорбция костной ткани преобладает над ее образованием, поэтому концентрация кальция в моче повышена.
овышенный уровень тиреоидных гормонов приводит к отрицательному минеральному балансу с потерей кальция, что проявляется усиленной резорбцией кости и сниженным кишечным всасыванием этого минерала. Резорбция костной ткани преобладает над ее образованием, поэтому концентрация кальция в моче повышена.У больных гипертиреозом обнаруживаются низкие уровни метаболита витамина D-1,25(ОН)2D, иногда гиперкальциемия и снижение уровня паратгормона в сыворотке. Клинически все эти нарушения приводят к развитию диффузного остеопороза. Возможны боли в костях, патологические переломы, коллапс позвонков, формирование кифоза. Артропатия при тиреотоксикозе развивается редко, по типу гипертрофической остеоартропатии с утолщением фаланг пальцев и периостальными реакциями.

