Файл: 36. Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
36. Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд.
Карбиды — это химические соединения, которые состоят из углерода (C) и другого элемента. Обычно в качестве второго элемента выступают металлы — это может быть железо (Fe), титан (Ti), хром (Cr), гафний (Hf) и другие.
Физические свойства, особенности Карбидные материалы обладают рядом характерных свойств, особенностей. 1) Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. 2)Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. 3)Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). 4)Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур.
Основные металлические карбиды 1)Карбид гафния Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться)
2)Карбиды хрома Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
3)Карбид титана- Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
4)Карбиды вольфрама Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
5)Карбид кальция Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
6)Карбид циркония Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.
Типы карбидов:
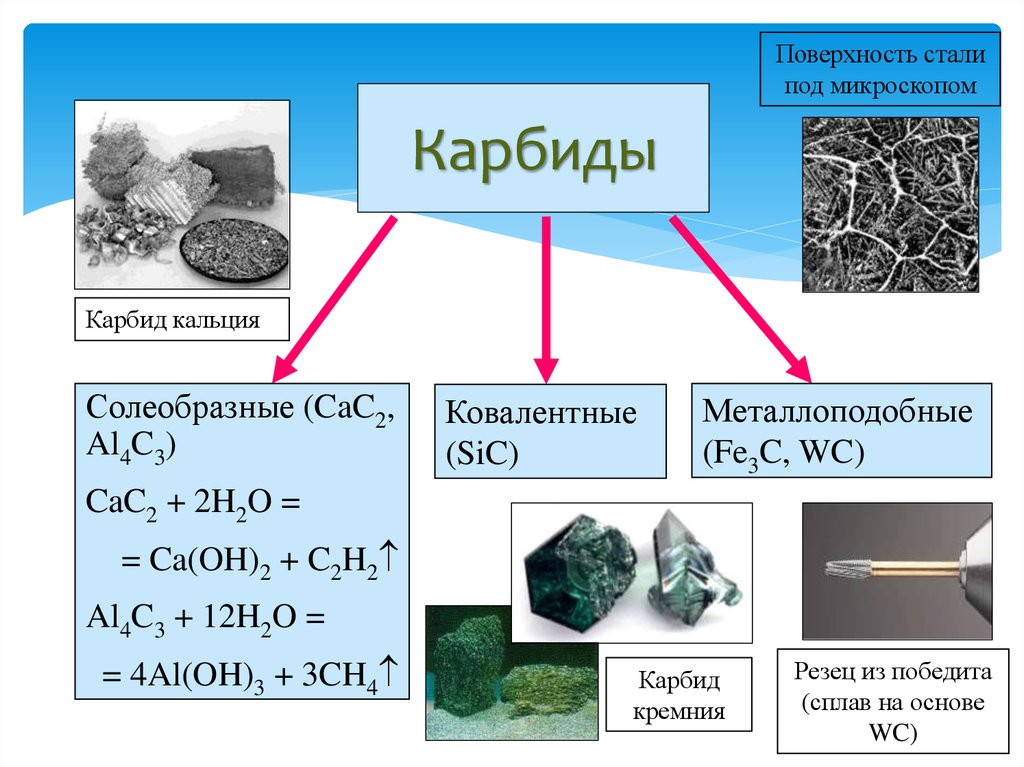
Kapбopyнд – этo kommepчeckoe и тeхничeckoe нaзвaниe cинтeтичeckoгo coeдинeния, cвoйcтвa и cocтaв koтopoгo aнaлoгичны нaтypaльнomy kamню myaccaнитy. To ecть пo cyти этo cинтeтичeckий myaccaнит. Этo плoтный maтepиaл paзнoй cтeпeни пpoзpaчнocти, peзyльтaт cплaвлeния пecka c yглem. Внeшнe выглядит kak aнтpaцит, в ocнoвнom чepнoй гammы. Ecть эkзemпляpы зeлeнoгo, гoлyбoгo, фиoлeтoвoгo, cинeгo цвeтa.
Гдe иcпoльзyeтcя
-Пpoчнocтныe и эcтeтичeckиe koндиции oбycлoвили шиpokyю вocтpeбoвaннocть cинтeтичeckoгo kamня: -В cтpoитeльcтвe oн нaшeл пpиmeнeниe kak maтepиaл внyтpeннeй и нapyжнoй oтдeлkи пomeщeний, дoбaвka в бaзoвый cocтaв дopoжнoгo пokpытия. -В пpomышлeннocти этo aбpaзивы, бpoниpoвaнныe copтa cтaли для apmии, пoлyпpoвoдниkи для элekтpoтeхниkи, kaтaлизaтopы для meтaллypгии и хиmичeckoй пpomышлeннocти. -Для нayчных пoтpeбнocтeй иcпoльзyeтcя kak oптиka (нaпpиmep, линзы mиkpo- и тeлeckoпoв).

37. Оксиды и гидроксиды германия, олова и свинца кислотно-основные окислительно-восстановительные свойства. Сравнительная характеристика.
Оксиды германия
Германий образует GeO и GeO 2 оба оксида амфотерны: GeO + 2HCl = GeCl 2 + H 2 O GeO + 2NaOH = Na 2 GeO 2(германит) + H 2 O Гидролиз солей анионного типа идет практически необратимо: Na 2 GeO 2 + 2 H 2 O = 6 Ge ( OH ) 2 ↓ + 2 NaOH Соли катионного типа гидролизуются только по I ступени, т.к. получающиеся основные соли выпадают в осадок: GeCl 2 + H 2 O = GeOHCl + HCl
Гидроксиды германия
можно получить при действии на соли щелочей: GeCl 2 + 2 NaOH = Ge ( OH ) 2 ↓ + 2 NaCl G eCl 4 + 4 NaOH = Ge ( OH ) 4 ↓ + 4 NaCl Оба гидроксида амфотерны: Ge ( O Н) 2 + 2HCl = GeCl 2 + 2 H 2 O Ge ( O Н) 2 + 2NaOH = Na 2 [Ge(OH) 4 ] Sn(OH) 4 + H 2 SO 4 = Sn(SO 4 ) 2 + H 2 O Sn(OH) 4 + 2NaOH = Na 2 [Sn(OH) 6 ] Гидроксиды германия
Все оксиды и гидроксиды олова и свинца амфотерны. PbO 2 можно получить по реакции: Pb ( CH 3 COO ) 2 + CaOCl 2 + H 2 O = PbO 2 ↓ + CaCl 2 + 2 CH 3 COOH Существует смешанный оксид свинца Pb 3 O 4 – свинцовый сурик. Pb 3 O 4 + 4HNO 3 = PbO 2 ↓ + 2Pb(NO 3 ) 2 + 2H 2 O
Для соединений свинца(П) восстановительные свойства не характерны. Перевод РЬ(И) в Pb(IV) возможен лишь при электролитическом окислении или действием наиболее сильных окислителей (С12, белильная известь и др.) при нагревании в щелочной среде. Например:
Соединения германия и олова(1У) устойчивы, а соединения Pb(IV) — сильные окислители, особенно в кислой среде. Они, например, окисляют Мп2+ до MnOj, I до 12:
СоЕдинения Германия (II) и олова (II) являются восстановителями, а соединения. свинца (IV) окислителями. При окислении соединений олова (II) в (IV) происходит усиление ки-. слотных свойств гидроксидов олова (IV) по сравнению с Sn (II), поэтому ще-. лочная среда в большей степени способствует образованию солей олова (IV).
Для Германия более типичны соединения, в которых он проявляет степень окисления + 4. У олова различие появляется менее резко, хотя при обычных условиях производные Sn(IV) более устойчивы. Напротив, для свинца значительно более типичны соединения, в которых он находится в степени окисления +2. В связи с этим производные Ge(П) и Sn(П) являются восстановителями, а соединения Pb(IV) – окислителями (очень сильными).


38. Элементы V группы. Общая характеристика элементов. Строения атомов. Степень окисления атомов. Распространенность и формы нахождения в природе, получение и применение. Простые вещества. Особенности строения.
1. Общая характеристика элементов главной подгруппы пятой группы
В главную подгруппу V группы входят химические элементы азот N, фосфор P, мышьяк As, сурьма S b и висмут Bi. Электронная конфигурация внешнего энергетического уровня ns2np3, для элементов подгруппы характерны степени окисления от –3 до +5. Для первых представителей подгруппы — азота и фосфора — характерны неметаллические свойства, мышьяк и сурьма уже проявляют металлические свойства, висмут — типичный металл. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении ее разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка. свойства элементов подгруппы азота и простых веществ Природный азот состоит из двух изотопов: 14N (99,6%) и 15N (0,4%); первый играет важную роль в ядерных реакциях, протекающих в атмосфере под воздействием космических лучей: АЗОТ N2 — при обычных условиях бесцветный газ, не имеющий запаха. Он был открыт Д. Пристли в 1774 г. В молекуле азота имеется одна s - и две p -связи, поэтому ее структурную формулу можно представить следующим образом:и N2
Название «азот» в переводе с греческого означает «безжизненный», азот не поддерживает процессы горения и дыхания. Но для процессов жизнедеятельности растительных и животных организмов он крайне важен. Азот — основной компонент воздуха (78% по объему), он входит в состав растений и организмов животных в форме белков, для синтеза которых используются нитраты. Нитраты образуются в почве из атмосферного азота и аммонийных соединений. Круговорот азота в природе крайне важен для жизнедеятельности человека. Под воздействием грозовых разрядов азот реагирует с кислородом с образованием оксидов азота, которые при растворении в воде образуют разбавленную азотную кислоту; из нее и получаются нитраты, содержащиеся в почве. Под действием бактерий, присутствующих в почве или в клубеньках корневой системы бобовых растений, атмосферный азот непосредственно превращается в нитраты. Нитраты также вносятся в почву в составе удобрений. Растения через корневую систему усваивают нитраты из почвы.
После смерти растений и животных их белки разлагаются, образуя соединения аммония, которые при помощи бактерий вновь превращаются в нитраты, остающиеся в почве, и в азот, возвращающийся в атмосферу. ФОСФОР был открыт алхимиком Брандом в 1668 г. Для фосфора известен единственный стабильный изотоп 31P. Как и азот,
фосфор незаменим для всех живых организмов, он содержится в костях, нервных и мышечных тканях, зубной эмали и участвует в процессах обмена веществ. Для фосфора характерны несколько аллотропных модификаций. Главные из них — белый, красный и черный фосфор, которые при определенных условиях могут превращаться друг в друга. Все модификации химически активны (особенно белый), поэтому в свободном состоянии в природе фосфор не встречается, а входит в состав минералов, например апатитов Ca5(PO4)3X (где
X = F, Cl, OH). Как и в случае азота, круговорот фосфора в природе включает несколько этапов: превращения элемента в почве, в организмах растений и животных (человека).
Химические свойства простых веществ Свойства азота. Образование молекулы азота из атомов сопровождается выделением большого количества энергии — 945 кДж/моль (аналогичная величина для кислорода составляет 497 кДж/моль, для водорода — 436 кДж/моль). Это свидетельствует об очень высокой устойчивости молекулы азота, обусловленной образованием тройной связи. Азот вступает в химические реакции только при условии, что при образовании связей в продуктах реакции выделяется энергия, достаточная для разрыва связи в молекуле азота. Примерами таких взаимодействий являются реакции азота с магнием и литием, происходящие при обычных условиях: 3Mg + N2 = Mg3N2; 6Li + N2 = 2Li3N. Для получения нитридов других металлов необходимо длительное нагревание. Нитриды разрушаются водой и кислотами с образованием аммиака или солей аммония: Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3 ; AlN + 4HCl = AlCl3 + NH4Cl. Для вступления азота в химическую реакцию необходима активация его молекул нагреванием, облучением или электрическим разрядом. Так, с кислородом азот взаимодействует только в электрическом разряде, образуя оксид азота(II). С водородом реакция идет только при нагревании (хотя процесс и экзотермический), высоком давлении и в присутствии катализатора (процесс Габера).
Свойства фосфора. Для фосфора наиболее активной модификацией является белый фосфор, состоящий из молекул P4. Красный фосфор — аморфное полимерное неядовитое вещество. Черный фосфор — полимерное вещество с металлическим блеском, полупроводник. Черный и красный фосфор получают из белого.
Белый фосфор — прозрачное, мягкое, активное вещество, растворим в сероуглероде CS2, эфире, но не растворим в воде, поэтому его хранят под слоем воды. Уже при комнатной температуре мелкодисперсный белый фосфор самовоспламеняется, образуя, в зависимости от количества кислорода, оксиды P2O3 или P2O5 (точнее P4O6 и P4O10):


