Файл: 36. Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
P4 + 3O2 = P4O6; P4 + 5O2 = P4O10. Белый фосфор может воспламениться даже под водой под воздействием струи газообразного кислорода. В отличие от азота белый фосфор активно реагирует с галогенами, серой с образованием PCl5, PCl3, PBr5, PBr3, P2S5, P2S3: P4 + 6Br2 4PBr3; P4 + 10Cl2 4PCl5; P4 + 6S 2P2S3. Красный и черный фосфор гораздо менее активны, эти модификации вступают в различные химические реакции при более высоких температурах. Так же, как и азот, фосфор реагирует с металлами, образуя фосфиды, которые, как и нитриды, легко разлагаются водой или кислотами с образованием фосфина PH3: 6Ca + P4 = 2Ca3P2; Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3 ; Ca3P2 + 6HCl = 3CaCl2 + 2PH3 . Только белый фосфор реагирует с горячими растворами щелочей, образуя фосфин и гипофосфиты, например Ba(H2PO2)2 : 2P4 + 3Ba(OH)2 + 6H2O = 3Ba(H2PO2)2 + 2PH3 . Последнюю реакцию используют в лаборатории для получения фосфина и гипофосфитов (солей фосфорноватистой кислоты H3PO2), из которых затем по обменной реакции получают H3PO2: Ba(H2PO2)2 + H2SO4 = BaSO4 ¯ + 2H3PO2. Непосредственно с водородом ни фосфор, ни более тяжелые представители подгруппы практически не взаимодействуют.
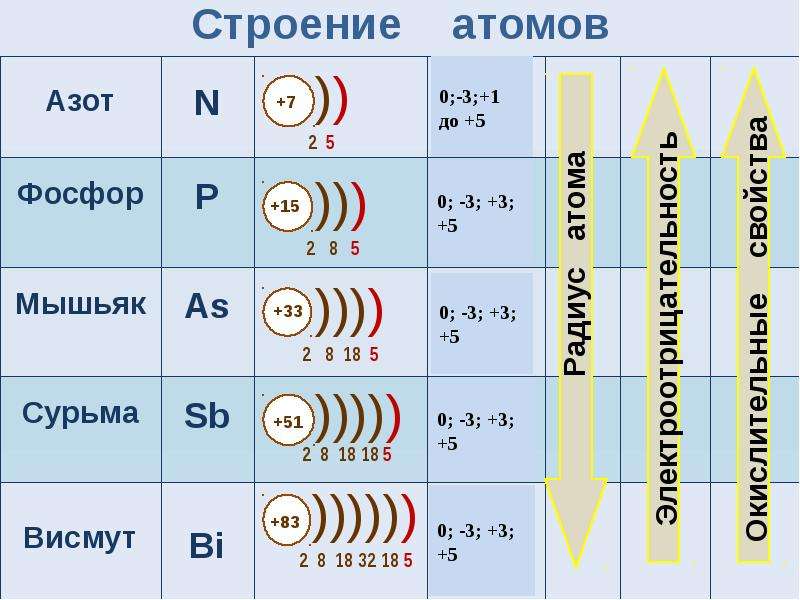
для элементов подгруппы характерны степени окисления от –3 до +5.












39.Аллотропные модификации фосфора. Химические и физические свойства простых веществ. Реакционная способность молекулярного азота, белого и красного фосфора.Строение молекул. Получение, свойства, применение.
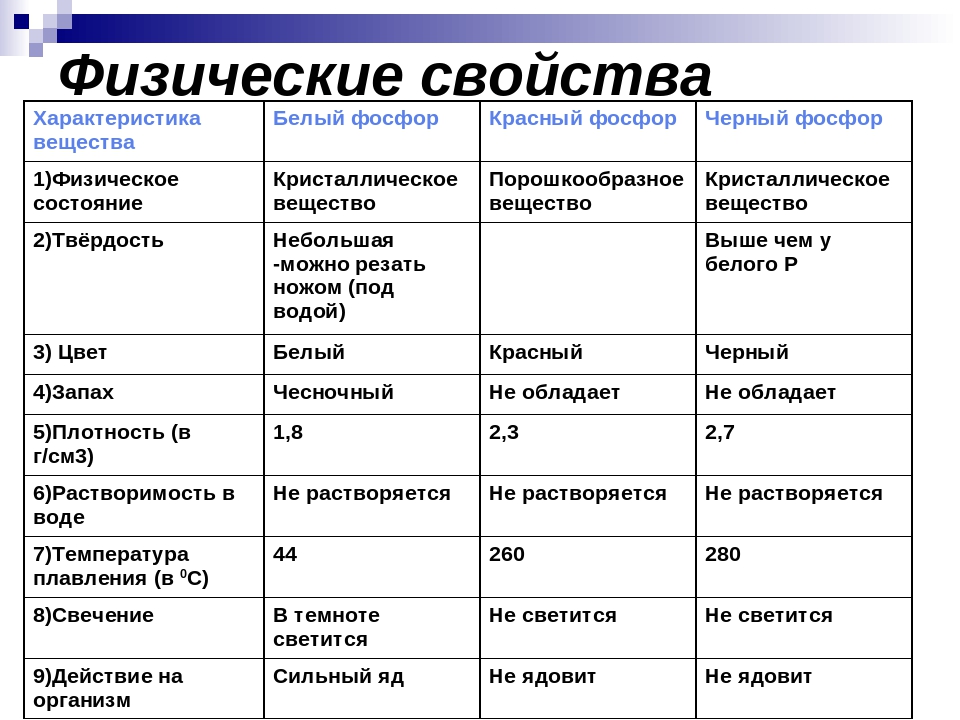
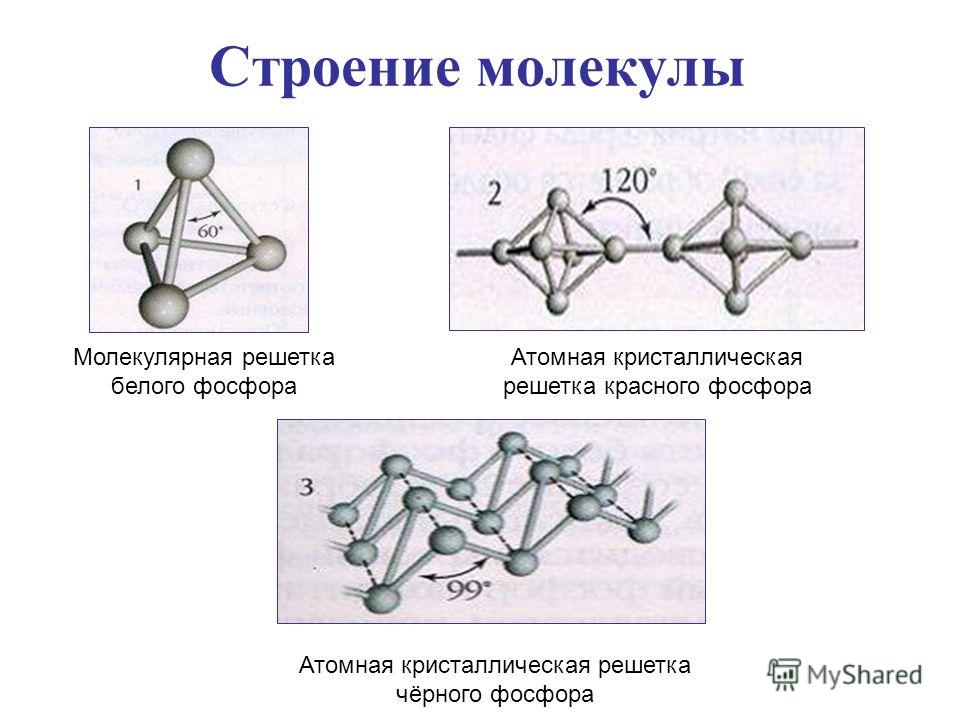
Аллотропные модификации фосфора: Фосфор может существовать в нескольких аллотропных модификациях: белый фосфор, красный, черный и металлический фосфор. В обычных условиях существуют первые три, а при сверхвысоких давлениях существует и металлический фосфор. Все эти аллотропные модификации различаются по цвету, плотности и другим характеристикам.Белый фосфор состоит из тетраэдрических молекул Р4 (рис. 3). Связь – ковалентная неполярная, одинарная. Но так как это напряженная структура, эти связи легко разрываются. Этим объясняется высокая химическая активность белого фосфора, а также его склонность при нагревании или хранении переходить в более стабильные полимерные модификации. При обычных условиях – это твердое вещество, легкоплавкое и летучее. Нерастворим в воде. Белый фосфор хранят под слоем воды. Но он хорошо растворим в неполярных органических растворителях: сероуглерод, бензол и др. Белый фосфор окисляется кислородом. Выделяющаяся при этом энергия выделяется не в форме тепла, а виде света, за счёт чего белый фосфор и способен светиться (рис. 4). Светится он только на поверхности и при окислении кислородом, т. е. фосфор, находящийся под слоем воды, светиться не будет. Белый фосфор – это очень ядовитое вещество. Летальная дозировка белого фосфора для взрослого человека – это 0,05 – 0,01 г. Большинство боевых отравляющих веществ, таких как зарин, зоман – это соединения фосфора.
Красный фосфор (рис. 4) образован полимерными молекулами различной длины. Молекулы состоят из пирамидально связанных атомов фосфора. При обычных условиях – это твердое аморфное вещество красного цвета, способное возгоняться при нагревании. При конденсации паров красного фосфора, образуется белый фосфор. Красный фосфор нерастворим в подавляющем большинстве растворителей.
Чёрный фосфор (рис. 5) – это вещество немолекулярного строения. Его кристаллическая решетка – атомно слоистая с характерным для фосфора пирамидальным расположением связей. Это твердое вещество, напоминающее графит, с высокой температурой плавления. Он способен проводить электрический ток.
Химические свойства Фосфор, являясь типичным неметаллом, реагирует с кислородом, галогенами, серой, металлами, окисляются азотной кислотой. В реакциях он может проявлять себя как окислителем, так и восстановителем. Взаимодействие с кислородом белого P приводит к образованию оксидов Р2О3 (оксид фосфора 3) и Р2О5 (оксид фосфора 5), причём
первый образуется при недостатке кислорода, а второй — при избытке: 4Р + 3О2 = 2Р2О3 4Р + 5О2 = 2Р2О5 взаимодействие с металлами Взаимодействие с металлами приводит к образованию фосфидов, в которых P находится в степени окисления -3, то есть в этом случае он выступает в роли окислителя. с магнием: 3Mg + 2P = Mg3P2 с натрием: 3Na + P = Na3P с кальцием: 3Ca + 2P = Ca3P2 с цинком: 3Zn + 2P = Zn3P2 взаимодействие с неметаллами С более электроотрицательными неметаллами P взаимодействует как восстановитель, отдавая электроны и переходя в положительные степени окисления. При взаимодействии с хлором образуются хлориды: 2Р + 3Cl2 = 2PCl3 — при недостатке Cl2 2Р + 5Cl2 = 2PCl5 — при избытке Cl2 Однако с йодом возможно образование только одного йодида: 2Р + 3I2 = 2PI3 С другими галогенами возможно образование соединений 3-х и 5-ти валентного Р в зависимости от соотношения реагентов. При реакции с серой или фтором также образуются два ряда сульфидов и фторидов: 2Р + 3S = P2S3 2Р + 5S = P2S5 Р + 3F = PF3 Р + 5F = PF5 взаимодействие с кислотами 3P + 5HNO3(разб.) + H2O = 3H3PO4 + 5NO↑ P + 5HNO3(конц.) = H3PO4 + 5NO2↑ + H2O 2P + 5H2SO4(конц.) = 2H3PO4 + 5SO2↑ + H2O С другими кислотами P не взаимодействует. взаимодействие с гидроксидами Белый фосфор способен реагировать при нагревании с водными растворами щелочей: P4 + 3KOH + 3H2O = PH3↑ + 3KH2PO2 2P4 + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2) В результате взаимодействия образуется летучее водородное соединение — фосфин (РН3), в котором степень окисления фосфора=-3 и соли фосфорноватистой кислоты (Н3РО2) — гипофосфиты, в которых Р находится в нехарактерной степени окисления +1.


40. Образование и устойчивости ионов аммония и фосфония. Жидкий аммиак как растворитель в. Реакции присоединения. Реакции замещения атомов водорода в аммиаке. Амиды, имиды, нитриды. Реакция окисления аммиака.
Жидкий аммиак Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой: 2NH3 → NH4+ + NH2− Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)². Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9. Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3. Растворенный в NH3 металл постепенно реагирует с образованием амида: 2Na + 2NH3 → 2NaNH2 + H2 Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O. Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Реакции замещения водорода в молекуле аммиака. Эти реакции очень разнообразны и протекают с заместителями различной электроотрицательности.При взаимодействии аммиака со щелочными и щелочноземельными металлами происходят реакции окислитсльно- восстановителыюго замещения, в которых азот не изменяет своей степени окисления, а водород восстанавливается. Щелочные и щелочноземельные металлы растворяются в жидком аммиаке и медленно реагируют с ним, образуя бесцветные солеобразные амиды:Прокаливание амидов приводит к образованию имидов и нитридов' Очень большое значение имеют производные аммиака, в которых водород замещен на углерод, имеющий электроотрицательность (2,55), близкую к электроотрицательности водорода (2,2).В химической промышленности используют амины — производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Возникающие при таком замещении связи N—С по прочности сравнимы со связями N—Н (см. параграф 19.1). В зависимости от числа замещенных атомов водорода различают первичные (замещен один атом Н), вторичные (замещены два атома Н) и третичные (замещены три атомы Н) амины. Существует несколько способов получения этих веществ. Их можно получить, например, при взаимодействии аммиака со спиртами в присутствии катализаторов, ускоряющих процесс дегидратации: Растворенные в воде амины, подобно аммиаку, проявляют свойства слабых оснований:Если на третичный амин подействовать алкилгалогени- дом, то образуется четвертичная аммониевая соль, содержащая катион алкиламмопия, который можно рассматривать как катион аммония, в котором все четыре атома водорода замещены на углеводородные радикалы. Например, при взаимодействии гриметиламина с метилиодидом образуется соль иодид тетраметиламмония:Соли, содержащие катионы алкиламмония, — кристаллические вещества. Из четвертичных аммониевых солей можно получить четвертичные аммониевые основания. Например, из иодида тетраметиламмония можно получить гидроксид тетраметиламмония:Четвертичные аммониевые основания — сильные электролиты, сравнимые по силе с гидроксидами натрия и калия.
Амиды — производные кислородсодержащих кислот, в которых гидроксильная группа кислотного остатка заменена аминогруппой. Амиды также можно рассматривать как ацилпроизводные аминов. Соединения с одним, двумя или тремя ацильными заместителями у атома азота называются первичными, вторичными и третичными амидами соответственно. Вторичные амиды также называют имидами. Амиды карбоновых кислот — карбоксамиды RCO−NR1R2 (где R1 и R2 — водород или другой остаток) — обычно называют просто амидами. В случае же других кислот, в соответствии с рекомендациями IUPAC, при именовании амида в качестве префикса указывается название класса кислоты, например амиды сульфокислот RSO2NH2 называются сульфамидами. Аналоги амидов, формально являющиеся продуктами замещения кислорода на халькоген, называются тиоамидами, селеноамидами и теллуроамидами. Номенклатура Название класса амидов происходит от названия аммиака. Золотая книга ИЮПАК делит амиды на первичные, вторичные и третичные в зависимости от числа ацильных остатков при атоме азота. Однако ту же классификацию применяют и в тех случаях, если остатки не ацильные, а любые органические: RCONH2 — первичные амиды; RCONHR’ — вторичные амиды; RCONR’R» — третичные амиды. Если атом азота содержит две или три ацильные группы, такие соединения называют также имидами и триациламинами соответственно. Циклические амиды называют лактамами. Названия первичных амидов образуют от названий соответствующих карбоновых кислот, добавляя к ним «-амид»: CH3CONH2 — ацетамид; C5H11CONH2 — гексанамид; PhCONH2 — бензамид. Если атом азота дополнительно замещён, его заместители перечисляют в начале названия с приставкой «N» вместо локанта (N,N-диметилформамид). Моноамиды дикарбоновых кислот называют с помощью окончания «-амовая кислота», например моноамид фталевой кислоты можно назвать фталамовой кислотой.
Ими́ды карбо́новых кисло́т — соединения, содержащие группу -CO-NR-CO-, диацилпроизводные аммиака (R = H) или аминов. Ациклические имиды — производные монокарбоновых кислот также называют диациламинами, большое значение в синтетической химии имеют циклические имиды дикарбоновых кислот.
 Реакция окисления аммиака
Реакция окисления аммиакаОни протекают с изменением состояния окисления азота. Так как аммиак - хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей. Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается). Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O. При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O
41. Окислительные свойства концентрированной и разбавленной азотной кислотой. Взаимодействие азотной кислоты с металлами и неметаллами. Царская водка.
Окислительно-восстановительные свойства азотной (HNO3) Азотная кислота относится к числу очень сильных электролитов. Наиболее характерным ее свойством является ярко выраженная окислительная способность, причем как в разбавленной , так и в концентрированной кислоте окислителем является пятивалентный азот (N5+), входящий в ион NO3-. Азотная кислота может восстанавливаться до следующих продуктов: HNO3-NO2-HNO2-NO-N2O-N2-NH3,где валентность азота соответственно равна: +5,+4,+3,+2,+1,0,-3. Степень восстановления азотной кислоты зависит как от концентрации самой кислоты, так и от активности восстановителя. Концентрированная HNO3 при взаимодействии с металлами восстанавливается до NO2 (бурый газ); разбавленная HNO3 до NO (бесцветный газ, буреющий на воздухе), и при действии на активные металлы (левее водорода в ряду стандартных потенциалов) до N2O, N2 и NH4NO3.При окислении неметаллов азотная кислота восстанавливается до NO. Соли азотной кислоты (нитраты) обладают окислительными свойствами

