Файл: Контрольная работа по общей и неорганической химии Вариант 35 студент гр. Зтуд122 Шипиев Д. А. Проверил.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования РФ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Владимирский государственный университет им. А.Г. и Н.Г. Столетовых»
Кафедра химии
Контрольная работа по общей и неорганической химии
Вариант № 35
Выполнил:
студент гр. ЗТуд-122
Шипиев Д.А.
Проверил:
Красильникова И.А.
Владимир 2023
№16

№51
а) N2 - 3 связи
НNO3- 5 связей
б) тетраэдр
в) наиболее полярная SiF4, так как между элементами наибольшая разница в ЭО
У F ЭО = 4, а у Si = 1,8
г) 2 связи
№122
-
0,15*80 = 12 (г) KNO3 было в первоначальном растворе
80+40 = 120 (г) масса нового раствора
12/120 = 0,1
Ответ: 10 %
-
Дано
Vppa=1.5L
Cн=0.2Н
найти
m(CuSO4*5H2O)-?
m(CuSO4*5H2O)=Cн*Vppa*M(CuSO4*5H2O)=0.2*1.5*249.5=74.85g
M(CuSO4*5H2O)=249.5g/mol
ответ 74.85 гр
-
В 100 г 10 %-гораствора содержится 10г карбамида и 90г воды. Далее в решении используем уравнение (2), т.е.
Р = Р°- Р°∙ NB = P°(1-NB).
Из этого соотношения и уравнения (2) для нашего расчёта выводим формулу:
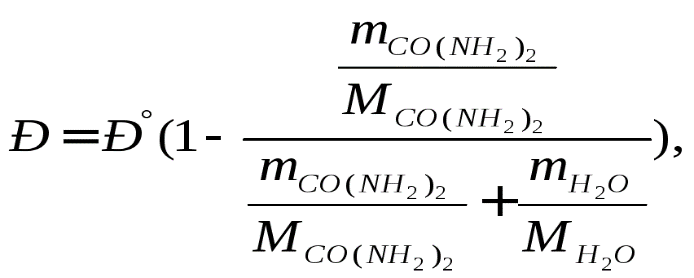
где Р° = 101,32 кПа - давление насыщенного пара над водой при 100°С [5, табл. 16];
m
тогда
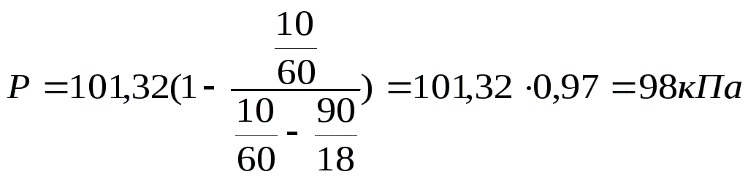
.
Ответ:98 кПа.
№145

№231
ПЕРВАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение Fe2(SO4)3 + 2HOH ⇄ 2FeOHSO4 + H2SO4
Полное ионное уравнение 2Fe3+ + 3SO42- + 2HOH ⇄ 2FeOH2+ + 2SO42- + 2H+ + SO42-
Сокращенное (краткое) ионное уравнение Fe3+ + HOH ⇄ FeOH2+ + H+
ВТОРАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение 2FeOHSO4 + 2HOH ⇄ (Fe(OH)2)2SO4 + H2SO4
Полное ионное уравнение 2FeOH2+ + 2SO42- + 2HOH ⇄ 2Fe(OH)2+ + SO42- + 2H+ + SO42-
Сокращенное (краткое) ионное уравнение FeOH2+ + HOH ⇄ Fe(OH)2+ + H+
ТРЕТЬЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение (Fe(OH)2)2SO4 + 2HOH ⇄ 2Fe(OH)3 + H2SO4
Полное ионное уравнение 2Fe(OH)2+ + SO42- + 2HOH ⇄ 2Fe(OH)3 + 2H+ + SO42- Сокращенное (краткое) ионное уравнение Fe(OH)2+ + HOH ⇄ Fe(OH)3 + H+
В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7).
ПЕРВАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение K2CO3 + HOH ⇄ KHCO3 + KOH
Полное ионное уравнение 2K+ + CO32- + HOH ⇄ K+ + HCO3- + K+ + OH- Сокращенное (краткое) ионное уравнение CO32- + HOH ⇄ HCO3- + OH-
ВТОРАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА
Молекулярное уравнение KHCO3 + HOH ⇄ H2CO3 + KOH
Полное ионное уравнение K+ + HCO3- + HOH ⇄ H2CO3 + K+ + OH-
Сокращенное (краткое) ионное уравнение HCO3- + HOH ⇄ H2CO3 + OH-
В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7).
Pb(CH3COO)2 - соль слабого основания и слабой кислоты, гидролизуется по аниону и по катиону преимущественно по 1 ступени:
Pb(CH3COO)2 → Pb2+ + 2CH3COO–
1 ст.
Pb2+ + НОН ⇆ PbОН+ + Н+
CH3COO– + НОН ⇆ CH3COOН + ОН–
Н+ + ОН– → Н2О
___________________________________
Pb2+ + CH3COO– + НОН ⇆ PbОН+ + CH3COOН
Pb(CH3COO)2 + Н2О ⇆ PbОНCH3COO + CH3COOН
По 2 ст. - только в особых усл., напр., при нагревании раствора:
PbОНCH3COO → PbОН+ + 2CH3COO–
PbОН+ + НОН ⇆ Pb(ОН)2↓ + Н+
CH3COO– + НОН ⇆ CH3COOН + ОН–
Н+ + ОН– → Н2О
___________________________________
PbОН+ + CH3COO– + Н2О ⇆ Pb(ОН)2↓ + CH3COOН
PbОНCH3COO + Н2О ⇆ Pb(ОН)2↓ + CH3COOН
