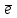ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.05.2024
Просмотров: 6
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вариант 11
ПЗ №1. СТРОЕНИЕ ВЕЩЕСТВА
| Вар | 1.1 | 1.3 | 2.2 | 2.3 | 2.4 |
| 11 | 11 | 11 | 11 | 11 | 11 |
1.1. Для указанного элемента (табл. 1.2) напишите распределение электронов в порядке заполнения орбиталей в нормальном и возбужденном состояниях. Приведите электронно-графическую формулу валентных электронов. Определите число протонов и нейтронов в атоме элемента.
44Ru
Распределение электронов для атома рутения в нормальном состоянии
напишем согласно правилу Клечковского, то есть с учетом энергии каждого
уровня и подуровня:
44 Ru рутений 1s 22s 22p 63s 23p64s 23d104p65s14d7.
Для проявления возбужденного состояния нарисуем электронную




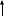




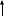
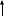
↑↓
↑↓
4d
5s
Поскольку в нормальном состоянии у атома рутения имеется все, то возбужденное состояние совпадает с валентным.
Протон (р) - это частица, имеющая массу 1,67.10-27 кг и положительный заряд.
Нейтрон (n) - незаряженная частица, обладающая массой 1,67.10-27 кг.
Число протонов в ядре характеризует его заряд (z) и принадлежность
атома данному химическому элементу, соответствует порядковому номеру элемента. Его пишут слева внизу у символа элемента.
Сумму протонов (z) и нейтронов (n), содержащихся в ядре атома,
называют массовым числом (А), А = z + n. Массовое число обычно пишут
слева вверху у символа элемента.
Следовательно, у атома рутения 101 44 Ru имеется 44 протона и 57 нейтронов.
1.3. Определите элемент, последний по порядку заполнения электрон которого характеризуется следующими значениями квантовых чисел. Представьте электронную формулу в порядке заполнения орбиталей выбранного элемента (табл. 1.4).
| Вариант | n | l | ml | ms |
| 11 | 5 | 1 | +1 | +½ |
51Sb сурьма 5p 3 N = 5 L = 1 Ml = 1 Ms = +½
Sb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
Sb: [Kr]5s2 4d10 5p3
2.2. С позиций метода ВС покажите образование предложенной молекулы PF3. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько σ- и π-связей содержит молекула? Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Отметьте полярность связей и полярность молекулы в целом.
Рассмотрим еще одну молекулу PF3
Выписываем валентные электроны центрального атома – фосфора.






3s
3р
Далее надо перевести в возбужденное состояние. Однако, так как во втором слое нет свободных (пустых) орбиталей, эту операцию пропускаем.
9F 1s 22s 22p 5






2s
2р
Определяем тип гибридизации. Для этого производим "сложение": s + p + p + p = 2sp3. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это s-элемент). Получаем угловую молекулу с теоретическим валентным углом 109 о .
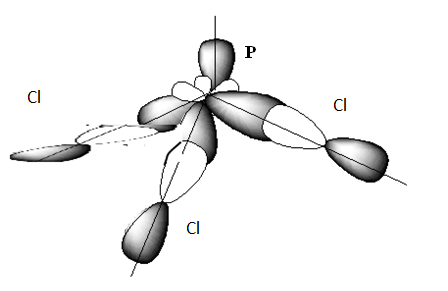
Отдельные связи P–F – полярные ОЭО(P)=2,19, ОЭО(F)=4 молекула в целом тоже полярна, так как в вершине угла заряд со знаком "-", а в противоположной стороне "+". Происходит оттягивание электронов в сторону P, т.е. образуется диполь. Три связи P–F– ковалентные σ-типа. Молекула в целом неполярна.
2.3. С позиций метода ВС покажите образование предложенной Молекулы BCl3. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько σ- и π-связей содержит молекула? Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Отметьте полярность связей и полярность молекулы в целом.
Определяем тип гибридизации центрального атома. Для этого выписываем валентные электроны центрального атома 5B.
2p
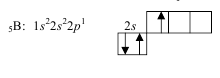
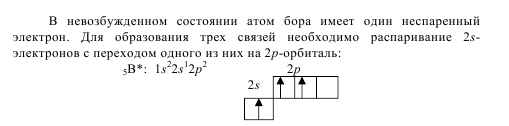
Далее "подводим" валентные электроны 17Cl.






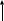
3р
3s
Для образования трех одинаковых связей В-Cl необходима
гибридизация одного 2s и двух 2р-орбиталей - sp2-гибридизация с
образованием трех гибридных орбиталей, расположенных в одной плоскости под углом 1200 относительно друг друга:

Образованные гибридные орбитали перекрываются с p-орбиталями
атома хлора с образованием трех σ-связей:
 8
8 
В + 3Н = ВCl3
Молекуля ВCl3 имеет плоское треугольное строение.
Для определения полярности связей В-Cl необходимо сравнить
значения ОЭО атомов В и Cl; ОЭО(В) = 2,0; ОЭО(Cl) = 2,83. Поскольку
электроотрицательность хлора больше, то связь В-Сl будет полярной.
Однако в целом молекула ВCl3 не обладает полярностью, так как полярность
связей В-Cl, направленных к вершинам правильного треугольника, взаимно компенсируется. Таким образом, в образовании молекулы ВCl3 принимают участие р-орбитали атома Cl и sp-гибридные орбитали бора. Молекула ВCl 3 не полярна, хотя содержит три полярные σ-связи, имеет плоскую треугольную структуру. Атом В находится в состоянии sp2-гибридизации.
2.4. В указанном комплексном соединении [Co(NH3)5Br]SO4 отметьте комплексообразователь, лиганды, внутреннюю и внешнюю сферы; определите степень окисления комплексообразователя и координационное число. Напишите уравнение диссоциации комплекса, приведите выражение константы нестойкости (Кнест). Назовите это соединение.
| Характеристики комплексного соединения | Формула комплексного соединения |
| [Co(NH3)5Br]SO4 | |
| Комплексное соединение с ука-занием степеней окисления всех частиц | [Coх(NH3)5Br-]SO4  х = 3 |
| Комплксообра- зователь | Со3+ |
| Лиганды | NH 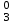 |
| Координационное число | 5+1 |
| Ионы внутренней сферы | [Co(NH3)5Br]2+ |
| Ионы внешней сферы | SO42- |
| Уравнение диссоциации комплексного соединения | [Co(NH3)5Br]SO4 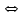 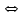 [Co(NH3)5Br]2+ +SO42- [Co(NH3)5Br]2+ +SO42- |
| Уравнение диссоциации внутренней сферы | [Co(NH3)5Br]2+ 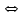 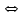 Co3++5NH3+Br- Co3++5NH3+Br- |
| Константы нестойкости | Кнест.=  |
В соответствии с правилами ИЮПАК соединение называется
Пентаамминобромкобальта (III) сульфат.
ПЗ №2: ЗАКОНОМЕРНОСТИХИМИЧЕСКИХ
ПРОЦЕССОВ
ПЗ№3: РАСТВОРЫ
РАСПРЕДЕЛЕНИЕ ЗАДАЧ ПО ВАРИАНТАМ
| Вар-т | 3.4 | 3.5 | 4.2 | 4.3 | 4.5 |
| 11 | 11 | 11 | 11 | 11 | 11 |
3.4. Рассчитайте изменение внутренней энергии (ΔU) в
химической реакции, представленной в табл. 3.3.
Таблица 3.3
| Вариант | Уравнения реакций |
| 11 | FеО (к) + СО (г) = Fе (к) + СО2 (г) |
Р е ш е н и е
По закону Гесса определяем
 = -241,84-396,3+263,7+110,5=-263,84 кДж<0, реакция экзотермическая
= -241,84-396,3+263,7+110,5=-263,84 кДж<0, реакция экзотермическаяΔU=-ΔH=263,84 кДж
3.5. Вычислите изменение энергии Гиббса при Т = 298К для химической реакции, представленной в таблице 3.3. Будет ли протекать данная реакция самопроизвольно при указанных условиях? Рассчитайте предельную температуру (равновероятности протекания прямой и обратной реакции) и константу равновесия при Т = 298К для данного процесса.
Р е ш е н и е
По закону Гесса определяем
 = -241,84-396,3+263,7+110,5=-263,84 кДж<0, реакция экзотермическая
= -241,84-396,3+263,7+110,5=-263,84 кДж<0, реакция экзотермическаяТемпература равновесия реакции – это Травн, когда
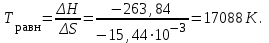
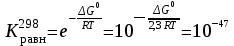 Большое значение
Большое значение Ответ:
Травн = 17088К;
4.2. Для реакции аА + bB → Продукты при увеличении концентрации вещества А в n1 раз скорость реакции выросла в m1 раз, а при увеличении концентрации вещества В в n2 раз скорость реакции выросла в m2 раз (табл. 4.2).
1) определите кинетический порядок по реагентам и общий кинетический порядок реакции;
2) рассчитайте константу скорости реакции, если при концентрациях веществ А и В, равных С(А) и С(В) моль/л соответственно, скорость реакции составила v моль/(л · с) (табл. 4.3).
3) приведите кинетическое уравнение реакции.
Т а б л и ц а 4.2
| Вариант | Изменение С(А) n1 | Изменение v m1 | Изменение С(В) n2 | Изменение v m2 |
| 11 | 25 | 25 | 4 | 16 |
| Вариант | С(А), моль/л | C(B), моль/л | v, моль/(л·с) |
| 11 | 0,12 | 0,2 | 0,72 |
Р е ш е н и е
1) Согласно закону действующих масс для химической кинетики кинетическое уравнение для приведенной реакции в общем виде будет иметь вид:
v = k · сх(A) сy(B),
где х – кинетический порядок реакции по веществу А, у –кинетический порядок реакции по веществу В.
х и у найдем на основе данных о влиянии изменения концентрации каждого реагента на скорость реакции.
а) Для вещества А:
v'/v=k · 〈25 ∙ с(A) х /k · 〈 ∙ с(A) х =25 или, после сокращения 25x = 25, откуда x = 1.
б) Аналогично для вещества В:
v,,/v=k · 〈16 ∙ с(A) х /k · 〈 ∙ с(A) х =4 или,
или после сокращения 16 y = 4, откуда y = 2.
На данном этапе кинетическое уравнение будет иметь вид:
v = k · с1(A) с2(B)
2) Рассчитаем константу скорости, используя данные из условия задачи и приведенное выше кинетическое уравнение:
v = с1(A) с2(B);
0,72 = k · 0,12·0,202, откуда k = 150 л 2/(моль 2 · мин).
Единицу измерения константы скорости определили, исходя из анализа размерностей: [моль/(л · мин)] = [k] · [моль/л]3. Откуда
[k] =[л 2/(моль 2 · мин)].
3) Окончательный вид кинетического уравнения приведенной реакции имеет вид:
v =150 с1(A) с2(B).
Оно позволяет рассчитать скорость реакции при заданных значениях концентраций реагентов А и В.
4.3.3. При повышении температуры от Т1 до Т2 скорость реакции увеличилась в n раз (табл. 4.6). Рассчитайте температурный коэффициент γ этой реакции.
Т а б л и ц а 4.6
| Вариант | Т1, ℃ | Т2, ℃ | n |
| 11 | 55 | 85 | 40 |
Используем правило Вант-Гоффа:


температурный коэффициент γ этой реакции 3,4.
4.5. Для приведенной обратимой реакции (табл. 4.9):
1) запишите выражение константы равновесия;
2) определите направление смещения равновесия при…
а) изменении концентрации одного из веществ;
б) изменении температуры;
в) изменении внешнего давления.
Свои ответы поясните.
Т а б л и ц а 4.9
| Вариант | Уравнение реакции, 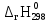 , кДж/моль , кДж/моль | Воздействие на равновесие | ||
| С | Т | р | ||
| 11 | CO(г) + Cl2(г)  COCl2(г) COCl2(г)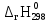 = ‒223,0 кДж = ‒223,0 кДж | уменьшение С(Cl2) | повышение | повышение |
Р е ш е н и е
1) Данная реакция гетерогенная. Согласно закону действующих масс для химического равновесия, константа равновесия, выраженная через равновесные концентрации участников процесса, будет иметь вид:
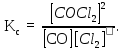
2) В соответствии с принципом смещения химического равновесия
Ле Шателье: а) Увеличение концентрации одного из веществ, участвующих в равновесном процессе, ускоряет тот процесс, в котором это вещество расходуется. Равновесие смещается в том же направлении. В данном случае уменьшение С(Cl2) уменьшает реакцию по его расходованию (т.е. слева направо) и приведет к смещению равновесия вправо, в сторону исходных продуктов;
б) Повышение температуры приводит к смещению равновесия в сторону эндотермической реакции. В рассматриваемом случае прямая реакция экзотермическая (
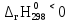 ). Соответственно, обратная реакция будет эндотермической. Таким образом, при повышении температуры равновесие в данном случае сместится влево, в сторону реагентов.
). Соответственно, обратная реакция будет эндотермической. Таким образом, при повышении температуры равновесие в данном случае сместится влево, в сторону реагентов. в) Уменьшение внешнего давления приводит к смещению равновесия в сторону больших объемов (большего числа молей газообразных участников равновесного процесса). В данном случае в левой части уравнения 2 моль газов, в правой части – 1 моль. Следовательно, понижение давления приведет к смещению равновесия влево, в сторону исходных веществ.
РАСПРЕДЕЛЕНИЕ ЗАДАЧ ПО ВАРИАНТАМ [1]
| Вар-т | 5.1 | 5.2 | 5.3 | 5.4 | Инд. |
| 11 | 11 | 11 | 11 | 11 | 5.14 |
5.1. Найдите массу соли CuSO4, необходимую для приготовления раствора объемом V =0,65л с массовой долей 2. Плотность раствора ρ 1019 кг/м3 . Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
1. Определяем молярную массу и молярную массу эквивалента CuSO4
М (CuSO4 ) = 160 г/моль, Э (CuSO4 ) = 160/4=40г/моль.
2. Находим массу CuSO4 , необходимую для приготовления 0,65 л его раствора с массовой долей 2 %. Массовая доля ω показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Масса раствора равна произведению объема раствора (V) на его плотность (ρ)
m = 0,65·10-3 м3 · 1019 кг/м3 = 0,662 кг.
В 100 кг раствора содержится 2 кг CuSO4
В 0,662 кг раствора содержится х кг CuSO4 ,
х=0,013 кг CuSO4
3. Находим молярную концентрацию раствора. Молярная концентрация раствора СМ показывает количество растворенного вещества, содержащегося в 1 л раствора.
В 0,65 л раствора содержится 13 г CuSO4 .
В 1 л раствора содержится х г CuSO4 ,
Х=20 г
Молярная концентрация С CuSO4 =20/160=0,125 моль/л
4. Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает
число молярных масс эквивалентов растворенного вещества, содержащихся в
1 л раствора.
cэк(CuSO4 ) = 20/40=0,5 моль/л
5. Находим моляльность раствора. Моляльность раствора cm (моль/кг)
показывает количество растворенного вещества, находящееся в 1 кг
растворителя.
Масса воды равна 662 г – 13 г = 649 г.
Количество BaCl2 равно 0,03 моль
В 649 г Н2О растворено 0,08 моль CuSO4 .
В 1000 г Н2О растворено х моль CuSO4 ,
Х=0,12 моль/кг.
6. Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора
содержится 20 г CuSO4 .
Т = 20/1000= 0,0200 г/мл.
5.2. Рассчитайте рН раствора соединения KOH основания и концентрации ионов Н+ и ОН− в растворе, содержащем m 0,112г соединения в объеме V 250мл раствора (α = 1).
Р е ш е н и е
Находим молярную концентрацию раствора KОН. Молярная масса KОН равна 56 г.
сNaOH= 0,112/56·0,25= 0,008 моль/л
Концентрация ОН− - ионов равна сNaОН = 0,008 моль/л.
рОН раствора рассчитываем по формуле
рОН = - lg aOH- = − lg γOH- ⋅[OH- ],
для расчета γOH- определяем ионную силу раствора
I = 1/2 ∑сi ⋅ zi2 =1/2 (cK+ ⋅ z2K+ + c OH- ⋅ z2OH- ) =1/2(0,001•12 + 0,001•12) = 0,001.
Из табл.П 6 находим γOH- = 0,964. Следовательно, рОН =- lg(0,964•0,001) = 3,02.
рН = рКв – рОН = 14 – 3,02 = 10,98.
5.3. Составьте ионное и молекулярное уравнения реакции гидролиза
Соли Na2CO3 , выражение для константы гидролиза и оцените величину рН раствора.
Соль сульфида аммония диссоциирует, образуя ионы
Na2CO3 ←→ 2 Na+ +CO32− .
Ионы Na+ и ион CO32− взаимодействуют с ионами воды, образуя малодиссоциирующее соединение Н2CO3, которое распадается на H2O и СО2. Гидролизуется соль необратимо и полностью.
Na2CO3 + 2 H2O = 2NaOH +H2CO3
2Na++CO3 2- + H2O = 2 Na++2OH- +H2O+CO2
CO3 2- +H2O = 2OH- +CO2
Kг=Кв/( Кд(H2CO3)
Cледовательно реакция среды щелочная.
5.4. Образуется ли осадок труднорастворимого соединения, если смешать равные объемы растворов двух солей BaCl2 и K2SO4 концентрацией с 0,002 моль/л? ПР(BaSO4) 1,08·10-10
Р е ш е н и е
При смешении равных объемов растворов объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое, то есть 0,001 моль/л;
Концентрации ионов Ba2+ , Cl− ,K+ и SO42− cоответственно равны
cBa2+ = 0,001 моль/л; cCl- = 0,002 моль/л; cK+ = ·0,002 моль/л; сSO42- = 0,001 моль/л.
ПР=aBa2+aSO42-=0,001·0,001=10-6
Ионная сила раствора равна
I = 1/2 ( сBa2+ ⋅ zBa2+2 + cCl-⋅ z 2Cl- + cK+ z 2K+ + cSO42- ⋅ zSO42-2 ) = 1/2 (10-3 ·4 + 2∙10-3 +2∙·10-3 ·1+10-3 ·4)= 12·10-3 = 0,012.
Учитывая коэффициенты активности для Ba2+ и SO42− (табл.П 6), рассчитываем активности этих ионов в растворе
а Ba2+ =γBa2+СBa2+ = 0,67·10-3 =0,67 ·10-3 моль/л
а SO42- =γSO42-СSO42- = 0,66·10-3 =0,66·10-3 моль/л
ПР= aBa2+aSO42-=0,67 ·10-3∙0,66·10-3 =0,44·10-6<1,08·10-10
Значит осадок не образуется.
5.14. Сколько мл 20 % соляной кислоты плотностью 1,098 г/см3потребуется для приготовления 1 л 2 М раствора?
1. находим количество вещества хлоридной кислоты в 1л:
n=V×с
n=1л×2моль/л=2моль
2. находим массу 2моль хлоридной кислоты:
m=n×М
m=2 моль×36,5г/моль=73г
3. узнаем массу раствора, в котором находится 73г кислоты ы где эта масса кислоты равна 20% масс. раствора:
m(раствора хлоридной кислоты)=m(кислоты)/w(кислоты)
m=73г/0,20=365г
4. рассчитываем объем раствора, масса которого =365г, а плотность1,098г/мл:
V=m/ρ
V=365г/1,098г/мл=332,4г
Ответ: 332,4 г
Тема. ОСНОВЫ ЭЛЕКТРОХИМИИ
| Задачи | 6.1 | 6.2 | 6.3 | 6.4 | 6.5 |
| 11 | 11 | 11 | 11 | 11 | 11 |
6.1. Определить тип окислительно-восстановительной реакции, степень окисления окислителя и восстановителя (табл. 6.3).
Т а б л и ц а 6.3
| Вариант | Реакция |
| 11 | NH4NO3 = N2O + 2H2O |
Рассмотрите ОВР, схема которой:
NH4NO3 ⟶ N2O + 2H2O
N-3 - 4ē ⟶ N+ |1 восстановитель (окисление)
N+5 + 4ē ⟶ N+ 4 |1 окислитель (восстановление)
NH4NO3 является восстановителем, NH4NO3 является окислителем (конпропорционирования).
6.2. Используя метод ионно-электронного баланса, подберите коэффициенты в уравнении окислительно-восстановительной реакции. Рассчитайте термодинамическую вероятность процесса, укажите направление реакции (табл. 6.4).
Т а б л и ц а 6.4
| Вариант | Реакция |
| 11 | H2O2 + PbO2 + CH3COOH → O2 + Pb(CH3COO)2 + H2O |
Решение:
2O-1
 O20 2 | окислитель восстановление
O20 2 | окислитель восстановление Pb4+
 Pb2+ 1 | восстановитель окисление
Pb2+ 1 | восстановитель окислениеМетодом полуреакций:
1 H2O2
 O2 +2H+
O2 +2H+ 1 PbO2 +4H+
 Pb2++ 2H2O
Pb2++ 2H2O PbO2 +4H+ +2H2O = H2O2+2H+ + Pb2++ 2H2O
H2O2+PbO2 +2CH3COOH → O2 + Pb(CH3COO)2 + 2H2О
Рассчитываем Е0298 и ∆G0298 данной реакции:
Е 0298 = φ 0окислителя - φ 0 восстановителя = (-1,455) –0,682 =- 2,137 В.
∆G 0298 = - zF Е298 = - 2 · 96500 · -2,137 · 10-3 = +412,4 кДж/моль .
6.3. Рассчитайте электродвижущую силу гальванического элемента по стандартным значениям энергии Гиббса (∆G 0298 для
реакции. Напишите реакции, происходящие на электродах, составьте схему гальванического элемента (табл. 6.5).
1 H2O2
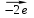 O2 +2H+
O2 +2H+ 1 PbO2 +4H+
 Pb2++ 2H2O
Pb2++ 2H2O PbO2 +4H+ +2H2O = H2O2+2H+ + Pb2++ 2H2O
H2O2+PbO2 +2CH3COOH → O2 + Pb(CH3COO)2 + 2H2О
Рассчитываем Е0298 и ∆G0298 данной реакции:
Е 0298 = φ 0окислителя - φ 0 восстановителя = (-1,455) –0,682 =- 2,137 В.
∆G 0298 = - zF Е298 = - 2 · 96500 · -2,137 · 10-3 = +412,4 кДж/моль .
Схема гальванического элемента примет следующий вид
(–) O2 ,2H+ | H2O2 || PbO2 | Pb2+, 2H2O (+).
При наличии внешней цепи на электродах протекают следующие реакции
| 2 | H2O2 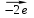 O2 +2H+ O2 +2H+ | окисление | восста- новитель | Анод |
| 2 | PbO2 +4H+  Pb2++ 2H2O Pb2++ 2H2O | восста- новление | окисли- тель | Катод |
6.4. Составьте схему работы гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известными концентрациями ионов, рассчитайте ЭДС этого элемента (табл. 6.6).
Т а б л и ц а 6.6
| Вариант | Металлы | Соли | Концентрации |
| 11 | Pd, Cd | PdSO4, CdI2 | С(Pd2+) = 0,1 M; С(Cd2+) = 0,03 M |
Р е ш е н и е
Равновесие для первого электрода Pd | PdSO4 (0,1 M).
Токообразующая реакция Pd2+ + 2
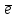 = Pd0.
= Pd0.φ
 = φ
= φ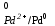 +
+ 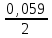 lg
lg 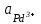 = 0,987+
= 0,987+ 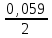 lg0,1 = 0,958 B.
lg0,1 = 0,958 B.Аналогично, для второго электрода Cd | CdI2 (0,03 M).
Токообразующая реакция Cd2+ + 2
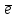 = Cd0.
= Cd0. φ
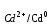 = φ
= φ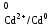 +
+ 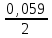 lg
lg 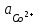 = –0,403+
= –0,403+ 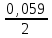 lg 0,03 = –0,448 B.
lg 0,03 = –0,448 B.При составлении гальванического элемента более отрицательным электродом будет система Co | Co2+, более положительным – Pd |Pd2+. Схема гальванического элемента примет следующий вид
(–) Cd | CdI2(0,03 M) || PdCl2(0,1 M) | Pd (+).
При наличии внешней цепи на электродах протекают следующие реакции
| 3 | Cd0 =Cd+2 + 2 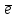 | окисление | восста- новитель | Анод |
| 2 | Pd2+ + 2 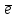 = Pd0 = Pd0 | восста- новление | окисли- тель | Катод |

 Реакция в элементе в целом Cd0 + Pd2+ = Cd2+ + Pd0.
Реакция в элементе в целом Cd0 + Pd2+ = Cd2+ + Pd0.
2
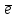
Электродвижущая сила этого элемента может быть рассчитана как по ранее определенным электродным потенциалам
, так и непосредственно.
E298 = φ
 – φ
– φ = ( 0,958 – (–0,448)) =1,406 B.
= ( 0,958 – (–0,448)) =1,406 B.6.5. При электролизе раствора данной соли металла током I, А, масса катода возросла на mг. Учитывая, что выход металла по току Bi, %, рассчитайте, какое количество электричества и в течение какого времени пропущено. Составьте схему электролиза c растворимым и нерастворимым анодом (табл. 6.7).
Т а б л и ц а 6.7
| Вариант | Формула cоли | I, A | m, г | Bi (Me), % |
| 11 | SbF3 | 0,99 | 0,77 | 71 |
Р е ш е н и е
Составляем схему электролиза с нерастворимым анодом.
Электрохимическая система имеет следующий вид
(- ) Fe | SbF3, H2O | Ti (+).
В качестве покрываемого металла выбрано железо; нерастворимого анода – титан.
В растворе присутствуют следующие ионы и молекулы
SbF3 ←→ Sb2+ + 3F− (электролитическая диссоциация);
SbF3 + 3H2O = Sb(OH)3 + 3HF (гидролиз);
Sb3+ + 3Н2О = Sb(ОН)3↓ + 3Н+, рН < 7, среда кислая.
Следовательно, при составлении схемы электролиза надо учитывать
ионы Sb3+, F− , Н+, молекулы Sb(OH)3, H2O.
Реакции на электродах
А: 2Н2О = О2 + 4Н+ + 4е ;
К: Sb3+ + 3е = Sb0
2Н+ + 2е = Н2.
Из-за выделения водорода на катоде совместно с восстановлением ионов Sb(III) выход по току металла меньше 100 %.
Схема электролиза водного раствора SbF3с нерастворимым анодом:
(–) Катод (+) Анод (нерастворимый)
← Sb3+ → H2O
← H+ → F

Sb3+ + 3
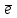 = Sb0
= Sb02H+ + 2
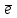 = H2 2H2O - 4
= H2 2H2O - 4