ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 97
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
. *+ 
 =
= 
*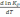
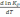 =
= 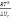
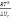 . *
. * 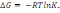
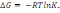
*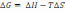
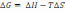 .
.
!. Термодинамиканың бірінші заңына сәйкес, жүйенің атқаратын жұмысы:
* Жүйеге жұмсалынған жылу мөлшеріне тең.
* Жүйеге жұмсалынған жылу мөлшерінен әрдайым артық.
* Жүйеге жұмсалынған жылу мөлшерінен әрдайым кіші.
*+A=Q-∆U теңдеуі бойынша анықталады.
* A=Q+∆U теңдеуі бойынша анықталады.
! Термодинамикалық функция –энтропия S:* Барлық денелер үшін кез-келген температурада нөлге тең емес.
* Өлшем бірлігі – Дж/моль.
*+Өлшем бірлігі – Дж/моль*К.
* Байланысқан энергияның мәні болып табылады.
* Бос энергияның мәні болып табылады.
! Энтропияға S сәйкес келетін сипаттамаларды таңдаңыз:
*+Жүйенің бір күйден екінші күйге өту жолына байланысты емес, бірақ жүйенің бастапқы және соңғы күйімен анықталады.
* Жүйенің бір күйден екінші күйге өту жолына байланысты.
* Жылу мен температураға кері пропорционал.
* Температураға тура пропорционал, ал жылуға кері пропорционал.
* Идеалды түзілген кристал үшін абсолютті нөл температурада нөлге тең емес.
!. Аммиактың түзілу энтальпиясы – 46,0 кДж/мольге тең.2NH3→N2+3H2 реакция нәтижесінде энтальпия өзгерісі тең болады:* +46,0 кДж/мольге.
*+ +92,0 кДж/мольге. * -23,0 кДж/мольге.
* -92,0 кДж/мольге. * +23,0 кДж/мольге.
! Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
* Энтропия. * Энтальпия. * Ішкі энергия.
* Гиббстің бос энергиясы. *+Жұмыс.
!. Барлық элементтердің энтальпиясы стандартты жағдайда тең болады:
*+Нөлге тең. * Айнымалы шамаға тең.
* Нөлден кіші. * Нөлден артық.
* Нөлден артық, бірақ бірден кіші.
!. Экзотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
* Тек қана оң мәнде. * Нөлге тең.
*+Тек қана теріс мәнде.
* Оң және теріс мәнде. * Кез-келген мәнде.
!. Эндотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
*+Тек қана оң мәнде. * Нөлге тең.
* Тек қана теріс мәнде.
* Оң және теріс мәнде. * Кез-келген мәнде.
! Н2(г)+Сl2(г)=2НСl(г) +44ккал реакциясы үшін хлорсутектің түзілу энтальпиясы тең болады:* -44 ккал/моль. * +22 ккал/моль.
*+ -22 ккал/моль. * +44 ккал/моль
!. H2+J2=2HJ, ∆H=12,40ккал реакциясы үшін сутекті иодтың түзілу жылуын есептеңіз:*-12,4 ккал/моль.
*+12,4 ккал/моль. * + -6,20 ккал/моль.
*+6,20 ккал/моль. * 42,80 ккал/моль.
!. С6Н6 +15/2О2→3Н2О+6СО2 реакциясының жылу эффектісі ∆Н=-3264,6 кДж/мольге тең. 7,8г бензол жанғанда бөлінетін жылуын есептеңіз:
* 3264,6 кДж/моль. * 3,2646 кДж/моль
* 32,646 кДж/моль. *+ 326,46 кДж/моль.
* 32646 кДж/моль.
! Төменде келтірілгеннен эндотермиялық реакцияларды таңдаңыз:* С+О2=СО2.
* С6Н6+15/2О2→3Н2О*6СО2.
*+ СаСО3=СаО+СО2.
* NaOH+HCl=NaCl+H2О.
* Cu(OH)2=CuO+H2O.
! Экзотермиялық реакцияларды көрсетіңіз:
* 2NaOH+H2SO4=Na2SO4+2H2O.
*+ С6Н6+15/2О2→3Н2О*6СО2.
* MgCO3=MgO+CO2.
* NaOH+HCl=NaCl+H2О.
* Cu(OH)2=CuO+H2O.
!. Изобаралық жағдайда жүйенің ішкі энергиясы ∆U мен энтальпиясы ∆H арасындағы айырмашылық тең болады:
*+ р∆V. * V∆p. * R. * 3/2R. * 1/2R.
! Жүйенің ішкі энергиясының қасиеттері жалпы жағдайда неге байланысты
* +жүйенің күй функциясы
* үрдістің функциясы
* интенсивті функция
* жылу үрдісіне тең функция
* жұмыс үрдісіне тең функция
!Кеңейтілген жүйедегі жылуұстағыштық - бұл* энтропия *+энтальпия * ішкі энергия
* температура * масса
!. Термодинамикалық жүйенің экстенсивті қасиеті* температура * қысым *+көлем
* концентрация * жылу сыйымдылық
!. Изохоралық үрдісте * р=const * T= const
* Q=const *+V=const * V, Т =const
!. Энергияның өлшем бірлігі *+Джоуль
* Кельвин * Ватт * килограмм * литр
!жылу мен жұмыстың ауысуын химияның қай саласы зерттейді* электрохимия
* химиялық кинетика * фотохимия
*+термодинамика * кинетика
!. Кило- мәні тең* 10-3 *+103 * 10-6
* 106 * 10-9
!. N2+3H2=2NH3 реакция жүрген кезде
* ΔS>0 *+ΔS <0 * ΔS =0 * ΔS = ΔН
* ΔS = ΔТ
!Жүйенің жұмысы W мен жылуын Q термодинамиканың 1 заңына байланыстырып жаз * Q = ΔU - W
*+Q = ΔU + W * ΔU = Q + W
* A = Q - W * W =ΔU + Q
!. Адиабата үрдісі арқылы идеал газды сипатта (W – жүйенің жұмысы, Q - үрдістің жылуы)* P = const
* V = const * T = const * ΔU=0
*+ΔU = - W
!. Кирхгофтың термохимиялық теңдеуі көрсететін тәуелділік
* тұрақты қысымдағы зат энтальпиясының температураға тәуелділігі
* тұрақты қысымдағы зат жылусыйымдылығының температураға тәуелділігі
* тұрақты температурадағы зат энтальпиясының қысымға тәуелділігі
* тұрақты температурадағы зат жылусыйымдылығының қысымға тәуелділігі
*+ тұрақты қысымдағы үрдістегі энтальпияның өзгеруінің температураға тәуелділігі
! Термодинамиканың екінші бастамасының математикалық өрнегі
* ΔS=ΔH/T * dS= Q/T * TdS=dU + PdV
* ΔS=Q/T *+dS≥δQ/T
! Оқшауланған жүйе энтропиясының тепе-теңдікке өз бетімен ұмтылуы
* 0-ге ұмтылады * шексіздікке ұмтылады
* минимумға жетеді
*+максимумға ұмтылады
* бірқалыпты өшеді
! Индивидуалды заттың Гиббс dG энергиясының толық дифференциалы мына түрге ие: * TdS + VdP
* TdS – PdV *+VdP – SdT * -PdV – SdT
!Температура бойынша тұрақты көлемде индивидуалды заттың Гельмгольц энергиясының жеке туындысы неге тең
* –P * V *+–S * T * G
!. Жалпы жағдайда жүйе компонентiнің химиялық потенциал қасиеті
*+жүйенің күй функциясы
* үдеріс функциясы * экстенсивті функция
* үдеріс жылуына тең функция
* үдеріс жұмысына тең функция
!. Термодинамикалық жүйенің ретсіздік өлшемі*+энтропия * энтальпия
* ішкі энергия * температура * масса
!. Термодинамикалық жүйенің интенсивті қасиеті * температура *ішкі энергия
* объем * энтропия *+энтальпия
! Изобаралық үдеріс жүреді
*+р=const * T= const * Q=const
* V=const *р, Т=const
!. Температура бірлігі * Джоуль
*+Кельвин * Ватт * Килограмм
* Цельсий
!. Реакцияның жылдамдығы мен механизмін зерттейді* электрохимия
*+химиялық кинетика * фотохимия
* термодинамика * термохимия
! Микро сөзі нені білдіреді?* 10-3
* 103 *+10-6 * 106 * 10-9
! Электрлық шам бұл:
* ашық термодинамикалық жүйе
*+жабық термодинамикалық жүйе
* оқшауланған термодинамикалық жүйе
* термодинамикалық жүйе болып табылмайды * мінсіз жүйе
!. Қай термодинамикалық шама (қалыпты жағдайда) нөлге тең емес*+энтропия
* энтальпия * Гиббс энергиясы
* Гельмгольц энергиясы
* ішкі энергия
! Химиялық термодинамика нені оқытады
*+химиялық энергияның электрлік, жылулық, механикалық, беткі деңгейлік және тағы басқа энергияларға айналының негізгі заңдылықтарын
* химиялық реакцияның жылдамдығын
* химиялық үдерістердің жүру механизімін
* жеке заттардың химиялық құрамын
* біртекті емес жүйені
! Гиббстің еркін энергиясы мына формулас бойынша анықталады:
*+
 G =
G = 
 H - T
H - T
 S *
S *
 G = T
G = T
 S
S
*
 G =
G = 
 U - T
U - T
 S *
S * 
 G =
G = 
 H + T
H + T
 S
S
*
 G =
G = 
 U - T
U - T
 S
S
!. .Қай келтірілген заттардың түзілу жылуы нөлге тең болуы керек:* +Н2
* СО* * СН4 *СО * С2Н4
! Химиялық жүйенің реакциялық қабілеттілігінің өлшемі болып табылатын шаманы тап:* Ішкі энергия
* Температуралық жүйе
* Реакция өнімінің түзілу жылуы
* +Гиббс энергиясы
* Қоршаған орта температурасы
!.Q=
 H формуласы білдіреді:
H формуласы білдіреді:
* Лавуазье-Лаплас заңы
* термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
* изохоралық процесстің жылу эффектісі
*+изобаралық процесстің жылу эффектісі
!.Q =
 U формуласы нені білдіреді:
U формуласы нені білдіреді:
*+Изохоралық процесстің жылу эффектісі
* Лавуазье-Лаплас заңы
* Термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
* Изобаралық процесстің жылу эффектісі
!. Жылу суық денеден едәуір жылырақ денеге өтуі мүмкін емес:
* Термодинамиканың нөлінші заңы
* Лавуазье-Лаплас заңы
* +Термодинамиканың екінші заңы
* Термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
! Термодинамикалық жүйенің бір күйден екінші күйге ауысу кезінде, энергия жоқтан пайда болмайды бардан жоғалмайды, тек қатаң эквиваленттік мөлшерде бір күйден екінші күйге ауысады:
*+Термодинамиканың бірінші заңы
* Лавуазье-Лаплас заңы
* термодинамиканың екінші заңы
* Гесстің заңы
* термодинамиканың нөлінші заңы
!."Реакцияның жылу эффектісі реакция жолына тәуелсіз, ал бастапқы зат пен ақырғы өнімнің күйі мен табиғатына тәуелді"
* термодинамиканың бірінші заңы
* Лавуазье-Лаплас заңы
* термодинамиканың екінші заңы
*+Гесс заңы
* термодинамиканың нөлінші заңы
! Термодинамикалық жүйе түсінігі қай анықтама үшін дұрыс? Жүйе – бұл дене немесе денелер тобы:
*+ әрекеттесуде және ойша айналадағы ортадан тыс өзімен-өзі орналасқан
*қоршаған ортамен алмасады
*қоршаған ортамен алмаспайды
*әлем бөліктерін жасаушы денелер тобы
*жылу жұтылумен жүреді
! Қай анықтама жабық жүйеге жатады? Жабық жүйе, бұл:
* қоршаған ортамен энергия алмасу болмайтын жүйе
*жылу, масса алмастырмайтын және көлемі өзгермейтін жүйе
*қоршаған ортамен жылу, масса алмастыратын жүйе
*қоршаған ортамен үнемі жылу алмасу болып тұрады
*+ қоршаған ортамен жылу алмасуы болып, бірақ масса алмасуы болмайтын жүйе
! Қай анықтама ашық жүйеге жатады?
*барлық термодинамикалық тепе – теңдік жүйелері
*+ қоршаған ортамен жылулық және материалдық алмасу болып тұратын жүйелер
*тек сыртқы ортада жылулық алмасу болып тұратын жүйе
*Арасында материалдық алмасу болып тұратын жүйе
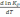
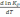 =
= 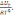
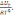
*
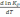
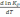 =
= 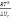
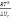 . *
. * 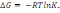
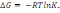
*
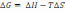
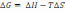 .
.!. Термодинамиканың бірінші заңына сәйкес, жүйенің атқаратын жұмысы:
* Жүйеге жұмсалынған жылу мөлшеріне тең.
* Жүйеге жұмсалынған жылу мөлшерінен әрдайым артық.
* Жүйеге жұмсалынған жылу мөлшерінен әрдайым кіші.
*+A=Q-∆U теңдеуі бойынша анықталады.
* A=Q+∆U теңдеуі бойынша анықталады.
! Термодинамикалық функция –энтропия S:* Барлық денелер үшін кез-келген температурада нөлге тең емес.
* Өлшем бірлігі – Дж/моль.
*+Өлшем бірлігі – Дж/моль*К.
* Байланысқан энергияның мәні болып табылады.
* Бос энергияның мәні болып табылады.
! Энтропияға S сәйкес келетін сипаттамаларды таңдаңыз:
*+Жүйенің бір күйден екінші күйге өту жолына байланысты емес, бірақ жүйенің бастапқы және соңғы күйімен анықталады.
* Жүйенің бір күйден екінші күйге өту жолына байланысты.
* Жылу мен температураға кері пропорционал.
* Температураға тура пропорционал, ал жылуға кері пропорционал.
* Идеалды түзілген кристал үшін абсолютті нөл температурада нөлге тең емес.
!. Аммиактың түзілу энтальпиясы – 46,0 кДж/мольге тең.2NH3→N2+3H2 реакция нәтижесінде энтальпия өзгерісі тең болады:* +46,0 кДж/мольге.
*+ +92,0 кДж/мольге. * -23,0 кДж/мольге.
* -92,0 кДж/мольге. * +23,0 кДж/мольге.
! Төменде көрсетілген шамалардың қайсысы күй функциясы болып табылады:
* Энтропия. * Энтальпия. * Ішкі энергия.
* Гиббстің бос энергиясы. *+Жұмыс.
!. Барлық элементтердің энтальпиясы стандартты жағдайда тең болады:
*+Нөлге тең. * Айнымалы шамаға тең.
* Нөлден кіші. * Нөлден артық.
* Нөлден артық, бірақ бірден кіші.
!. Экзотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
* Тек қана оң мәнде. * Нөлге тең.
*+Тек қана теріс мәнде.
* Оң және теріс мәнде. * Кез-келген мәнде.
!. Эндотермиялық реакция үшін энтальпия шамасы болуы мүмкін:
*+Тек қана оң мәнде. * Нөлге тең.
* Тек қана теріс мәнде.
* Оң және теріс мәнде. * Кез-келген мәнде.
! Н2(г)+Сl2(г)=2НСl(г) +44ккал реакциясы үшін хлорсутектің түзілу энтальпиясы тең болады:* -44 ккал/моль. * +22 ккал/моль.
*+ -22 ккал/моль. * +44 ккал/моль
!. H2+J2=2HJ, ∆H=12,40ккал реакциясы үшін сутекті иодтың түзілу жылуын есептеңіз:*-12,4 ккал/моль.
*+12,4 ккал/моль. * + -6,20 ккал/моль.
*+6,20 ккал/моль. * 42,80 ккал/моль.
!. С6Н6 +15/2О2→3Н2О+6СО2 реакциясының жылу эффектісі ∆Н=-3264,6 кДж/мольге тең. 7,8г бензол жанғанда бөлінетін жылуын есептеңіз:
* 3264,6 кДж/моль. * 3,2646 кДж/моль
* 32,646 кДж/моль. *+ 326,46 кДж/моль.
* 32646 кДж/моль.
! Төменде келтірілгеннен эндотермиялық реакцияларды таңдаңыз:* С+О2=СО2.
* С6Н6+15/2О2→3Н2О*6СО2.
*+ СаСО3=СаО+СО2.
* NaOH+HCl=NaCl+H2О.
* Cu(OH)2=CuO+H2O.
! Экзотермиялық реакцияларды көрсетіңіз:
* 2NaOH+H2SO4=Na2SO4+2H2O.
*+ С6Н6+15/2О2→3Н2О*6СО2.
* MgCO3=MgO+CO2.
* NaOH+HCl=NaCl+H2О.
* Cu(OH)2=CuO+H2O.
!. Изобаралық жағдайда жүйенің ішкі энергиясы ∆U мен энтальпиясы ∆H арасындағы айырмашылық тең болады:
*+ р∆V. * V∆p. * R. * 3/2R. * 1/2R.
! Жүйенің ішкі энергиясының қасиеттері жалпы жағдайда неге байланысты
* +жүйенің күй функциясы
* үрдістің функциясы
* интенсивті функция
* жылу үрдісіне тең функция
* жұмыс үрдісіне тең функция
!Кеңейтілген жүйедегі жылуұстағыштық - бұл* энтропия *+энтальпия * ішкі энергия
* температура * масса
!. Термодинамикалық жүйенің экстенсивті қасиеті* температура * қысым *+көлем
* концентрация * жылу сыйымдылық
!. Изохоралық үрдісте * р=const * T= const
* Q=const *+V=const * V, Т =const
!. Энергияның өлшем бірлігі *+Джоуль
* Кельвин * Ватт * килограмм * литр
!жылу мен жұмыстың ауысуын химияның қай саласы зерттейді* электрохимия
* химиялық кинетика * фотохимия
*+термодинамика * кинетика
!. Кило- мәні тең* 10-3 *+103 * 10-6
* 106 * 10-9
!. N2+3H2=2NH3 реакция жүрген кезде
* ΔS>0 *+ΔS <0 * ΔS =0 * ΔS = ΔН
* ΔS = ΔТ
!Жүйенің жұмысы W мен жылуын Q термодинамиканың 1 заңына байланыстырып жаз * Q = ΔU - W
*+Q = ΔU + W * ΔU = Q + W
* A = Q - W * W =ΔU + Q
!. Адиабата үрдісі арқылы идеал газды сипатта (W – жүйенің жұмысы, Q - үрдістің жылуы)* P = const
* V = const * T = const * ΔU=0
*+ΔU = - W
!. Кирхгофтың термохимиялық теңдеуі көрсететін тәуелділік
* тұрақты қысымдағы зат энтальпиясының температураға тәуелділігі
* тұрақты қысымдағы зат жылусыйымдылығының температураға тәуелділігі
* тұрақты температурадағы зат энтальпиясының қысымға тәуелділігі
* тұрақты температурадағы зат жылусыйымдылығының қысымға тәуелділігі
*+ тұрақты қысымдағы үрдістегі энтальпияның өзгеруінің температураға тәуелділігі
! Термодинамиканың екінші бастамасының математикалық өрнегі
* ΔS=ΔH/T * dS= Q/T * TdS=dU + PdV
* ΔS=Q/T *+dS≥δQ/T
! Оқшауланған жүйе энтропиясының тепе-теңдікке өз бетімен ұмтылуы
* 0-ге ұмтылады * шексіздікке ұмтылады
* минимумға жетеді
*+максимумға ұмтылады
* бірқалыпты өшеді
! Индивидуалды заттың Гиббс dG энергиясының толық дифференциалы мына түрге ие: * TdS + VdP
* TdS – PdV *+VdP – SdT * -PdV – SdT
!Температура бойынша тұрақты көлемде индивидуалды заттың Гельмгольц энергиясының жеке туындысы неге тең
* –P * V *+–S * T * G
!. Жалпы жағдайда жүйе компонентiнің химиялық потенциал қасиеті
*+жүйенің күй функциясы
* үдеріс функциясы * экстенсивті функция
* үдеріс жылуына тең функция
* үдеріс жұмысына тең функция
!. Термодинамикалық жүйенің ретсіздік өлшемі*+энтропия * энтальпия
* ішкі энергия * температура * масса
!. Термодинамикалық жүйенің интенсивті қасиеті * температура *ішкі энергия
* объем * энтропия *+энтальпия
! Изобаралық үдеріс жүреді
*+р=const * T= const * Q=const
* V=const *р, Т=const
!. Температура бірлігі * Джоуль
*+Кельвин * Ватт * Килограмм
* Цельсий
!. Реакцияның жылдамдығы мен механизмін зерттейді* электрохимия
*+химиялық кинетика * фотохимия
* термодинамика * термохимия
! Микро сөзі нені білдіреді?* 10-3
* 103 *+10-6 * 106 * 10-9
! Электрлық шам бұл:
* ашық термодинамикалық жүйе
*+жабық термодинамикалық жүйе
* оқшауланған термодинамикалық жүйе
* термодинамикалық жүйе болып табылмайды * мінсіз жүйе
!. Қай термодинамикалық шама (қалыпты жағдайда) нөлге тең емес*+энтропия
* энтальпия * Гиббс энергиясы
* Гельмгольц энергиясы
* ішкі энергия
! Химиялық термодинамика нені оқытады
*+химиялық энергияның электрлік, жылулық, механикалық, беткі деңгейлік және тағы басқа энергияларға айналының негізгі заңдылықтарын
* химиялық реакцияның жылдамдығын
* химиялық үдерістердің жүру механизімін
* жеке заттардың химиялық құрамын
* біртекті емес жүйені
! Гиббстің еркін энергиясы мына формулас бойынша анықталады:
*+

 G =
G = 
 H - T
H - T
 S *
S *
 G = T
G = T
 S
S*

 G =
G = 
 U - T
U - T
 S *
S * 
 G =
G = 
 H + T
H + T
 S
S*

 G =
G = 
 U - T
U - T
 S
S!. .Қай келтірілген заттардың түзілу жылуы нөлге тең болуы керек:* +Н2
* СО* * СН4 *СО * С2Н4
! Химиялық жүйенің реакциялық қабілеттілігінің өлшемі болып табылатын шаманы тап:* Ішкі энергия
* Температуралық жүйе
* Реакция өнімінің түзілу жылуы
* +Гиббс энергиясы
* Қоршаған орта температурасы
!.Q=

 H формуласы білдіреді:
H формуласы білдіреді:* Лавуазье-Лаплас заңы
* термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
* изохоралық процесстің жылу эффектісі
*+изобаралық процесстің жылу эффектісі
!.Q =

 U формуласы нені білдіреді:
U формуласы нені білдіреді:*+Изохоралық процесстің жылу эффектісі
* Лавуазье-Лаплас заңы
* Термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
* Изобаралық процесстің жылу эффектісі
!. Жылу суық денеден едәуір жылырақ денеге өтуі мүмкін емес:
* Термодинамиканың нөлінші заңы
* Лавуазье-Лаплас заңы
* +Термодинамиканың екінші заңы
* Термодинамиканың бірінші заңы
* Гесс заңының бірінші салдары
! Термодинамикалық жүйенің бір күйден екінші күйге ауысу кезінде, энергия жоқтан пайда болмайды бардан жоғалмайды, тек қатаң эквиваленттік мөлшерде бір күйден екінші күйге ауысады:
*+Термодинамиканың бірінші заңы
* Лавуазье-Лаплас заңы
* термодинамиканың екінші заңы
* Гесстің заңы
* термодинамиканың нөлінші заңы
!."Реакцияның жылу эффектісі реакция жолына тәуелсіз, ал бастапқы зат пен ақырғы өнімнің күйі мен табиғатына тәуелді"
* термодинамиканың бірінші заңы
* Лавуазье-Лаплас заңы
* термодинамиканың екінші заңы
*+Гесс заңы
* термодинамиканың нөлінші заңы
! Термодинамикалық жүйе түсінігі қай анықтама үшін дұрыс? Жүйе – бұл дене немесе денелер тобы:
*+ әрекеттесуде және ойша айналадағы ортадан тыс өзімен-өзі орналасқан
*қоршаған ортамен алмасады
*қоршаған ортамен алмаспайды
*әлем бөліктерін жасаушы денелер тобы
*жылу жұтылумен жүреді
! Қай анықтама жабық жүйеге жатады? Жабық жүйе, бұл:
* қоршаған ортамен энергия алмасу болмайтын жүйе
*жылу, масса алмастырмайтын және көлемі өзгермейтін жүйе
*қоршаған ортамен жылу, масса алмастыратын жүйе
*қоршаған ортамен үнемі жылу алмасу болып тұрады
*+ қоршаған ортамен жылу алмасуы болып, бірақ масса алмасуы болмайтын жүйе
! Қай анықтама ашық жүйеге жатады?
*барлық термодинамикалық тепе – теңдік жүйелері
*+ қоршаған ортамен жылулық және материалдық алмасу болып тұратын жүйелер
*тек сыртқы ортада жылулық алмасу болып тұратын жүйе
*Арасында материалдық алмасу болып тұратын жүйе


