ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 36
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО Науки и высшего образования РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Реферат
По дисциплине:
Аналитическая химия и ФХМА
Тема: «Полярографические методы анализа»
Выполнили: студент гр. ТХН-19 /Антонова В.С./
(подпись)
Проверил: доцент ____________ /Берлинский И.В./
(подпись)
Санкт-Петербург 2021
Содержание
Введение 3
1. История возникновения 4
2. Основы полярографического метода анализа 5
2.1. Определение и принцип метода 5
2.2. Измерительная ячейка 6
2.3. Принцип измерения 7
3. Классическая полярограмма 8
4. Качественный полярографический анализ 10
5. Количественный полярографический анализ 12
6. Достоинства и недостатки 15
7. Факторы, влияющие на результаты полярографических измерений 16
8. Современное применение полярографии 17
Заключение 19
Список литературы 20
Введение
Достойное место в аналитической практике занимают электроаналитические методы анализа. С недавних пор появились электронные измерительные устройства, которые значительно повлияли на практику вольтамперометрического и полярографического анализа. Так, полярографы, оснащенные компьютерами и микропроцессами, сделали возможной автоматизацию как измерительного процесса, так и обработки данных. Применение дополнительных устройств, например, насосов, дозаторов и т.д., управляемых микропроцессами, позволило полностью автоматизировать серийные анализы и измерения в потоке. С развитием приборостроением стал постепенно сокращаться ручной труд, а также улучшаться воспроизводимость и чувствительность определений.
При помощи полярографии можно определять как органические, так и неорганические ионы и молекул в относительно широком диапазоне концентраций. В отличие от широко применяемых методов атомной спектроскопии, когда анализируемое вещество повреждается в процессе анализа, электрохимические методы позволяют избирательно определять отдельные химические формы вещества в исходном виде.
В таком методе электрохимического анализа, как полярография, были достигнуты наибольшие успехи после 1986 г.
1.История возникновения
Полярографический метод электрохимического анализа берет свое начало с постояннотоковой полярографии, которая была разработана Ярославом Гейровским. Ученый заметил, что сила тока через каплю зависит от состава раствора. В дальнейшем он создал метод, который основан на измерении зависимости тока от напряжения на ртутно-капельном электроде.
В данном методе рабочим электродом является ртутный капающий электрод с малой скорость истечения ртути, а электродом сравнения – слой ртути, находящийся на дне электрохимической ячейки (донная ртуть). Оба электрода должны быть присоединены к источнику постоянного напряжения. Конструктивно ртутный капающий электрод представляет собой толстостенный стеклянный капилляр, из которого ртуть вытекает в анализируемый раствор под давлением, создаваемым столбом ртути. Гейровский использовал в качестве резервуара для ртути делительную воронку, которая была соединялась с капилляром при помощи шланга.
В своей первой книге, написанной в 1948 г. и посвященной полярографии, Гейровский описывает преимущества ртутного капающего электрода перед другими типами электродов. А именно, он пишет, что «ввиду малой поверхности такого электрода уже при очень малых силах тока плотность тока достаточно велика для того, чтобы электрод хорошо поляризовался, т.е. чтобы приложенное напряжение вызывало изменение собственного потенциала электрода, а также противодействующую этому силу, называемую поляризацией» [1, с.10]. Также, 3 годами позже Гейровский опубликовал первые вольт-амперные кривые, зарегистрированные специальным прибором – полярографом. В дальнейшем эти кривые ученый называл полярограммами.
В 1959 году за выдающееся открытие Гейровскому была присуждена Нобелевская премия по химии.
Несмотря на бурное развитие методов электроанализа и в теоретическом, и практическом плане, полярографические методы не получили достаточной востребованности лабораториями крупных предприятий. Из-за этого в стране все меньше стало выпускаться современных приборов для развития полярографии.
Однако с 1986 г. интерес к полярографическому методу электрохимического анализа вновь возрастает. Начинается развитие работ по амальгамой полярографии с накоплением, со стационарным ртутным электродом. Результаты многих разработок стали внедряться в практику.
2.Основы полярографического метода анализа
2.1. Определения и принцип метода
Полярография – это раздел такого метода электрохимического анализа, как вольтамперометрия. Этот метод основан на получении кривых зависимости тока от напряжения в цепи, которая состоит из исследуемого раствора, погруженных в него двух электронов. Один электрон является сильно поляризующимся, а другой – практически неполяризующимся. Получение кривых (полярограмм) осуществляют при помощи полярографов. Схема простейшего полярографа показана на рис.1.
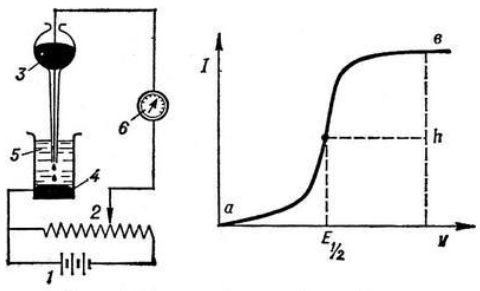
Рис. 1. Схема полярографа и полярограмма
От потенциометра 2, который соединен с аккумулятором 1, подают напряжение, которое постепенно возрастает, на поляризующийся капельный ртутный электрод 3 и неполяризующийся электрод 4. Неполяризующийся электрод 4 – это слой ртути небольшой поверхности. Величину тока, проходящего при этом через раствор 5, измеряют гальванометром 6. Для определения окисляющихся веществ поляризующийся электрод соединяют с отрицательным полюсом внешнего источника тока, при определении восстанавливающихся веществ – с отрицательным полюсом. В авторегистрирующих полярографах полярограмма вычерчивается автоматически.
В зависимости от скорости и формы изменения поляризующего напряжения различают выскочастотную, импульсную, постояннотоковую или классическую, переменнотоковую полярографию. Варианты метода имеют различные разрешающую способность и чувствительность.
В вольтамперометрии в качестве индикаторного электрода используют ртутный капающий электрод. Данный электрод обладает несколькими качествами, присущими только ему. Во-первых, ртутный электрод является идеально поляризуемым электродом в широком диапазоне потенциалов, ограниченным в катодной области реакциями восстановления катиона водорода (от -1 В до -1,5 В) или фонового электролита, а в анодной области – химическими реакциями окисления ртути (0,06 В в щелочной и 0,4 В в кислой среде).
Шаг и размер капли зависит от диаметра капилляра, его длины, а также высоты столба ртути над капилляром.
Полярографическая установка довольно проста. Один из электродов (в большинстве случаев – катод) представляет собой периодически капающие из капиллярного отверстия капли ртути, у которых поверхность довольно мала по сравнению с другим электродом (обычно анодом). В связи с этим, катод считается абсолютно поляризующимся электродом [3]. Другой электрод (анод) представляет собой обычно неподвижный слой ртути на дне электролизера. Анод имеет большую поверхность, и плотность тока на электроде не достигает предельной величины, при которой мог бы заметно измениться потенциал такого электрода. Таким образом, ртутный анод является типичным неполяризующимся электродом, благодаря чему равновесный электрохимический потенциал его в ходе электролиза остается постоянным по величине.
Протекание тока через ртуть, а также другие металлические и углеродные материалы связано прежде всего с движением электронов. Поэтому на границе раствора и электрода должен существовать определенный процесс, который будет обеспечивать переход потока ионов в поток электронов (в противном случае, ток не пойдет). Количество прореагировавшего вещества определяется с помощью закона Фарадея:
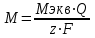 , где
, гдеМ – масса прореагировавшего вещества;
Мэкв – масса прореагировавшего вещества;
Q – прошедший через электрод заряд;
z – количество электронов, участвующих в превращении иона или молекулы;
F – число Фарадея
2.2. Измерительная ячейка
Для полярографических измерений используют электрохимические ячейки, у которых относительно небольшая площадь поверхности рабочего электрода (около 100 мм2). Плотность тока, протекающего через такой электрод, довольно велика.
С физико-химической точки зрения, рабочий электрод является самостоятельной фазой электрода, имеющий электронную проводимость. Фоновой электролит проводит ток и представляет собой раствор электрохимически неактивного электролита в воде или другом полярном растворителе [2].
Рабочим электродом в полярографической ячейке является статический ртутный капельный электрод. В роли электрода сравнения раньше использовали донную ртуть, а на сегодняшний день применяют электроды второго рода, например, хлоридсеребряный электрод.
Обозначим потенциал рабочего электрода как
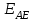
, а разность потенциалов между электродом сравнения и рабочим электродом как
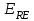 . Если к электродам не приложено никакого внешнего напряжения, то в таких условиях значения величин называются, соответственно потенциалом покоя и напряжением ячейки. Данные величины изменятся при наличии внешнего напряжения. Рабочий электрод перейдет в поляризованное состояние, а электрод сравнения останется прежним. При этом потенциал рабочего электрода изменится на величину приложенного напряжения, т.е. напряжения на клеммах,
. Если к электродам не приложено никакого внешнего напряжения, то в таких условиях значения величин называются, соответственно потенциалом покоя и напряжением ячейки. Данные величины изменятся при наличии внешнего напряжения. Рабочий электрод перейдет в поляризованное состояние, а электрод сравнения останется прежним. При этом потенциал рабочего электрода изменится на величину приложенного напряжения, т.е. напряжения на клеммах, 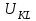 . Разность потенциалов между электродами
. Разность потенциалов между электродами 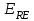 =
=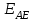 =
=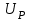
называется напряжением поляризации. В соответствии с законом Ома, ток, протекающий через ячейку, определяется по формуле:
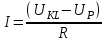
Величина
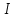 обычно мала. Если напряжения недостаточно для того, чтобы спровоцировать электрохимическое превращение вещества, то величину тока
обычно мала. Если напряжения недостаточно для того, чтобы спровоцировать электрохимическое превращение вещества, то величину тока 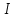 можно считать пренебрежимо малой.
можно считать пренебрежимо малой. Сопротивление ячейки
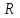 ввиду наличия фонового электролита также мало. Поэтому, если
ввиду наличия фонового электролита также мало. Поэтому, если 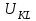 =
=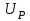 , то произведение IR можно считать равным нулю.
, то произведение IR можно считать равным нулю. Если потенциал электрода сравнения постоянен (
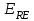 =const), то справедливо выражение:
=const), то справедливо выражение: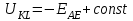
В том случае, если сопротивлением ячейки нельзя пренебречь, то для потенциала рабочего электрода справедливо выражение:
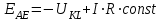
2.3. Принцип измерения
В простейшем случае в полярографии измеряют зависимость тока от напряжения, которое изменяется по линейному закону. На рис. 2 приведена схема классического измерительного устройства с двухэлектродной ячейкой. Данное устройство состоит из регистратора, электрохимической ячейки и напряжения.


