Файл: 1. Основные этапы развития микробиологии. Работы Л. Пастера, Р. Коха и их значение для развития микробиологии. Значение открытия Д. И. Ивановского. Роль отечественных ученых Н. Ф. Гамалея, П. Ф. Здродовского, А. А.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 09.02.2024
Просмотров: 48
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1.По консистенции (степени плотности):
– жидкие
– полужидкие
– плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют уплотнители или клеевые вещества. Чаще используют агар-агар или желатин
Агар-агар (по-малайски – желе) - полисахарид, продукт растительного происхождения, добываемый из морских водорослей. Применение агаровых сред благодаря их способности сохранять плотность при температуре 37°С дало возможность выращивать патогенные микробы при оптимальной для большинства из них температуре на плотных средах
Желатин – вещество белковой природы животного происхождения. Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается.
Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с селикагелем
2. По назначению:
– основные (общие)- служат для культивирования большинства патогенных микробов и являются основой для приготовления специальных сред. МПБ, МПА, пептонная вода.
– специальные- служат для выделения и выращивания того или иного вида микроорганизмов, не растущих на простых средах.
Среди специальных выделяют:
– элективные (избирательные) - служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов, это достигается путём добавления факторов элективности – различных веществ : определённых антибиотиков, солей, изменения pH.
– жидкие элективные среды называют средами накопления (обогащения),используются для облегчения выделения чистой культуры возбудителя в том случае, когда возбудителя заведомо мало в материале.
– элективно-диффреренциальные – содержат элективный фактор и компоненты, позволяющие определить какой-либо дифференциальный (отличительный) признак выделенной культуры. Например: ЖСА, где повышенная концентрация соли - это элективный фактов, а желток куриного яйца позволяет определить наличие фермента лецитиназы – дифференциальный признак патогенного стафилококка.
дифференциально-диагностические- позволяют отличить один вид микробов от другого по ферментативной активности.
По своему назначению дифференциально-диагностические питательные среды подразделяются следующим образом:
· Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин, свернутую кровяную сыворотку и т. д. ·
Среды с индифферентными химическими веществами, которые служат источником питания для одних видов микробов и не усваиваются другими видами.
· Среды с углеводами и многоатомными спиртами для обнаружения соответствующих ферментов. · Среды для определения редуцирующей способности микробов
– консервирующие – предназначены для первичного посева и транспортировки исследуемого материала.
В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических и окислительно-восстановительных ферментов, вводят индикаторы
3. По происхождению.
– натуральные (естественные) среды- готовят из продуктов животного и растительного происхождения (мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови и др.)
– синтетические среды- готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.

Требования к питательным средам
1Содержать необходимые для питания микроорганизма вещества - быть питательными, т.е. содержать в легко усвояемом виде все вещества, необходимые для удовлетворения пищевых и энергетических потребностей
2. иметь оптимальную концентрацию водородных ионов - pH, т.к. только при оптимальной реакции среды, влияющей на проницаемость оболочки, микроорганизмы могут усваивать питательные вещества. Для большинства патогенных бактерий оптимальна слабощелочная среда (pH 7,2-7,4).
3. Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили pH, среды должны обладать буферностью, т.е. содержать вещества, нейтрализующие продукты обмена.
4. быть изотоничными для микробной клетки, т.е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальная среда, соответствующая физиологической концентрации NaCl.
5. плотные среды должны быть влажнымии иметь оптимальную для микроорганизмов консистенцию, так как микробы питаются по законам диффузии и осмоса
6. быть по возможности унифицированными, т.е. содержать постоянное количество отдельных ингредиентов.
8. желательно, чтобы среды были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.
9. быть стерильными, т.к. посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды.
13 Выделение чистых культур аэробов .
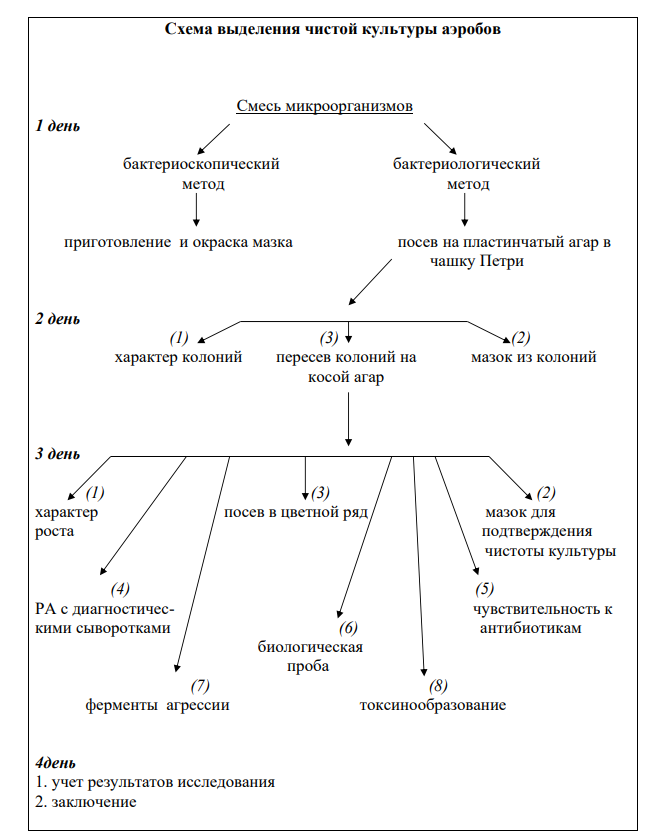
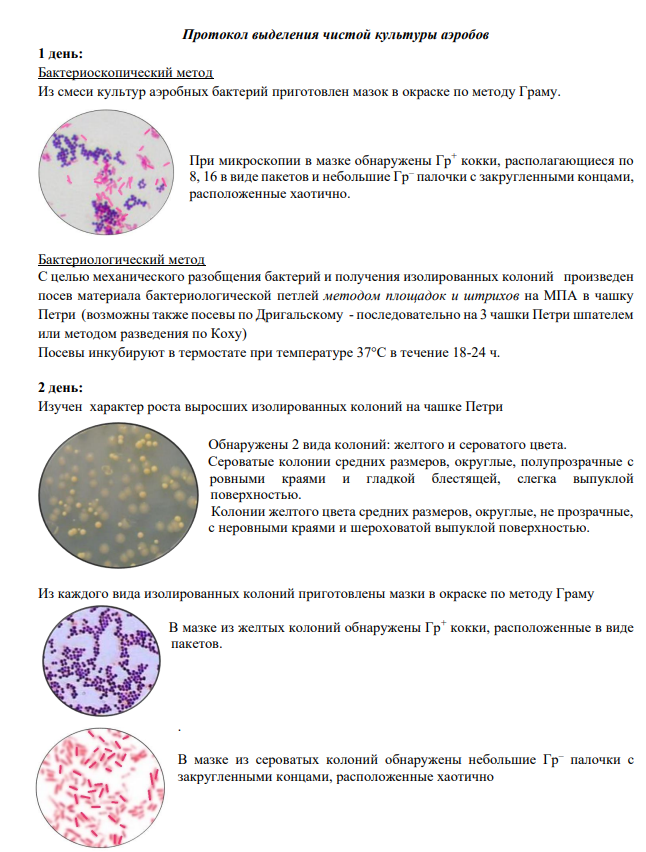
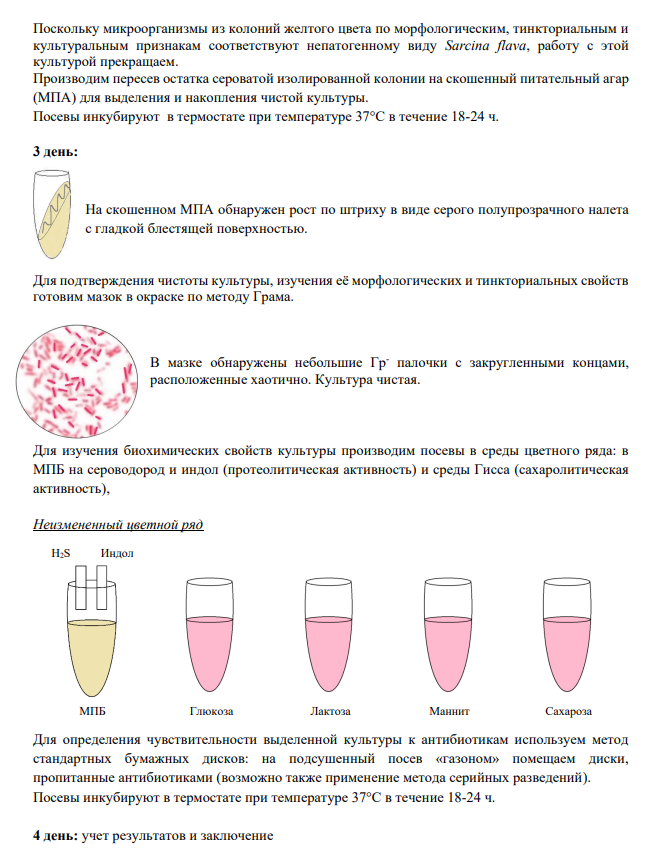
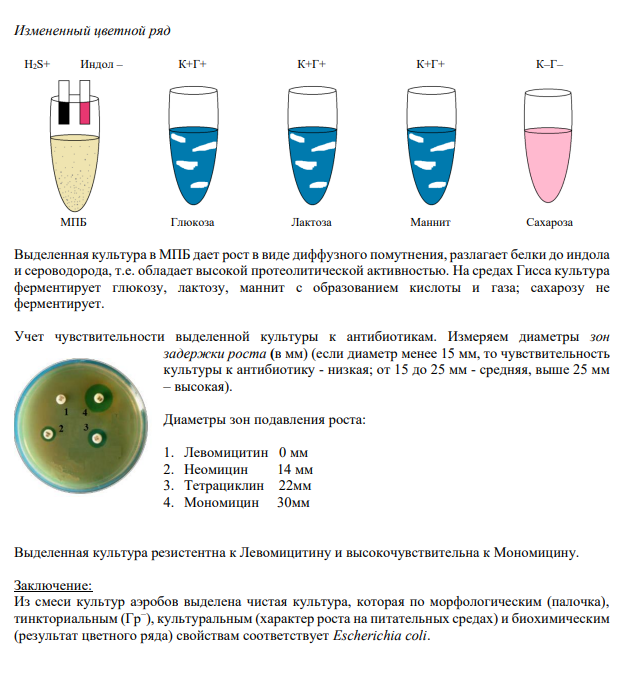
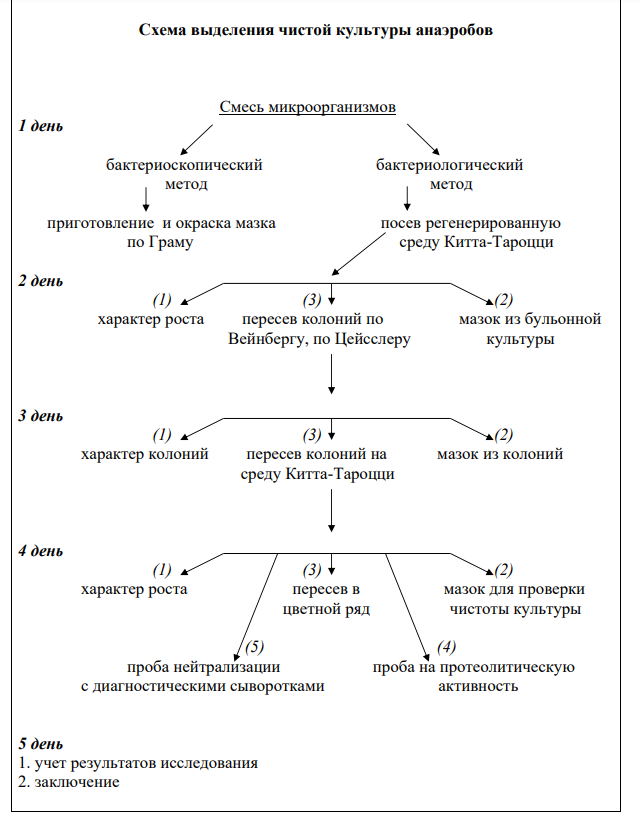
14 Выделение чистых культур анаэробов
Сущность условий, необходимых для культивирования анаэробов, заключается в снижении парциального давления молекулярного кислорода, что достигается механическими, физическими, химическими и биологическими способами.
Механические методы удаления кислорода
1. Посев анаэробной культуры уколом в высокий столбик сахарного агара или среды Вильсон-Блера. Это наиболее простой способ.
2. Способ Виньяля-Вейона. В расплавленный и остуженный до 50°С агар вносят исследуемую анаэробную культуру, перемешивают и засасывают в пастеровскую пипетку, конец которой запаивают. В среде вырастают ясно видимые снаружи колонии бактерий, которые можно извлечь, распилив трубку.
3. Метод Перетца. В пробирку с растопленным и остуженным до 45°С сахарным агаром вносится и размешивается исследуемая культура. Смесь выливается в стерильную чашку Петри, охлаждается. На поверхность накладывается стерильное стекло. Чашку в закрытом виде помещают в термостат на 18-20 часов. Под стеклом вырастают колонии, которые извлекают, отодвинув стекло. Физические методы удаления кислорода
1. Анаэростат, из которого воздух выкачивается насосом. Можно использовать вместо анаэростата эксикатор, где на дно которого помещеныхимические поглотители кислорода (щелочной растворпирогаллола и др.)
2. Аппарат Киппа, где воздух заменен водородом.
3. Среда Китта-Тароцци (МПБ, 0,5 % глюкозы и кусочками свежих органов животных, например, печени или с мясным фаршем). Кусочки органов, а также глюкоза обладают рецидивирующими свойствами. Перед посевом её кипятят и заливают сверху вазелиновым маслом.
Химические методы удаления кислорода
1. Прибор Омелянского, где для поглощения кислорода используется пирогаллол.
2. Среда Вильсон-Блера (железо-сульфитный агар). Черные колонии образует Cl.perfringens за счет образования сульфата железа (FeS).
Биологический метод удаления кислорода по Фортнеру В чашку Петри с толстым слоем агара делят на 2 половины, на одну половину засевают облигатный аэроб – «чудесную» палочку (S.marcescens), на другую половину чашки засевают исследуемую анаэробную культуру. Чашку заливают растопленным парафином


15 Ферменты бактерий. Использование ферментативной активности бактерий при их идентификации
В основе всех метаболических реакций в бактериальной клетке лежит деятельность ферментов, которые принадлежат к 6 классам: оксиредуктазы, трансферазы, гидролазы, лигазы, лиазы, изомеразы. Ферменты, образуемые бактериальной клеткой, могут локализоваться как внутри клетки —эндоферменты, так и выделяться в окружающую среду —экзоферменты. Экзоферменты играют большую роль в обеспечении бактериальной клетки доступными для проникновения внутрь источниками углерода и энергии. Большинство гидролаз является экзоферментами, которые, выделяясь в окружающую среду, расщепляют крупные молекулы пептидов, полисахаридов, липидов до мономеров и димеров, способных проникнуть внутрь клетки. Ряд экзоферментов, например гиалуронидаза, коллагеназа и другие, являются ферментами агрессии. Некоторые ферменты локализованы в периплазматическом пространстве бактериальной клетки. Они участвуют в процессах переноса веществ в бактериальную клетку. Ферментативный спектр является таксономическим признаком, характерным для семейства, рода и — в некоторых случаях — для видов. Поэтому определением спектра ферментативной активности пользуются при установлении таксономического положения бактерий. Наличие экзоферментов можно определить при помощи дифференциально-диагностических сред
Для определения ферментативной (биохимической) активности микробов используют дифференциально – диагностические среды.
К дифференциально – диагностическим средам относятся среды Гисса, на которых изучается сахаролитическая активность микрооганизмов.
Среды Гисса могут быть жидкими и плотными. Основу сред Гисса составляют мясо – пептонный бульон (МПБ) и мясо – пептонный агар (МПА). В состав этих сред входит углевод и индикатор. Существуют два ряда сред Гисса – большой (включающий 27 наименований) и малый. Малый ряд сред Гисса включает мальтозу, глюкозу, сахарозу, манит и лактозу. Исходная установка рН среды – слабо щелочная (7,2 – 7,4).
Если при культивировании микробов происходит расщепление субстрата до кислоты, то рН среды изменяется в кислую сторону и при этом происходит изменение цвета индикатора. Изменение цвета питательной среды и является показателем наличия у данного микроба фермента, расщепляющего конкретный субстрат до кислоты. И в жидкой, и в плотной питательной среде о наличии фермента, расщепляющего субстрат до кислоты, судят по изменению цвета индикатора. Для определения аммиака используют красную лакмусовую бумажку.
Образование газа устанавливают по скоплению пузырьков газа в толще агара и по разрыву агара (если среды Гиса плотные) или по скоплению пузырьков газа в поплавке (если среды жидкие). Поплавок – узкая стеклянная трубочка с запаянным концом, обращенным вверх, которую помещают в пробирку со средой перед стерилизацией среды.
Различие в наборе ферментов, расщепляющих углеводы, может быть использовано при дифференцировке родственных микробов, например, сальмонелл, шигелл, эшерихий. Так, на средах Эндо, Левина, Плоскирева, в состав которых входит лактоза и индикатор (анилиновый краситель), колонии кишечной палочки будут окрашены в фиолетовый цвет (на среде Левина) или в сиреневый (на средах Эндо и Плоскирева). Колонии сальмонелл и шигелл на этих же средах будут бесцветными.
16 Нормальная микрофлора организма человека и ее значение. Дисбактериозы. Эубиотики.
Микрофлора представляет собой стабильное сообщество микроорганизмов, т.е. микробиоценоз. Она колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. Место обитания сообщества микроорганизмов называется биотопом. В норме микроорганизмы отсутствуют в легких и матке. Различают нормальную микрофлору кожи, слизистых оболочек рта, верхних дыхательных путей, пищеварительного тракта и мочеполовой системы. Среди нормальной микрофлоры выделяют резидентную и транзиторную микрофлору. Резидентная (постоянная) облигатная микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная) микрофлора не способна к длительному существованию в организме.


