ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 24
Скачиваний: 0
Уравнение полярографической волны Ильковича-Гейровского.
Рассмотрим электролиз в системе, где катодом служит ртутный капающий электрод, а анодом является практически неполяризуемый каломельный электрод. Если в растворе нет веществ, способных восстанавливаться под действием электрического тока, сила тока будет пропорциональна приложенному напряжению Е (закон Ома):1=E/R..
В присутствии веществ, способных восстанавливаться на ртутном электроде в области исследуемых напряжений по достижении потенциала восстановления ионы начнут разряжаться на ртутном катоде (нередко с образованием амальгамы):
Мn++ne-+ Hg=M (Hg)
Потенциал ртутного катода, на котором протекает обратимый процесс, выражается уравнением Нернста:
Е=Е°+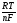 ln
ln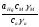
где Са—концентрация амальгамы;
a—ее коэффициент активности;
См—концентрация восстанавливающихся ионов в приэлектродном слое (заряд иона для простоты опущен);
а— его коэффициент активности;
аHg—активность ртути в амальгаме;
Е°—стандартный потенциал электрода.
В результате процесса сила тока в цепи начнет возрастать и концентрация восстанавливающихся ионов у поверхности ртутной капли уменьшится. Однако за счет диффузии из массы раствора к поверхности капли доставляются новые порции ионов. Сила тока в цепи будет зависеть от скорости диффузии, которая пропорциональна разности концентраций в массе раствора (С0М) и в приэлектродном слое (СМ). Сила тока будет пропорциональна этой разности:
I= kM(cM0-cM).
Вклад других, недиффузионных механизмов поступления ионов в прикатодный слой ( например, миграция ионов к катоду под действием электрического поля в условиях большого избытка индифферентного фонового электролита пренебрежимо мал. При некотором потенциале катода концентрация ионов у поверхности ртутной капли См уменьшится до ничтожно малой по сравнению с концентрацией в массе раствора, и скорость разряда ионов на катоде станет равной скорости диффузии.
Концентрация восстанавливающегося иона в глубине раствора постоянна, а концентрация в прикатодном слое близка к нулю. Поэтому разность концентраций, определяющая скорость диффузии при данной температуре, будет постоянна, что и приводит к постоянной скорости поступления ионов к катоду и постоянной силе тока, не изменяющейся при дальнейшем увеличении напряжения. Этот постоянный ток, контролируемый диффузией, называют диффузионным :
Iд =kМ сМ.
Тогда:
cM=
 .
.
Концентрация амальгамы:
Сa=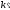 aI
aI
После подстановки в уравнение Нернста):
Е
= Е° +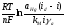 .
.
Выделим в уравнении величины, зависящие только от температуры:
E=E0+
Это уравнение полярографической волны, а величину Е1/2 называют потенциалом полуволны
Е1/2=E0+
Потенциал полуволны является качественной характеристикой иона и зависит от среды:
1.Природы и концентрации фонового электролита.
2.Наличие в растворе веществ, способных к комплексообразованию с определяемым ионом. Присутствие в исследуемом растворе лиганда смещает потенциал полуволны в отрицательную область, что позволяет создавать условия для определения нескольких компонентов в одном растворе без их предварительного разделения. Например, в 1 М КС1 ионы свинца (II) и таллия (I) имеют потенциалы полуволны, соответственно, —0,435 и —0,483 В и их раздельное определение неосуществимо. В 1 М NaОН потенциал полуволны свинца становится равным—0,755 В, а у таллия остается практически без изменения.
Если в растворе находится несколько веществ, потенциалы полуволны которых различаются на 100 мВ и больше, то на полярограмме будет не одна волна, а несколько — по числу восстанавливающихся ионов, а возможно и больше, так как при ступенчатом восстановлении один ион может давать две. Для идентификации неизвестного вещества можно этим методом определить потенциал полуволны и, пользуясь таблицей потенциалов полуволны или полярографическим спектром, установить наиболее вероятный элемент

|
Рис 44. Полярограмма 1—остаточный ток; 2—диффузионный ток. |
Рис 45. Полярограмма при наличии в растворе восстанавливающихся веществ А, В и С.
|
Количественный полярографический анализ
Методы прямой полярографии основаны на непосредственном применении уравнения полярографической волны и уравнения Ильковича
Iд =kМ сМ.
Метод градуировочного графика. График строят по данным полярографирования нескольких стандартных растворов. На оси ординат откладывается пропорциональная силе диффузионного тока высота полярографической волны, а по оси абсцисс — концентрация анализируемого вещества. Метод дает точные результаты при условии строгой идентичности условий полярографирования стандартных растворов и неизвестной пробы
Метод стандартчых растворов. В этом методе в строго одинаковых условиях снимают полярограммы стандартного и анализируемого растворов. неизвестную концентрацию рассчитывают из пропорции. Метод применим только в условиях строгой стандартизации условий полярографирования.
Метод добавок. Определяют диффузионный ток при полярографировании исследуемого раствора и его же с добавкой известного количества стандартного раствора. Неизвестную концентрацию рассчитывают из пропорции. Можно использовать также графический метод. В методе добавок автоматически учитывается влияние фона и третьих компонентов, что является важным достоинством метода.
Дифференциальная полярография
Используется для анализа смесей, содержащих ионы или вещества с близкими noтенциалами полуволны. Получать дифференциальные полярограммы можно графическим дифференцированием обычных полярограмм или с помощью специальной электрической схемы, позволяющей непосредственно записывать дифференциальную кривую во время полярографирования. Дифференциальная полярография имеет значительно более высокую разрешающую способность.

Рис 46. Полярограмма раствора, содержащего Рb(NО3)2 и ТlNО3 на фоне 2 М КNО3.
Этим методом могут быть определены свинец и таллий, у которых потенциалы полуволны на фоне 2М КNОз различаются только на 0,06 В. На интегральной полярограмме оба иона образуют одну общую волну (рис. 6.43,а), а на дифференциальных кривых четко видны два максимума (рис. 6.43,б). Методы дифференциальной полярографии более точны
Хроноамперометрия с линейной разверткой потенциала
Обычная скорость изменения потенциала в этом методе составляет до 50 мВ/с вместо 2-3 мВ/с в классической полярографии. Для измерения силы тока здесь вместо гальванометра используют безинерционный осциллограф. При достижении потенциала восстановления ток резко возрастает и достигает максимума, превышая величину Id классической полярографии, поскольку происходит электровосстановление практически всех ионов приэлектродного слоя, и затем падает, так как приэлектродный слой обедняется ионами, а скорость диффузии недостаточна, чтобы пополнить дефицит за столь короткое время. Потенциал максимума на этой кривой является качественной характеристикой иона, а высота максимума пропорциональна концентрации иона. Метод имеет более низкий предел обнаружения, чем обычная вольтамперометрия.
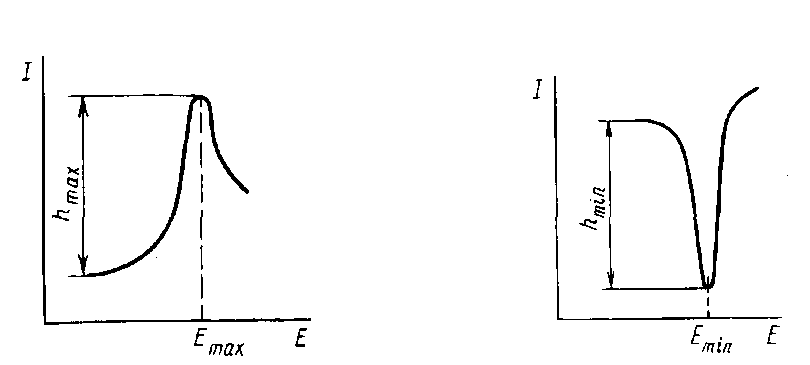
|
Рис 47. Осциллографическая полярограмма |
Рис 48. Кривая анодного растворения |


