ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 29
Скачиваний: 0
ВОЛЬТАМПЕРОМЕТРИЯ– высокочувствительный метод анализа неорганических и органических веществ в химических, биологических, геологических, экологических и других объектах.
Метод основан на получении и изучении вольтамперных (поляризационных) кривых, отражающих зависимость силы тока (I), протекающего через электрохимическую ячейку от приложенного к ячейке напряжения (Е). Поляризацией называют смещение потенциала электрода от равновесного значения под действием прилагаемого напряжения.
Соответственно вольтамперные кривые, выражающие зависимость тока разрядки электрохимически активного вещества на поляризуемом электроде от прилагаемого напряжения называют поляризационными. Электродная ячейка в вольтамперометрии содержит два электрода с сильно различающимися размерами поверхностей. Рабочий электрод, на котором происходят процессы окисления или восстановления, называется микроэлектродом и имеет весьма малую поверхность £ ~ 0,01...0,03 см2. Второй электрод имеет поверхность £ в сотни раз большую и называется макроэлектродом.
При прохождении тока I через ячейку его плотность на микроэлектроде, то есть отношение 1/5, в сотни раз больше, чем на макроэлектроде. Поэтому микроэлектрод сильно поляризуется, на нем с большой скоростью протекают процессы электровосстановления или электроокисления. Из-за малой плотности тока на макроэлектроде он не поляризуется, и его потенциал остается постоянным. Это первое условие электролиза в вольтамперометрии; второе условие электролиза — непрерывное повышение напряжения на ячейке с определенной скоростью, но не более 200 мВ/мин.
При прохождении постоянного тока через электролитическую ячейку процесс характеризуется соотношением: E = Eа – Eк + I ∙ R, где
E – приложенное извне напряжение;
Eа – потенциал анода;
Eк – потенциал катода;
I – ток в цепи;
R – сопротивление электролитической ячейки
Процесс электролиза в указанных условиях рассмотрим на примере восстановления катиона металла в растворе:
Мен+ + не — Ме (1)
Напряжение Е, приложенное к электродной ячейке, в которой протекает этот процесс, описывают соотношением:
Е = Еа - Ек + 1Я, (2)
Где:
Е —приложенное напряжение, В;
I — сила тока, проходящего через раствор ячейки, А;
Я — электрическое сопротивление раствора в ячейке, Ом;
Еа — потенциал анода, В;
Ек — потенциал катода, В.
Схема вольтамперометрической установки
ИЭ –
индикаторный электрод; ЭС –
электрод сравнения;
Г –
гальванометр;
V – вольтметр; Rшунта –
шунт гальванометра;
Rдел –
делитель напряжения; ИСП –
источник стабилизированного питания.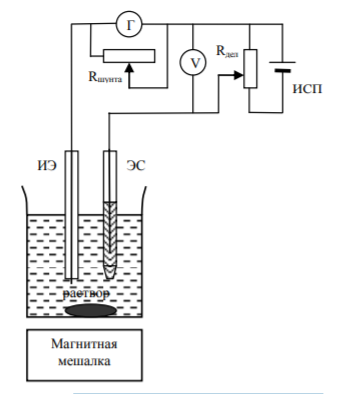
Сила тока I зависит от электростатического взаимодействия электродов с ионами, а также диффузионного процесса. Электростатическая составляющая тока, называемая миграционным током, зависит от напряжения электрического поля, но не зависит от концентрации определяемого вещества, поэтому не может использоваться в аналитических целях. Для устранения влияния электрического поля в исследуемый раствор вводят 50-100 кратный избыток (по сравнению с концентрацией определяемых ионов) индифферентного электролита, называемого фоном. Ионы фона не участвуют в электродных процессах, но экранируют электрические поля электродов, и доля миграционного тока будет ничтожно мала. В этом случае подвод исследуемых ионов к ИЭ осуществляется за счет диффузии в приэлектродный слой раствора, концентрация в котором (СЭ) меньше концентрации в глубине раствора (С). Скорость диффузии и, тем самым, сила тока, определяются разностью (градиентом) концентраций (С - СЭ), поэтому данная составляющая тока называется диффузионным током (Iдиф):
Iдиф = K (С - СЭ).
Чем больше напряжение, тем больше ионов в приэлектродном пространстве разряжаются, т.е. уменьшается СЭ. При некотором потенциале ИЭ значение СЭ становится равным нулю. Это означает, что все ионы, подходящие к ИЭ, разряжаются. Дальнейшее увеличение напряжения не вызывает роста тока – достигается значение предельного диффузионного тока, который линейно зависит от концентрации:
Iпр= K С.
Следовательно, величина Iпр может использоваться для целей количественного вольтаперометрического анализа.
Электрохимическая ячейка для вольтамперометрических измерений
Для регистрации в вольтамперометрометрии применяют 2х и 3х электродные ячейки.
- особенностью является очень большое различие площадей поверхности электродов. Площадь поверхности индикаторного значительно меньше. Плотность тока в электроде сравнения значительно меньше, чем в индикаторном.
Рисунок слева: 2х электродная; справа – 3х электродная ячейка
Двухэлектродная
ячейка включает индикаторный электрод
(ИЭ) и электрод сравнения (ЭС). При
регистрации вольтамперограмм может
протекать довольно заметный электрический
ток, поэтому рекомендуют применять
трёхэлектродную ячейку, в которую для
токоотвода от индикаторного электрода
дополнительно вводят вспомогательный
электрод (ВЭ) (платиновая проволочка). 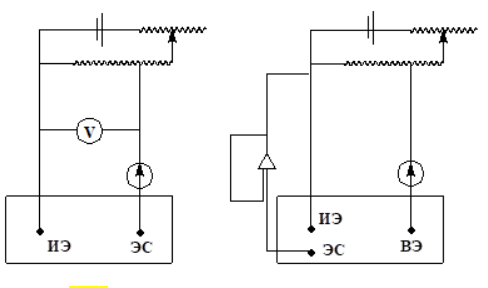
Для вольтамперометрических измерений используется трехэлектродная ячейка, изображенная на рис.1.5.
Индикаторный
электрод должен обратимо реагировать
на изменение состава анализируемого
раствора, чтобы по наличию (или отсутствию)
аналитического сигнала и его интенсивности
можно было судить о том, есть ли
определяемый компонент в растворе и в
каком количестве. Индикаторный электрод
не должен реагировать с компонентами
раствора, поэтому для их изготовления
чаще всего применяют химически инертные
токопроводящие материалы: благородные
металлы (золото, платина), ртуть, углеродные
материалы (графит, стеклоуглерод).
Непременным условием вольтамперометрического
анализа является применение индикаторного
микроэлектрода, например ртутного с
поверхностью ртутной капли не более
0,1см2 , и вспомагательного макроэлектрода,
поверхность которого в сотни раз выше,
чем индикаторного. Напряжение, подаваемое
на ячейку: U=Eа – Ек + IR, где IR – падение
напряжения в электролите, оно небольшое
(порядка 1мВ), поэтому им можно пренебречь,
тогда U = Eа – Ек ,
i l/s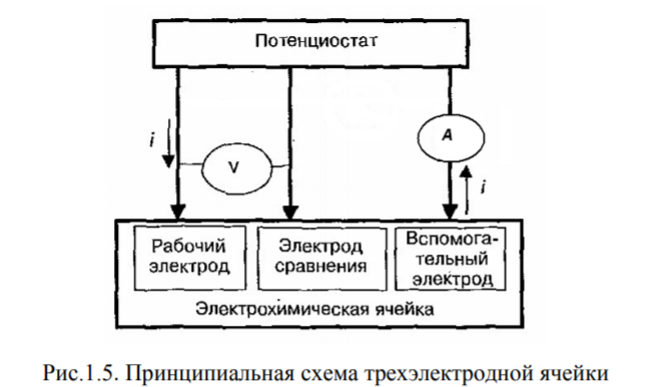
Плотность тока i l/s на макроэлектроде будет незначительной, и это не будет вызывать отклонение равновесного потенциала электрода. В этом случае электрод будет неполяризуемым, т.е. Eа = const (в случае макроанода) или Ек = const (в случае макрокатода). Плотность тока на микроэлектроде будет значительной, и это вызовет поляризацию электрода; таким образом, все прилагаемое напряжение на ячейку будет тратиться на поляризацию микроэлектрода. Если потенциал рабочего электрода измеряют относительно потенциала электрода сравнения, условно приняв последний за нуль, то в этом случае U= Eа для рабочего микроанода и U= – Ек для рабочего микрокатода.
При этом электрод сравнения должен обладать постоянным и не зависящим от состава раствора потенциалом. Иногда даже не обязательно знать его численное значение, достаточно, чтобы оно воспроизводилось от опыта к опыту и не изменялось при протекании через ячейку небольших токов. Из других требований существенными являются низкое электрическое сопротивление в схеме, отсутствие влияния на состав анализируемого раствора и простота конструкции. На практике в качестве электрода сравнения чаще всего используют хлорсеребряный и каломельный электроды (рис. 1.6).

Рис.1.6. Электроды сравнения хлоридсеребряный (а) и каломельный (б) с двойным солевым мостиком: 1 – асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 2 – внешний раствор КС1 (насыщ.); 3 – крошечное отверстие для контакта; 4 – внутренний раствор КС1 (насыщ.), AgCl (тв.); 5 – отверстие для ввода раствора КС1; 6 – паста из смеси Hg2Cl2 , Hg и КС1 (насыщ.)
Таким образом, регистрируемая вольтамперограмма I=f(E) отражает электрохимический процесс, происходящий на индикаторном электроде. Вольтамперограмму, полученную на ртутном электроде, называют полярограммой.
Характеристика вольтамперограммы
Численное значение Iпр измеряют по регистрируемой в ходе анализа вольтамперной кривой, называемой по внешнему виду «волной». Вид вольтамперограммы определяется составом раствора. В случае электропревращения на электроде ионов двух 16 электроактивных веществ она имеет вид, представленный на рисунке ниже.
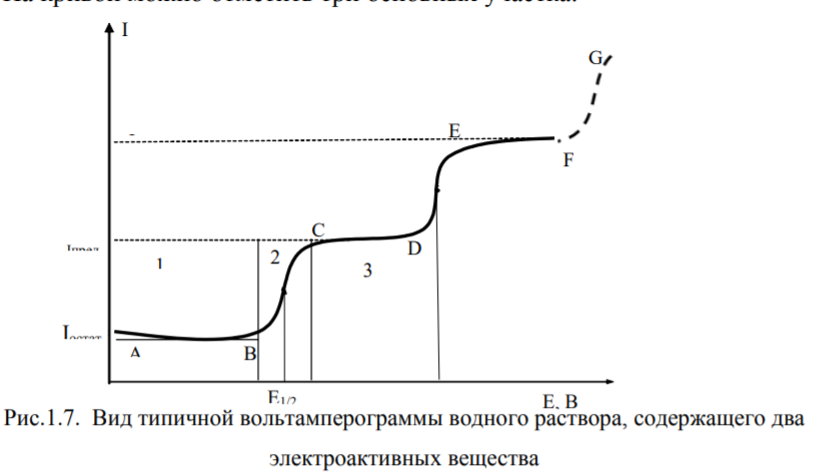
Участок АВ характеризуется плавной, почти горизонтальной линией и указывает на отсутствие разряда определяемых ионов. Ток в этом случае незначительный, он называется остаточным током и обусловлен двумя причинами:
восстановлением на электроде примеси более электроположительной, чем определяемый ион (фарадеев ток, Iфар);
образованием двойного электрического слоя на границе электрод – раствор (ѐмкостный ток или ток заряжения Iзар)
Iост = Iфар + Iзар
Участок ВС характеризуется резким подъемом тока при незначительном увеличении потенциала электрода. Величина силы тока здесь определяется количеством разряжающихся ионов, которые диффундируют к поверхности электрода из глубины раствора. Диффузия ионов обусловлена градиентом концентрации, имеющим место в связи с уменьшением концентрации в приэлектродном слое за счет восстановления ионов на поверхности электрода. С увеличением потенциала количество ионов, разряжающихся на поверхности электрода, будет увеличиваться, следовательно, будет расти и градиент концентрации.
С дальнейшим незначительным увеличением потенциала наступает момент, когда все ионы данного вида, подходящие к поверхности электрода, мгновенно разряжаются. Дальнейшее увеличение потенциала не приведет к увеличению числа разряжающихся ионов. Наступит явление концентрационной поляризации, характеризующееся тем, что рост потенциала не сопровождается изменением величины силы тока. Сила тока будет иметь предельное значение. На кривой получаем почти горизонтальную площадку CD. Сила тока, при которой достигается полный разряд всех ионов данного вида, поступающих в приэлектродное пространство за счет диффузии, называется предельным диффузионным током.
Силу предельного диффузионного тока можно рассчитать по уравнению Ильковича:
Id = 607 n C D1/2 m 2/3 t 1/6
где n – число электронов, участвующих в электрохимическом восстановлении (окислении) определяемого иона: D – коэффициент диффузии; m – масса ртути, вытекающая из капилляра в секунду; t – период капания ртути.
При дальнейшем увеличении напряжения разряжаются ионы другого электроактивного вещества (участок DE).
При анализе водных растворов, что часто имеет место, дальнейшее увеличение напряжения приводит к разряду ионов водорода или молекул воды с выделением водорода:
2Н+ + 2е = Н2,
2Н2О + 2е = Н2 + 2ОН-
Поскольку концентрация растворителя велика, предельного тока выделения водорода достичь не удается, и кривая будет иметь вид, показанный пунктиром на участке FG.
Уравнение вольтамперограммы для случая восстановления ионов металла имеет вид:
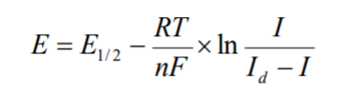
Это уравнение Гейровского – Ильковича, где Е1/2 – потенциал полуволны (В), т.е. потенциал, отвечающий точке перегиба на полярографической волне, когда сила тока составляет половину величины его предельного значения; I – ток, соответствующий данному потенциалу Е в данной точке кривой; Id – предельный диффузионный ток. По значению предельного диффузионного тока судят о количестве вещества, а по потенциалу полуволны – о природе иона.
Ориентировочно
Е1/2 можно найти,
опустив перпендикуляр из середины
полярографической волны на ось
потенциалов.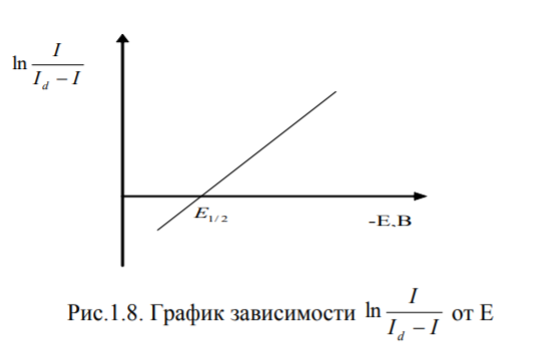
Более
точно Е1/2 можно определить
по графику линейной зависимости
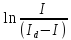 от
потенциала в точке пересечения графика
с осью абсцисс.
от
потенциала в точке пересечения графика
с осью абсцисс.
Нахождение потенциала полуволны является основой качественного полярографического и вольтамперометрического анализов.

