Файл: Курсовая работа по дисциплине Общая химическая технология Тема Синтез аммиака в производстве аммиака.docx
Добавлен: 03.05.2024
Просмотров: 403
Скачиваний: 6
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Таблица 2.1. - Физические постоянные аммиака при 760 мм рт.ст.
| Молекулярная масса, г/моль | Мольный объем при 0 С | Тпл, С | Ткип, С | Критические константы | ||
| Ткр, С | Ркр, атм | Vкр, см3/моль | ||||
| 17,0306 | 22049 | -77,8 | -33,5 | 132,4 | 111,5 | 72,5 |
Наиболее типичными примесями являются вода, смазочные масла, катализаторная пыль, окалина, карбонат аммония, растворенные газы, (водород, азот, метан). Аммиак жидкий синтетический должен соответствовать следующим требованиям (ГОСТ 6221 - 82):
Таблица 2.2 – Требования к аммиаку
| Содержание,% | 1-й сорт | 2-й сорт |
| аммиак, не менее | 99,9 | 99,6 |
| влага, не более | 0,1 | 0,4 |
| Примеси, мг/л, не более | ||
| масло | 10 | 35 |
| железо | 2 | не нормируется |
Аммиак является важнейшим и практически единственным соединением азота, производимым в промышленных масштабах из азота атмосферы. Таким образом, его следует рассматривать как полупродукт для получения всех остальных соединений азота.
3. Обоснование оптимальных параметров технологического процесса
3.1 Термодинамический анализ
Проведем термодинамический анализ для реакции синтеза аммиака в производстве аммиака, ключевым компонентом реакции будет являться аммиак.
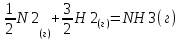
Таблица 3.1. - Термодинамические параметры веществ[1].
| Вещества |  |  |
 | -45,94 | 192,66 |
 | 0 | 191,5 |
 | 0 | 130,6 |
-
Найдем изменение энтальпии реакции при стандартных условиях:

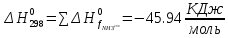
-
Определим изменение энтропии реакции:


-
Определим изменение энергии Гиббса:
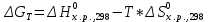






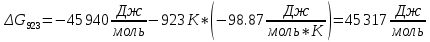
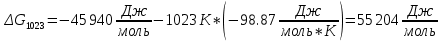
На основании полученных данных, построим график, отражающий зависимость
 (рис. 1).
(рис. 1).Рис. 1 – Зависимость

Реакция обратима на интервале температур, поэтому рассчитаем температуру инверсии.

Из графика очевидно, что при увеличением температуры
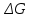 также увеличивается. Значит, при повышении температуры равновесие сдвигается в сторону обратной реакции, а при понижении температуры – в сторону прямой.
также увеличивается. Значит, при повышении температуры равновесие сдвигается в сторону обратной реакции, а при понижении температуры – в сторону прямой.3.2 Принцип Ле-Шателье
Синтез аммиака протекает в газовой фазе, с уменьшением ее объема в результате прямой реакции. В таком случае, по принципу Ле-Шателье, увеличение давления приведет к сдвигу равновесия реакции в сторону продуктов, а уменьшение давления – в сторону реагентов.
По принципу Ле-Шателье для сдвига равновесия реакции синтеза аммиака в сторону продуктов, необходимо в равновесной газовой смеси увеличить концентрацию азота и водорода или уменьшить концентрацию аммиака. Последнее можно осуществить на практике: после образования из азота и водорода некоторого количества аммиака, газовую смесь необходимо как можно более полно освободить от аммиака.
3.3 Кинетический анализ
Реакция синтеза аммиака, является гетерогенной каталитической реакцией, так как протекает между газообразными веществами на поверхности твердого катализатора, поэтому её механизм будет соответствовать данным стадиям:
-
перенос газообразных реагирующих веществ к поверхности катализатора, -
адсорбция -
реакция на поверхности -
десорбция продукта реакции с поверхности -
перенос продукта реакции от поверхности в объем газовой фазы.
Адсорбция при гетерогенно-газовых каталитических реакциях характеризуется, относительно высокой энергией активации и сопровождается выделением значительного количества тепла. Данная адсорбция называется активированной.
Скорость суммарного процесса будет определять лимитирующая стадия. Какая из них будет медленной, зависит от свойств системы и значений внешних параметров. Иногда скорость каталитического процесса определяют стадии переноса газообразных веществ к поверхности и продуктов реакции от поверхности. К примеру, если смесь в газовой фазе проходит через слой катализатора с малой линейной скоростью, то перенос веществ к поверхности катализатора совершается медленнее и может ограничивать скорость суммарного процесса — реакция характеризуется малым значением энергии активации и незначительным увеличением скорости реакции с повышением температуры. Однако чаще всего скорость
реакции ограничивается скоростью адсорбции, десорбции или реакции на поверхности. В случае с синтезом аммиака, с помощью многочисленных исследований было установлено, что лимитирующей стадией является адсорбция азота.
На основании литературных данных, механизм процесса синтеза аммиака состоит из последующих этапов[2]:
-
Диффузия азота и водорода на поверхность катализатора из газовой фазы через пограничный слой -
Диффузия из пор kat в реакционный центр -
Адсорбция молекул азота и водорода на поверхности kat -
Химическое взаимодействие азота и водорода -
Десорбция аммиака с поверхности -
Транспортировка аммиака через систему пор обратно на поверхность -
Диффузия аммиака в газовый объем
В виде химического процесса это будет выглядеть так:
1. N2+↔ N2⁕
2. N2⁕ + ⁕↔ 2N⁕
3.N⁕ +H⁕ ↔ NH⁕
4. NH⁕ +H⁕ ↔ NH2⁕ + ⁕
5. NH2⁕ +H⁕ ↔ NH3⁕ + ⁕
6.NH3⁕↔ NH3+ ⁕
7.H2+ 2⁕↔ 2H⁕
Стадии каталитического синтеза аммиака следующие. Азот и водород диффундируют из объема газовой фазы к поверхности катализатора, где протекает активированная адсорбция обоих газов. Воздействие условий, адсорбция азота на поверхности катализатора зависит от микроскопической структуры поверхности катализатора. Железо имеет разные кристаллические поверхности, реакционная способность которых сильно различается. Далее адсорбированный азот вступает во взаимодействие с адсорбированным или газообразным водородом, причем последовательно образуются имид NH, амидNH2и аммиак NH3. Последний десорбируется с поверхности и поступает в объем газовой фазы. Из всех перечисленных стадий, одна является лимитирующей, то есть определяющей скорость суммарного процесса. Очевидно, что первые и последние два этапа (транспортировка и диффузия) будут протекать быстрее, чем адсорбция и десорбция, по причине оболочечной структуры катализатора. Кинетика синтеза аммиака на железных катализаторах изучалась многими авторами. По общему признанию, лимитирующей стадией процесса является адсорбция молекул азота на поверхности катализатора. М. И. Темкин и В. М. Пыжев предложили уравнение для скорости синтеза аммиака на большинстве известных катализаторов:
 , где
, гдеk1,
k2 – константы скорости прямой и обратной реакции;
PN2, PH2, PNH3 – парциальные давления компонентов;
α – коэффициент, характеризующий степень покрытия поверхности катализатора азотом, для железного kat величина составляет 0,5.
Зависимость влияния температуры на константы скоростей прямой и обратной реакции k1 и k2 выражает закон Аррениуса:
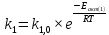 ;
;  ;
;где Eакт – энергия, активации прямой и обратной реакции;
R – универсальная газовая постоянная = 8,31⸱103;
k1,0 и k2,0 - константы.
 – константа равновесия синтеза аммиака
– константа равновесия синтеза аммиакаРеакция синтеза аммиака экзотермическая из чего следует, что энергия активации для прямой реакции меньше, чем для обратной. По выражениям констант скоростей можно сделать вывод, что с увеличением температуры они будут возрастать, а при понижении температуры - уменьшаться. По уравнению Аррениуса было выведено уравнение для расчета оптимальной температуры:
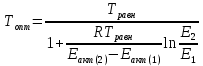
Имеется две характерные точки: оптимальная и равновесная температура. Оптимальная температура - температура, при которой скорость максимальна. Химическое равновесие - состояние, при котором скорость прямой и обратной реакции равны. (Рис. 2)
Рис.2. - Зависимость выхода аммиака от температуры при различных объёмных скоростях азотоводородной смеси (Р = 30 МПа)

Из рисунка видно следующее:
• с увеличением объёмной скорости (то же самое, что «с уменьшением времени соприкосновения газа с катализатором») выход аммиака уменьшается;
• для каждой объёмной скорости имеется оптимальная температура, которой соответствует максимальный выход аммиака.
Сначала, когда концентрации исходных веществ велики, скорость прямой реакции большая по сравнению с обратной, содержание аммиака в газовой смеси растёт, кроме того, увеличение температуры также способствует этому. [4]
