ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 42
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ТА + ПВ = С,
рівняння швидкості реакції має вигляд:
v = k * [A] m * [B] n
Це рівняння є математичний вираз закону діючих мас у загальному вигляді.
Щоб зрозуміти фізичний зміст константи швидкості реакції, треба прийняти в написаних вище рівняннях, що [А] = 1 моль / л і [В] = 1 моль / л (або прирівняти одиниці їх твір), і тоді v = k. Звідси ясно, що константа швидкості k чисельно дорівнює швидкості реакції, коли концентрації реагуючих речовин (чи його твір в рівняннях швидкості) рівні одиниці.
Загальна вираз для швидкості хімічної реакції отримано для даної, фіксованої температури. У загальному ж випадку, оскільки швидкість реакції залежить від температури, закон діючих мас записується як
v (T) = k (T) * [A] m * [B] n
де v і k є функціями температури.
9.3 Константа швидкості хімічної реакції, її залежність від температури
Численні досліди показують, що при підвищенні температури швидкість більшості хімічних реакцій істотно збільшується, причому для реакцій в гомогенних системах при нагріванні на кожні десять градусів швидкість реакції зростає в 2 - 4 рази (правило Вант-Гоффа).
Це правило пов'язане з поняттям температурного коефіцієнта швидкості реакції γ і визначається співвідношенням
γ = k Т +10 / k Т
Значення температурного коефіцієнта γ дає можливість розрахувати зміну швидкості реакції при збільшенні температури на деяке число градусів від Т 1 до Т 2 по формулі
v (Т 1) / v (Т 2) = γ (Т 2-Т 1) / 10
Очевидно, що при підвищенні температури в арифметичній прогресії швидкість реакції зростає в геометричній.
Каталіз
Каталіз - процес, що полягає у зміні швидкості хімічних реакцій у присутності речовин, які називаються каталізаторами. Каталітичні реакції - реакції, що протікають в присутності каталізаторів.
Позитивним називають каталіз, при якому швидкість реакції зростає, негативним ( інгібуванням) - при якому вона убуває. Прикладом позитивного каталізу може служити процес окислення аміаку на платині при отриманні азотної кислоти. Прикладом негативного - зниження швидкості корозії при введенні в рідину, в якій експлуатується метал, нітриту натрію, хромату і дихромата калію.
Багато найважливіші хімічні виробництва, такі, як отримання сірчаної кислоти, аміаку, азотної кислоти, синтетичного каучуку, ряду полімерів та ін, проводяться в присутності каталізаторів.
6.
Хімічна рівновага, фактори її зміщення. Принцип Лє-Шательє.
Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотними. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаютьсянеоборотними.
Умови необоротності хімічних реакцій
1) Продукти, що утворюються, виводяться зі сфери реакції — випадають у вигляді осаду, виділяються у вигляді газу:
2) Утворюються малодисоціюючі сполуки, наприклад вода:
3) Виділяється велика кількість енергії:
Хімічна рівновага
Оборотні реакції не йдуть до кінця і закінчуються встановленням хімічної рівноваги — такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові.
Стан хімічної рівноваги можна змістити в той або інший бік зміною зовнішніх умов: температури, тиску, концентрації речовин, що беруть участь у реакції. Ці зміни визначаються принципом динамічної рівноваги— принципом Ле Шательє: зовнішня дія на рівноважну систему зміщує рівновагу в напрямі ослаблення ефекту цієї дії.
Із принципу Ле Шательє випливає:
1) при збільшенні концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а при зменшенні концентрації — у бік її утворення;
2) зміна тиску зміщує рівновагу тільки в газових системах. Зі збільшенням тиску рівновага зміщується у бік зменшення об’єму (кількості речовини) газоподібних речовин,
із зменшенням тиску — у бік збільшення об’єму (кількості речовини) газоподібних речовин. Якщо реакція проходить без зміни числа молекул (кількості речовини) газоподібних речовин, то тиск не впливає на стан рівноваги;
3) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури — екзотермічної реакції.
7.
Окисно-відновні реакції. Окисник,відновник. Складання ОВР методом електронного баланса.
Окисно-відновні реакції
За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на:
1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, реакції іонного обміну в розчинах та деякі інші:
AgNO3 + NaCl → AgCl ↓ і + NaNO3.
2) Реакції, що протікають зі зміною ступеня окиснення всіх або деяких (або навіть одного) елементів, наприклад:
— усі елементи змінюють ступені окиснення:
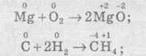
— деякі елементи змінюють ступені окиснення:

— один елемент змінює ступінь окиснення:

Хімічні реакції, які протікають зі зміною ступеня окиснення елементів, що входять до складу реагентів, називають окисно-відновними реакціями (ОВР).
Будь-який окисно-відновний процес обов’язково складається з двох протилежних процесів — окиснення та відновлення.
Окиснення — це процес віддачі електронів атомом, іоном або молекулою. Якщо атом віддає електрон, то він здобуває позитивний заряд:
Якщо негативно заряджена частинка віддає електрон, то вона може перетворюватися в нейтральний атом або позитивно заряджену частинку:
Якщо ж позитивно заряджена частинка віддає електрони, то вона збільшує свій позитивний заряд:
Відновлення — це процес прийому електронів атомом, іоном або молекулою. Якщо нейтральний атом приймає електрони, то він перетворюється в негативно заряджену частинку:
Якщо позитивно заряджена частинка приймає електрони, то вона зменшує свій позитивний заряд і залежно від числа прийнятих електронів може перетворитися в позитивно заряджену частинку з меншим позитивним зарядом, нейтральний атом або негативно заряджену частинку:
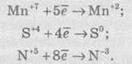
Частинку (атом, молекулу або іон), яка приймає електрон, називають окисником, а частинку, яка віддає електрони — відновником. Окисник у процесі реакції відновлюється, а відновник — окислюється. Оскільки в результаті реакції одна частинка віддає електрони, то обов’язково має бути частинка, яка ці електрони приймає, тому процеси окиснення й відновлення нерозривно пов’язані й не можуть протікати незалежно один від одного. Із цієї ж точки зору в окисно-відновному процесі обов’язково мають брати участь окисник і відновник, ОВР не може протікати між двома окисниками або між двома відновниками.
Окисниками можуть бути частинки, які здатні приймати електрони. До таких частинок належать: 1) нейтральні атоми та молекули неметалів; 2) позитивно заряджені іони металів, складні іони та молекули, що містять атоми елементів з вищим або проміжним ступенем окиснення.
Катіони як окисники
Позитивно заряджені іони металів тією чи іншою мірою володіють окисною здатністю, тобто здатні приймати електрони — відновлюватися. Серед них найсильнішими окисниками є іони металів з найвищим ступенем окиснення.



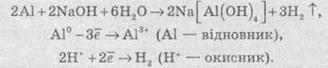
Аніони як окисники
Типовими окисниками є аніони, до складу яких входять атоми перехідних металів з вищим ступенем окиснення, наприклад: КМnО, (Мn+7), К2Сr2O7 (Сr+6) тощо.
Сильними окисниками є також іони або молекули, що містять неметали з позитивним ступенем окиснення (вищим або проміжним), наприклад нітратна кислота HNO3 (N+5), концентрована сульфатна кислота H2SO4 (S+6), бертолетова сіль КСlO3 (Сl+5) тощо.
Найпоширеніші окисники, які часто використовують у техніці або в лабораторіях:
1.Кисень (O2) використовують у багатьох хімічних виробництвах. Ще більш сильним окисником є інша алотропна модифікація Оксигену — озон. У реакціях атоми Оксигену приймають два електрони, утворюючи найчастіше частинку О-2 або, рідше, О22-:
2. Нітратна кислотаHNO3 є одним з найсильніших окисників. Вона окислює багато металів, а в суміші з хлоридною кислотою (царська горілка) здатна окислювати навіть малоактивні метали, наприклад золото. У реакціях може відновлюватися до нітроген діоксиду NO2, нітроген монооксиду NO, азоту N2,амоніаку NH3.
3. Концентрована сульфатна кислотаH2SO4 належить до числа досить сильних окисників, особливо при нагріванні. Проявляючи окисні властивості, сульфатна кислота найчастіше відновлюється до сульфур діоксиду


