ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 56
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, мозковим шаром бруньок і гіпофізом. Введені в організм тварин і людини броміди підсилюють концентрацію процесів гальмування в корі головного мозку, сприяють нормалізації стану нервової системи, що постраждала від перенапруги гальмівного процесу. Одночасно, затримуючись у щитовидній залозі, бром вступає в конкурентні відносини з йодом, що впливає на діяльність залози, а у зв'язку із цим - і на стан обміну речовин.
20.
Підгрупа Оксигену, загальна характеристика. Властивості кисню, алотропні модифікації. Отримання.
Загальна характеристика підгрупи оксигену
До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній — радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву — халькогени, що означає “ті, що утворюють руди”.
Таблиця 9.1. Властивості елементів підгрупи оксигену
Оксиген і його властивості
Поширення в природі. Оксиген — найпоширеніший на Землі елемент. Він становить 47,2 % маси земної кори. Його вміст у повітрі становить 20,95 % за об’ємом або 23,15 % — за масою. Оксиген входить до складу води, гірських порід, багатьох мінералів і солей, міститься у білках, жирах і вуглеводах, з яких складаються живі організми.
Добування.
У лабораторних умовах кисень добувають електролізом водного розчину гідроксиду натрію (електроди нікелеві) або розкладом при нагріванні бертолетової солі (хлорату(V) калію) чи перманганату калію. Розклад хлорату калію значно прискорюється за наявності оксиду мангану(ІV) МnО2:
2КСlO2 = 2КСl + 3O2 ↑.
Дуже чистий кисень утворюється при розкладі перманганату калію:
2КМnO4 = К2МnО4 + МnО2 + O2 ↑ .
У промисловості кисень добувають із рідкого повітря, а також при добуванні водню електролізом води. Кисень зберігають і перевозять у стальних балонах під тиском до 15 МПа (мегапаскаль).
Фізичні властивості.
Кисень — газ без кольору, смаку і запаху, трохи важчий за повітря. У воді розчиняється мало (в 1 л води при 20 °С розчиняється 31 мл кисню). При температурі —183°С і тиску 101,325 кПа кисень переходить у рідкий стан. Рідкий кисень має блакитний колір, втягується в магнітне поле. Природний оксиген містить три ізотопи: 168O (99,76 %), 178O (0,04 %) і 188O (0,20 %). Хімічні властивості. До завершення зовнішнього електронного рівня атому оксигену не вистачає двох електронів. Енергійно приєднуючи їх, атом оксигену виявляє ступінь окиснення —2. Однак у сполуках з флуором (OF2 і O2F2) спільні електронні пари зміщені до флуору, як до більш електроне гативного елемента. У цьому випадку ступені окиснення оксигену відповідно дорівнюють +2 і +1, а флуору —1.
Молекула кисню складається з двох атомів O2. Хімічний зв’язок у ній — ковалентний неполярний.
Молекула озону складається з трьох атомів оксигену О3. Озон — це алотропічна модифікація елемента оксигену. Хоча кисень і озон утворені одним і тим самим елементом, властивості їх різні. Озон— газ із характерним запахом. Руйнує органічні речовини, окиснює багато металів, у тому числі золото і платину; він сильніший окисник, ніж кисень.
Температура киснево-ацетиленового полум’я досягає З 500°С, киснево-водневого — З 000°С.
У медицині кисень застосовується для полегшення дихання хворих (кисневі подушки і палатки). Він використовується в кисневих приладах під час виконання робіт у важкій для дихання атмосфері (підземні й підводні роботи, висотні й космічні польоти тощо).
21.
Оксиди та гідроксиди. їх класифікація. Хімічні властивості.
Оксиди — складні речовини, утворені двома елементами, одним із яких є Оксиген. Їх назва складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини, у називному відмінку.
Класифікація оксидів
1) Оксиди, яким відповідають основи, називаються основними. Вони утворені металами. До них належать CuO,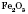 ,
, 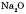 , CaO, BaO,
, CaO, BaO, 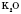 , NiO та інші.
, NiO та інші.
2) Оксиди, яким відповідають кислоти, називаються кислотними. Вони утворені в основному неметалами. Це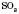 ,
, 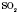 ,
, 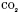 ,
, 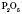 ,
, 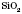 ,
, 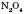 та інші.
та інші.
Поширення оксидів у природі
Оксиди широко поширені в природі. Наприклад, силіцій(IV) оксид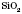
— кремнезем є основною складовою піску, глини, входить до складу багатьох мінералів; — карбон(IV) оксид, вуглекислий газ,— складова частина повітря;
— карбон(IV) оксид, вуглекислий газ,— складова частина повітря; 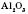 — алюміній оксид входить до складу глини і багатьох гірських порід;
— алюміній оксид входить до складу глини і багатьох гірських порід;  — ферум(ІІІ) оксид міститься в залізних рудах;
— ферум(ІІІ) оксид міститься в залізних рудах; 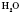 — вода — найпоширеніший на Землі оксид.
— вода — найпоширеніший на Землі оксид.
Вода як найважливіший природний оксид
Фізичні властивості води. Чиста вода прозора, не має запаху і смаку. Найбільша її густина — при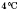 (1 г/см3). Густина льоду менша ніж густина рідкої води, тому лід спливає на її поверхню. Вода замерзає при 0 °С й кипить при
(1 г/см3). Густина льоду менша ніж густина рідкої води, тому лід спливає на її поверхню. Вода замерзає при 0 °С й кипить при 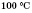 та тиску 101 325 Па (1 атм). Вона погано проводить тепло і дуже погано — електрику. Вода є гарним розчинником.
та тиску 101 325 Па (1 атм). Вона погано проводить тепло і дуже погано — електрику. Вода є гарним розчинником.
Хімічні властивості води.
1) Взаємодія з металами. Метали, що стоять у ряді напруг до Алюмінію включно, реагують із водою за звичайних умов:
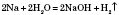
Метали, що стоять у ряді напруг від Мангану до Гідрогену, реагують із водою при нагріванні:
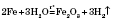
Метали, що стоять у ряді напруг після Гідрогену, з водою не реагують.
2) Вода реагує з оксидами металів, якщо метали, що утворюють оксиди, знаходяться в ряді напруг до Магнію. При цьому утворюються луги, тобто розчинні у воді основи:
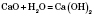 — кальцій гідроксид.
— кальцій гідроксид.
3) Вода реагує з багатьма оксидами неметалів, внаслідок реакції утворюються розчинні кислоти:
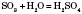 — сульфатна кислота.
— сульфатна кислота.
4) Вода розкладається під дією високої температури або електричного струму:
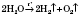 .
.
20.
Підгрупа Оксигену, загальна характеристика. Властивості кисню, алотропні модифікації. Отримання.
Загальна характеристика підгрупи оксигену
До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній — радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву — халькогени, що означає “ті, що утворюють руди”.
Таблиця 9.1. Властивості елементів підгрупи оксигену
| Властивість | O | S | Se | Те | Ро |
| 1. Порядковий номер | 8 | 16 | 34 | 52 | 84 |
| 2. Валентні електрони | 2s22p4 | 3s23p4 | 4s24p4 | 5s25p4 | 6s26p4 |
| 3. Енергія іонізації атома, еВ | 13,62 | 10,36 | 9,75 | 9,01 | 8,43 |
| 4. Відносна електронегативність | 3,50 | 2,60 | 2,48 | 2,01 | 1,76 |
| 5. Ступінь окиснення у сполуках | -1,-2, +2 | -2, +2 +4,+6 | -2, +4,+6 | -2, +4,+6 | -2,+4 |
| 6. Радіус атома, нм | 0,066 | 0,104 | 0,117 | 0,137 | 0,164 |
Оксиген і його властивості
Поширення в природі. Оксиген — найпоширеніший на Землі елемент. Він становить 47,2 % маси земної кори. Його вміст у повітрі становить 20,95 % за об’ємом або 23,15 % — за масою. Оксиген входить до складу води, гірських порід, багатьох мінералів і солей, міститься у білках, жирах і вуглеводах, з яких складаються живі організми.
Добування.
У лабораторних умовах кисень добувають електролізом водного розчину гідроксиду натрію (електроди нікелеві) або розкладом при нагріванні бертолетової солі (хлорату(V) калію) чи перманганату калію. Розклад хлорату калію значно прискорюється за наявності оксиду мангану(ІV) МnО2:
2КСlO2 = 2КСl + 3O2 ↑.
Дуже чистий кисень утворюється при розкладі перманганату калію:
2КМnO4 = К2МnО4 + МnО2 + O2 ↑ .
У промисловості кисень добувають із рідкого повітря, а також при добуванні водню електролізом води. Кисень зберігають і перевозять у стальних балонах під тиском до 15 МПа (мегапаскаль).
Фізичні властивості.
Кисень — газ без кольору, смаку і запаху, трохи важчий за повітря. У воді розчиняється мало (в 1 л води при 20 °С розчиняється 31 мл кисню). При температурі —183°С і тиску 101,325 кПа кисень переходить у рідкий стан. Рідкий кисень має блакитний колір, втягується в магнітне поле. Природний оксиген містить три ізотопи: 168O (99,76 %), 178O (0,04 %) і 188O (0,20 %). Хімічні властивості. До завершення зовнішнього електронного рівня атому оксигену не вистачає двох електронів. Енергійно приєднуючи їх, атом оксигену виявляє ступінь окиснення —2. Однак у сполуках з флуором (OF2 і O2F2) спільні електронні пари зміщені до флуору, як до більш електроне гативного елемента. У цьому випадку ступені окиснення оксигену відповідно дорівнюють +2 і +1, а флуору —1.
Молекула кисню складається з двох атомів O2. Хімічний зв’язок у ній — ковалентний неполярний.
Молекула озону складається з трьох атомів оксигену О3. Озон — це алотропічна модифікація елемента оксигену. Хоча кисень і озон утворені одним і тим самим елементом, властивості їх різні. Озон— газ із характерним запахом. Руйнує органічні речовини, окиснює багато металів, у тому числі золото і платину; він сильніший окисник, ніж кисень.
Температура киснево-ацетиленового полум’я досягає З 500°С, киснево-водневого — З 000°С.
У медицині кисень застосовується для полегшення дихання хворих (кисневі подушки і палатки). Він використовується в кисневих приладах під час виконання робіт у важкій для дихання атмосфері (підземні й підводні роботи, висотні й космічні польоти тощо).
21.
Оксиди та гідроксиди. їх класифікація. Хімічні властивості.
Оксиди — складні речовини, утворені двома елементами, одним із яких є Оксиген. Їх назва складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини, у називному відмінку.
Класифікація оксидів
1) Оксиди, яким відповідають основи, називаються основними. Вони утворені металами. До них належать CuO,
2) Оксиди, яким відповідають кислоти, називаються кислотними. Вони утворені в основному неметалами. Це
Поширення оксидів у природі
Оксиди широко поширені в природі. Наприклад, силіцій(IV) оксид
— кремнезем є основною складовою піску, глини, входить до складу багатьох мінералів;
Вода як найважливіший природний оксид
Фізичні властивості води. Чиста вода прозора, не має запаху і смаку. Найбільша її густина — при
Хімічні властивості води.
1) Взаємодія з металами. Метали, що стоять у ряді напруг до Алюмінію включно, реагують із водою за звичайних умов:
Метали, що стоять у ряді напруг від Мангану до Гідрогену, реагують із водою при нагріванні:
Метали, що стоять у ряді напруг після Гідрогену, з водою не реагують.
2) Вода реагує з оксидами металів, якщо метали, що утворюють оксиди, знаходяться в ряді напруг до Магнію. При цьому утворюються луги, тобто розчинні у воді основи:
3) Вода реагує з багатьма оксидами неметалів, внаслідок реакції утворюються розчинні кислоти:
4) Вода розкладається під дією високої температури або електричного струму:

