ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 41
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.

Сумарне рівняння реакції
У результаті на катоді утворюється залізо (хоча побічним процесом також може бути виділення газуватого водню), на аноді виділяється газуватий кисень, а в розчині залишається сульфатна кислота.
І, нарешті, випадок, коли ні катіон, ні аніон солі не піддається електролізу. Наприклад, калій нітрат (правила 1 та 4):

Сумарне рівняння реакції
У цьому разі ні катіони металу, ні аніон оксигеновмісної кислоти не розряджаються. На катоді виділяється водень, а на аноді — кисень. Фактично електроліз розчину калій нітрату зводиться до електролітичного розкладу води.
Розгляньмо також випадок електролізу купрум(ІІ) хлориду, тільки не з інертними електродами, а з активними. Якщо як електроди взяти мідні пластинки, то в цьому разі на катоді також буде виділятися мідь, а на аноді, де відбуваються процеси окиснення, замість розрядки хлоридіонів і виділення хлору протікає окиснення анода (міді). У цьому разі продукти окиснення анода — іони Сu2+ переходять у розчин, а досягаючи катода, осідають на ньому:
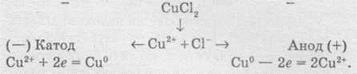
Таким чином, електроліз розчину купрум(ІІ) хлориду з розчинним анодом зводиться до окиснення матеріалу анода (його розчинення) й супроводжується перенесенням металу з анода на катод.
У промисловості цей процес використовують для електрохімічного очищення (рафінування) міді. Один електрод у вигляді тонкого дроту виготовляють із хімічно чистої міді, а другий електрод роблять із болванок чорнової міді, отриманої при виплавці. Після підключення джерела електричного струму чорнова мідь (анод) розчиняється, а чиста мідь осідає на іншому катоді. У підсумку одержують мідь із досить високим ступенем очищення.
9.
Вода в природі. Фізичні властивості, будова молекули води, роль водневого зв’язку. Твердість води та методи її пом’якщення.
Вода́, Н2O — хімічна речовина у вигляді прозорої безбарвної рідини без запаху і смаку, (в нормальних умовах). В природі існує у трьохагрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома Оксигену і двох атомів Гідрогену. Атоми Гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома Оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів Гідрогену (протонів) на атомидейтерію утворюється модифікація, яка називається важкою водою.
Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Земліводою покрито 70,9% поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у виглядіопадів. Вода має велике значення для економіки: сільського господарства й промисловості. Питна вода становить тільки 2,5% від загальної кількості. Нестача води може стати однією з найважчих проблем людства в найближчі десятиллітя.
У Всесвіті
Хімічні елементи, які входять до складу води, Гідроген і Оксиген, належать до найпоширеніших у природі. Утворення води з цих елементів відбувається там, де густина газів достатньо велика і зіткненням між атомами достатньо ймовірне. Вода виявлена в складі міжзоряних газових хмар, що лежать у межах нашої галактики - Чумацького Шляху.
Вода належить до найпоширеніших речовин на Земній кулі[Джерело?]. Водою вкрито близько 2/3 поверхні земної кулі (океани, моря, озера,річки). Значна її кількість у вигляді льоду і снігу вкриває високі гори і величезні простори Арктики і Антарктиди. Багато води в атмосфері —пара, туман і хмари. Значні кількості води містяться і в земній корі у вигляді підземних вод. У природі вода перебуває не тільки у вільному стані, а і в хімічно зв'язаному.
Вода входить до складу багатьох гірських порід і всіх рослинних і тваринних організмів. На воду припадає близько 60% маси тварин і до 80% маси риб. У деяких рослинах вміст води іноді перевищує 90% їхньої маси.
Більшість запасів води на Землі знаходяться в морях і океанах, прісна вода становить 2,5-3% від загального об'єму гідросфери.
Фізичні властивості
Чиста вода — безбарвна прозора рідина, без запаху і смаку. На землі вода існує в трьох агрегатних станах — твердому, рідкому тагазоподібному. За нормального атмосферного тиску при 0°С вона замерзає і перетворюється у лід, а при 100°С — кипить, перетворюючись упару. У газоподібному стані вода існує і за нижчої температури, навіть нижче 0°С. Тому лід і сніг теж поступово випаровуються.
У рідкому стані вода практично не стискається, при замерзанні розширюється на 1/11 від свого об'єму.
Найбільшу густину вода має при +4°С. Масу 1 см³ чистої води при цій температурі прийняли за одиницю і назвали грамом (сучасне визначення грама основане на точнішому еталоні). На відміну від інших рідин, вода при охолодженні від + 4 до 0°С розширюється. Тому лід легший від води (на 8%) і не тоне у ній. Завдяки цьому, а також малій теплопровідності шар льоду захищає глибокі водойми від промерзання до дна, і цим забезпечується у них життя.
Потрійна точка води, тобто умови, за яких одночасно у рівноважному стані можуть співіснувати вода, лід та пара, реалізується при температурі0,01 °C і тиску 611,73 Па. Значення 0,01 °C точне — на ньому основане визначення одиниці вимірювання температури в Міжнародній системі (СІ), кельвіна. Проте відповідно до запропонованих змін у СІ, коли значення сталої Больцмана та числа Авогадро буде зафіксовано, температура потрійної точки води буде визначатися з похибкою.
Вода характеризується великою питомою теплоємністю, що дорівнює за означенням калорії 1 кал/г-град. Завдяки цьому температура океанів і морів змінюється досить повільно, і цим регулюється температура на поверхні земної кори. Цим пояснюється також те, що клімат на островахрівномірніший, ніж на материках.
Фізичні властивості води великою мірою зумовлені тим, що її молекули мають значний дипольний момент (1,844 Дебая). Оскільки атоми Оксигену є більш електронегативними, ніж атоми Гідрогену, вони відтягують на себе електронну густину ковалентних зв'язків у молекулах води. Через це на перших (O) виникає частковий негативний заряд (2δ-), а на других (H) — вдвічі менший за значенням позитивний заряд (δ+). Внаслідок електростатичного притягування між атомами Гідрогену й Оксигену сусідніх молекул води, між ними формується водневий зв'язок[2]. Завдяки такій взаємодії конденсація води відбувається при порівняно високій температурі. Так, наприклад, набагато важчі молекули кисню івуглекислого газу при цих температурах конденсованої фази не утворюють.
У будь-який момент часу в рідкій воді більшість молекул утворюють водневі зв'язки, проте час життя кожного з них дуже короткий (від 1 до 20 пс). Після руйнування одного зв'язку наступний, із тим же або іншим партнером, утворюється приблизно через 0,1 пс. Тимчасові групи молекул води, сполучених між собою водневими зв'язками, називають «кластерами, що мигають». Сила водневих зв'язків досить невелика (енергія розриву 23 кДж/моль), проте вони дуже суттєво впливають на властивості води, через їх велику кількість[2].
Завдяки своїй формі молекули води можуть сполучатись водневими зв'язками із чотирма іншими. Саме таким чином вони організовані у кристалах льоду. Проте в рідкій воді молекули менш впорядковані і перебувають у стані постійного руху, тому середня кількість зв'язків, що утворюються кожною із них, в будь-який момент часу становить 3,6[2].
Роль
Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н.
Водневий зв'язок є прикладом трицентрового чотириелектронного зв'язку.
Прослідковується певна аналогія між водневим та ковалентним зв'язком. Зокрема, водневий зв'язок є направленим та насичуваним, що вказує на його резонансну природу (на противагу електростатичній природі йонного зв'язку). Висувається припущення, що йон H+ завдяки своїм унікальним властивостям (він фактично є єдиною частинкою — протоном) виступає аналогом електронної пари в класичному ковалентному зв'язку, тільки з протилежним знаком.
За величиною енергії він на порядок слабший за ковалентний зв'язок. Наприклад, у рідкій воді енергія розриву водневого зв'язку становить 23 кДж/моль, для порівняння енергія розриву ковалентного O—H зв'язку — 470 кДж/моль[1].
Розрізняють міжмолекулярний та внутрішньомолекулярний водневий зв'язок.
Водневий зв'язок є важливим для органічної хімії. Завдяки водневому зв'язку вода (головний розчинник у неорганічній хімії та біохімії) має високу температуру плавлення і кипіння. Водневий зв'язок з'єднує подвійну спіраль ДНК (носія генетичної інформації), а також відповідає за формування вторинної і третинної структури білків.
Із встановленням наявності водневого зв'язку в структурі речовини пов'язані певні труднощі, оскільки атом водню важко локалізувати за допомогою стандартного рентгеноструктурного аналізу через його надзвичайно малу відносну масу. Існує кілька критеріїв встановлення водневого зв'язку:


