ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 56
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
основному за першим ступенем
18.
Комплексні сполуки: типи, номенклатура.
Комплекси можуть існувати в розчині, кристалі, а інколи і в газовому стані, наприклад [Аl2Сl6]. Заряд комплекса визначають алгебричною сумою зарядів його складових частин. При цьому ступінь окиснення центрального атома приймають за заряд іона. Для лігандів – нейтральних молекул – заряд прирівнюють до нуля, а для аніонних лігандів беруть такий же заряд, як і у відповідного аніона. Комплекс матиме характер катіона або аніона, якщо сумарний заряд координованих груп не дорівнює заряду центрального іона. У цьому разі координаційна сполука має зовнішню сферу, або позасферні іони.
Отже, комплексними, або координаційними називають сполуки, кристалічні ґратки яких складаються з поліатомних угруповань (комплексів), здатних існувати самостійно.
– У молекулі будь-якої комплексної сполуки один з іонів, найчастіше позитивно заряджений, займає центральне місце і називається комплексо-утворювачем, або центральним іоном.
– Атоми, молекули або іони, розташовані безпосередньо навколо комплексоутворювача і зв'язані з ним за рахунок додаткової валентності, називаються лігандами.
– Ліганди разом з комплексоутворювачем складають внутрішню сферу комплексу, або внутрішню координаційну сферу, яку при написанні формули координаційної сполуки пишуть у квадратних дужках.
– Іони, або нейтральні частини комплексу, що не є лигандами чи комплексоутворювачем і не увійшли у внутрішню координаційну сферу, складають зовнішню сферу комплексів.
НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК
Назви комплексних сполук будують за тими ж принципами, що й назви простих, з урахуванням їхньої хімічної природи. Спочатку називають комплексний катіон (або простий катіон) у називному відмінку, потім – простий аніон (або комплексний аніон). Якщо сполука неелектролітного типу, то її називають одним словом.
Називаючи комплексні іони, насамперед вказують ліганди (L) – аніонні, нейтральні та катіонні, а потім центральний атом (М), не розділяючи їх. Формули комплексів записують у зворотному порядку [М(L+)(L0)(L–)].
Назви лігандів одержують сполучну голосну – о, наприклад: Н– – гідридо-, F– – фторо-, О2– – оксо-, О22– – пероксо-, S2– – тіо-, ОН– – гідроксо-, СN– – ціано-, NСО– – ціанато-, SСN– – тіоціанато-, NСS– – ізотіоціанато-, NО2– – нітро-, ОNО– – нітрито-, NН2– – амідо-, NН2– – імідо-, С2О42– – оксалато-, NН2(СН2)2NН2 – етилендіамін-, Н2О – аква-, NН3 – амін-, СО – карбоніл-,
NО – нітрозил-, Н+ – гідрогено-, Н3О+ – оксоно-, NН4+ – амоно-, N2Н5+ – гідразино-.
Перед лігандами зі складними назвами, які уже містять числівники, для позначення числа лігандів використовують помножуючі префікси біс-, трис-, тетракіс- і т. ін. Назви таких лігандів звичайно беруть у дужки. Якщо ліганд є містком між двома центрами координації, перед його назвою ставлять грецьку літеру μ (мю) через дефіс. Місткові ліганди називають останніми. Щоб уникнути двозначності, складні групи атомів у молекулі відокремлюють різною формою дужок у такому порядку: [{( )}].
19.
Галогени, властивості,сполуки,застосування,отримання.
ЙОД
ЙОД - І хімічний елемент VII групи періодичної системи Менделєєва, належить до галогенів (у літературі зустрічається також символ J); атомний номер 53, атомна маса 126,9045; кристали чорно-сірого кольору з металевим блиском. Природний йод складається з одного стабільного ізотопу з масовим числом 127. Йод відкрив в 1811 р. французький хімік Б. Куртуа. Нагріваючи матковий розсіл золи морських водоростей з концентрованою сірчаною кислотою, він спостерігав виділення фіолетової пари (звідси назва йод - від грецького iodes, ioeides - схожий кольором на фіалку, фіолетовий), що конденсувався у вигляді темних блискучих пластинчастих кристалів. В 1813 – 1814 рр. французький хімік Ж. Л. Гей-Люссак й англійський хімік Г. Дэві довели елементарну природу йоду.
ХЛОР
ХЛОР (Cl) - хімічний елемент VII групи періодичної системи Менделєєва, атомний номер 17, атомна маса 35,453; відноситься до галогенів. При нормальних умовах жовто-зелений газ із різким дратівним заходом. Природний хлор складається із двох стабільних ізотопів: 35Cl (75,77%) і 37Cl (24,23%).
Xлор отриманий уперше в 1774 р. Шееле взаємодією соляної кислоти з піролюзитом Мn2. Однак, тільки в 1810 М. Дэві встановив, що хлор - елемент і назвав його chlorine (від грецького chloros - жовто-зелений). В 1813 Ж.Л. Гей-Люссак запропонував для цього елемента назву хлор.
Xлор зустрічається в природі тільки у вигляді сполук.
З киснем хлор утворить оксиди: Cl2O, Cl2, Cl2O6, Cl2O7, Cl2O8, а також гіпохлорити, хлорити, хлорати й перхлорати. Всі кисневі з'єднання хлору утворять вибухонебезпечні суміші з легкоокисними речовинами. Окисиди хлору малостійкі й можуть мимовільно вибухати, гіпохлорити при зберіганні повільно розкладаються, хлорати й перхлорати можуть вибухати під впливом ініціаторів.
ФТОР
ФТОР (F) - хімічний елемент VII групи періодичної системи Менделєєва, відноситься до галогенів, атомний номер 9, атомна маса 18,998403; при нормальних умовах (0 С; 0,1 Мн/м
2, або 1 кгс/см2) - газ блідо-жовтого цвіту з різким заходом.
БРОМ (Br) - хімічний елемент VII групи періодичної системи Менделєєва, відноситься до галогенів, атомний номер 35, атомна маса 79,904; червоно-бура рідина із сильним неприємним заходом. Бром відкритий в 1826 французьким хіміком А. Ж. Баларом при вивченні розсолів соляних промислів; названий від грецького bromos — сморід. Природний бром складається з 2 стабільних ізотопів 79Br (50,34%) і 81Br (49,46%). Зі штучно отриманих радіоактивних ізотопів брому найцікавіший 80Вr, на прикладі якого И. В. Курчатовим відкрите явище ізомерії атомних ядер.
Зміст брому в земній корі (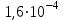 % по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях.
% по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях.
2. Застосування галогенів та їх найважливіших сполук
ЙОД
Сировиною для промислового одержання йоду служать нафтові бурові води, морські водорості, а також маткові розчини чилійської (натрієвої) селітри, що містять до 0,4% йоду у вигляді йодату натрію.
Йод і його з'єднання застосовують головним чином у медицині й в аналітичній хімії, а також в органічному синтезі й фотографії. У промисловості застосування йоду поки незначно по обсягу, але досить перспективно. Так, на термічному розкладанні йодидів засноване одержання високоочисних металів.
ХЛОР
Однією з важливих галузей хімічної промисловості є хлорна промисловість. Основні кількості хлору переробляються на місці його виробництва.
Xлор - один з біогенних елементів, постійний компонент тканин рослин і тварин. Вміст хлору в рослинах (багато хлору в галофітах) - від тисячних часток відсотка до цілих відсотків, у тварин - десяті й соті частки відсотка. Добова потреба дорослої людини в хлорі, (2 - 4 г) покривається за рахунок харчових продуктів. З їжею хлор надходить звичайно в надлишку у вигляді хлориду натрію й хлориду калію. Особливо багаті хлором хліб, м'ясні й молочні продукти. В організмі тварин хлор - основна осмотично-активна речовина плазми крові, лімфи, спинномозкової рідини й деяких тканин. Відіграє роль у водно-сольовому обміні, сприяючи втриманню тканинами води. Регуляція кислотно-лужної рівноваги в тканинах здійснюється поряд з іншими процесами шляхом зміни в розподілі хлору між кров'ю й іншими тканинами, хлор бере участь в енергетичному обміні в рослин. Xлор позитивно впливає на поглинання коріннями кисню. Xлор необхідний для утворення кисню в процесі фотосинтезу ізольованими хлоропластами. До складу більшості живильних для середовищ штучного культивування рослин хлор не входить. Можливо, для розвитку рослин достатньо досить малі концентрації хлору.
Джерелом для виробництва фтору служить фтористий водень, що виходить в основному або при дії сірчаної кислоти H2SO4 на флюорит Ca2, або при переробці апатитів і фосфоритів.
Широке застосування одержали численні з'єднання фтору - фтористий водень, алюмінію фторис), кремне-фториди, фторсульфована кислота (розчинник, каталізатор, реагент для одержання органічних сполук, що містять групу - SO2F), ВF3 (каталізатор), фторорганічні з'єднання й ін.
Біологічна роль фтору вивчена недостатньо. Установлено зв'язок обміну фтору з утворенням кісткової тканини кістяка й особливо зубів. Необхідність фтору для рослин не доведена.
Препарати, що містять фтор, застосовують у медичній практиці в якості захисту від пухлин (5-фторурацил, фторафур, фтор-бензотеф), нейроліптичних (трифлу-перидол, або триседил, фторфеназин, трифтазин й ін.), антидепресивних (фторацизин), наркотичних (фторотан) і інших засобів.
БРОМ
Вихідною сировиною для одержання брому служать морська вода, озерні й підземні розсоли, що містять бром у вигляді броміду-іону Вг-.
Бром застосовують досить широко. Він - вихідний продукт для одержання ряду бромистих солей й органічних похідних. Більші кількості брому витрачають для одержання бромистого етилу й діброметану - складових частин етилової рідини, що додає до бензинів для підвищення їхньої детонаційної стійкості. З'єднання брому застосовують у фотографії, при виробництві ряду барвників, бромистий мітив і деякі інші з'єднання брому - як інсектициди. Деякі органічні сполуки брому служать ефективними протипожежними засобами. Бром і бромну воду використають при хімічних аналізах для визначення багатьох речовин. У медицині використовують броміди натрію, калію, амонію, а також органічні з'єднання брому, які застосовують при неврозах, істерії, підвищеній дратівливості, безсонні, гіпертонічній хворобі, епілепсії й хореї.
Бром - постійна складова частина тканин тварин і рослин. Наземні рослини містять у середньому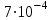 % брому на сиру речовину, тварини
% брому на сиру речовину, тварини  %. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою
%. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою
18.
Комплексні сполуки: типи, номенклатура.
Комплекси можуть існувати в розчині, кристалі, а інколи і в газовому стані, наприклад [Аl2Сl6]. Заряд комплекса визначають алгебричною сумою зарядів його складових частин. При цьому ступінь окиснення центрального атома приймають за заряд іона. Для лігандів – нейтральних молекул – заряд прирівнюють до нуля, а для аніонних лігандів беруть такий же заряд, як і у відповідного аніона. Комплекс матиме характер катіона або аніона, якщо сумарний заряд координованих груп не дорівнює заряду центрального іона. У цьому разі координаційна сполука має зовнішню сферу, або позасферні іони.
Отже, комплексними, або координаційними називають сполуки, кристалічні ґратки яких складаються з поліатомних угруповань (комплексів), здатних існувати самостійно.
– У молекулі будь-якої комплексної сполуки один з іонів, найчастіше позитивно заряджений, займає центральне місце і називається комплексо-утворювачем, або центральним іоном.
– Атоми, молекули або іони, розташовані безпосередньо навколо комплексоутворювача і зв'язані з ним за рахунок додаткової валентності, називаються лігандами.
– Ліганди разом з комплексоутворювачем складають внутрішню сферу комплексу, або внутрішню координаційну сферу, яку при написанні формули координаційної сполуки пишуть у квадратних дужках.
– Іони, або нейтральні частини комплексу, що не є лигандами чи комплексоутворювачем і не увійшли у внутрішню координаційну сферу, складають зовнішню сферу комплексів.
НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК
Назви комплексних сполук будують за тими ж принципами, що й назви простих, з урахуванням їхньої хімічної природи. Спочатку називають комплексний катіон (або простий катіон) у називному відмінку, потім – простий аніон (або комплексний аніон). Якщо сполука неелектролітного типу, то її називають одним словом.
Називаючи комплексні іони, насамперед вказують ліганди (L) – аніонні, нейтральні та катіонні, а потім центральний атом (М), не розділяючи їх. Формули комплексів записують у зворотному порядку [М(L+)(L0)(L–)].
Назви лігандів одержують сполучну голосну – о, наприклад: Н– – гідридо-, F– – фторо-, О2– – оксо-, О22– – пероксо-, S2– – тіо-, ОН– – гідроксо-, СN– – ціано-, NСО– – ціанато-, SСN– – тіоціанато-, NСS– – ізотіоціанато-, NО2– – нітро-, ОNО– – нітрито-, NН2– – амідо-, NН2– – імідо-, С2О42– – оксалато-, NН2(СН2)2NН2 – етилендіамін-, Н2О – аква-, NН3 – амін-, СО – карбоніл-,
NО – нітрозил-, Н+ – гідрогено-, Н3О+ – оксоно-, NН4+ – амоно-, N2Н5+ – гідразино-.
Перед лігандами зі складними назвами, які уже містять числівники, для позначення числа лігандів використовують помножуючі префікси біс-, трис-, тетракіс- і т. ін. Назви таких лігандів звичайно беруть у дужки. Якщо ліганд є містком між двома центрами координації, перед його назвою ставлять грецьку літеру μ (мю) через дефіс. Місткові ліганди називають останніми. Щоб уникнути двозначності, складні групи атомів у молекулі відокремлюють різною формою дужок у такому порядку: [{( )}].
19.
Галогени, властивості,сполуки,застосування,отримання.
ЙОД
ЙОД - І хімічний елемент VII групи періодичної системи Менделєєва, належить до галогенів (у літературі зустрічається також символ J); атомний номер 53, атомна маса 126,9045; кристали чорно-сірого кольору з металевим блиском. Природний йод складається з одного стабільного ізотопу з масовим числом 127. Йод відкрив в 1811 р. французький хімік Б. Куртуа. Нагріваючи матковий розсіл золи морських водоростей з концентрованою сірчаною кислотою, він спостерігав виділення фіолетової пари (звідси назва йод - від грецького iodes, ioeides - схожий кольором на фіалку, фіолетовий), що конденсувався у вигляді темних блискучих пластинчастих кристалів. В 1813 – 1814 рр. французький хімік Ж. Л. Гей-Люссак й англійський хімік Г. Дэві довели елементарну природу йоду.
ХЛОР
ХЛОР (Cl) - хімічний елемент VII групи періодичної системи Менделєєва, атомний номер 17, атомна маса 35,453; відноситься до галогенів. При нормальних умовах жовто-зелений газ із різким дратівним заходом. Природний хлор складається із двох стабільних ізотопів: 35Cl (75,77%) і 37Cl (24,23%).
Xлор отриманий уперше в 1774 р. Шееле взаємодією соляної кислоти з піролюзитом Мn2. Однак, тільки в 1810 М. Дэві встановив, що хлор - елемент і назвав його chlorine (від грецького chloros - жовто-зелений). В 1813 Ж.Л. Гей-Люссак запропонував для цього елемента назву хлор.
Xлор зустрічається в природі тільки у вигляді сполук.
З киснем хлор утворить оксиди: Cl2O, Cl2, Cl2O6, Cl2O7, Cl2O8, а також гіпохлорити, хлорити, хлорати й перхлорати. Всі кисневі з'єднання хлору утворять вибухонебезпечні суміші з легкоокисними речовинами. Окисиди хлору малостійкі й можуть мимовільно вибухати, гіпохлорити при зберіганні повільно розкладаються, хлорати й перхлорати можуть вибухати під впливом ініціаторів.
ФТОР
ФТОР (F) - хімічний елемент VII групи періодичної системи Менделєєва, відноситься до галогенів, атомний номер 9, атомна маса 18,998403; при нормальних умовах (0 С; 0,1 Мн/м
2, або 1 кгс/см2) - газ блідо-жовтого цвіту з різким заходом.
БРОМ
БРОМ (Br) - хімічний елемент VII групи періодичної системи Менделєєва, відноситься до галогенів, атомний номер 35, атомна маса 79,904; червоно-бура рідина із сильним неприємним заходом. Бром відкритий в 1826 французьким хіміком А. Ж. Баларом при вивченні розсолів соляних промислів; названий від грецького bromos — сморід. Природний бром складається з 2 стабільних ізотопів 79Br (50,34%) і 81Br (49,46%). Зі штучно отриманих радіоактивних ізотопів брому найцікавіший 80Вr, на прикладі якого И. В. Курчатовим відкрите явище ізомерії атомних ядер.
Зміст брому в земній корі (
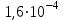 % по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях.
% по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях.2. Застосування галогенів та їх найважливіших сполук
ЙОД
Сировиною для промислового одержання йоду служать нафтові бурові води, морські водорості, а також маткові розчини чилійської (натрієвої) селітри, що містять до 0,4% йоду у вигляді йодату натрію.
Йод і його з'єднання застосовують головним чином у медицині й в аналітичній хімії, а також в органічному синтезі й фотографії. У промисловості застосування йоду поки незначно по обсягу, але досить перспективно. Так, на термічному розкладанні йодидів засноване одержання високоочисних металів.
ХЛОР
Однією з важливих галузей хімічної промисловості є хлорна промисловість. Основні кількості хлору переробляються на місці його виробництва.
Xлор - один з біогенних елементів, постійний компонент тканин рослин і тварин. Вміст хлору в рослинах (багато хлору в галофітах) - від тисячних часток відсотка до цілих відсотків, у тварин - десяті й соті частки відсотка. Добова потреба дорослої людини в хлорі, (2 - 4 г) покривається за рахунок харчових продуктів. З їжею хлор надходить звичайно в надлишку у вигляді хлориду натрію й хлориду калію. Особливо багаті хлором хліб, м'ясні й молочні продукти. В організмі тварин хлор - основна осмотично-активна речовина плазми крові, лімфи, спинномозкової рідини й деяких тканин. Відіграє роль у водно-сольовому обміні, сприяючи втриманню тканинами води. Регуляція кислотно-лужної рівноваги в тканинах здійснюється поряд з іншими процесами шляхом зміни в розподілі хлору між кров'ю й іншими тканинами, хлор бере участь в енергетичному обміні в рослин. Xлор позитивно впливає на поглинання коріннями кисню. Xлор необхідний для утворення кисню в процесі фотосинтезу ізольованими хлоропластами. До складу більшості живильних для середовищ штучного культивування рослин хлор не входить. Можливо, для розвитку рослин достатньо досить малі концентрації хлору.
ФТОР
Джерелом для виробництва фтору служить фтористий водень, що виходить в основному або при дії сірчаної кислоти H2SO4 на флюорит Ca2, або при переробці апатитів і фосфоритів.
Широке застосування одержали численні з'єднання фтору - фтористий водень, алюмінію фторис), кремне-фториди, фторсульфована кислота (розчинник, каталізатор, реагент для одержання органічних сполук, що містять групу - SO2F), ВF3 (каталізатор), фторорганічні з'єднання й ін.
Біологічна роль фтору вивчена недостатньо. Установлено зв'язок обміну фтору з утворенням кісткової тканини кістяка й особливо зубів. Необхідність фтору для рослин не доведена.
Препарати, що містять фтор, застосовують у медичній практиці в якості захисту від пухлин (5-фторурацил, фторафур, фтор-бензотеф), нейроліптичних (трифлу-перидол, або триседил, фторфеназин, трифтазин й ін.), антидепресивних (фторацизин), наркотичних (фторотан) і інших засобів.
БРОМ
Вихідною сировиною для одержання брому служать морська вода, озерні й підземні розсоли, що містять бром у вигляді броміду-іону Вг-.
Бром застосовують досить широко. Він - вихідний продукт для одержання ряду бромистих солей й органічних похідних. Більші кількості брому витрачають для одержання бромистого етилу й діброметану - складових частин етилової рідини, що додає до бензинів для підвищення їхньої детонаційної стійкості. З'єднання брому застосовують у фотографії, при виробництві ряду барвників, бромистий мітив і деякі інші з'єднання брому - як інсектициди. Деякі органічні сполуки брому служать ефективними протипожежними засобами. Бром і бромну воду використають при хімічних аналізах для визначення багатьох речовин. У медицині використовують броміди натрію, калію, амонію, а також органічні з'єднання брому, які застосовують при неврозах, істерії, підвищеній дратівливості, безсонні, гіпертонічній хворобі, епілепсії й хореї.
Бром - постійна складова частина тканин тварин і рослин. Наземні рослини містять у середньому
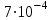 % брому на сиру речовину, тварини
% брому на сиру речовину, тварини  %. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою
%. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою

