ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 49
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Ответы на экзаменационные вопросы.
| № 1. Современная формулировка периодического закона заключается в том, что в свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от зарядов атомных ядер. Именно заряд ядра определяет электронное строение и все вытекающие из этого свойства атома. Все химические элементы делят на 4 электронных семейства: s-,р-,d- и f-элементы. s-элементы располагаются в начале каждого периода, их по 2 в каждом периоде. Это объясняется тем, что на s-орбитале может расположиться всего 2 электрона. Для s-элементов возможны следующие степени окисления: +1 (для элементов первой группы главной подгруппы) и +2 (для элементов второй группы главной подгруппы), для водорода - +1 и -1. Главные подгруппы III, IV, V, VI и VII групп составляют р-элементы. На внешнем энергетическом уровне этих элементов находится от 3-х до 7-ми электронов. Так как в периодах с увеличением зарядов ядер атомов растет число электронов на внешнем уровне от 1-го до 7-ми, то растет и высшая степень окисления элементов в соединениях от +1 до +7. К s- и р-элементам относятся инертные элементы (элементы VIII группы главной подгруппы), но у этих элементов внешние слои завершены, и они не вступают в химические реакции и соединений не образуют. Окислительные свойства элементов в периодах усиливаются, а восстановительные – ослабевают. Это связано с увеличением числа валентных электронов и уменьшением атомного радиуса. В подгруппах с увеличением порядкового номера элемента увеличиваются атомные радиусы, поэтому окислительные свойства ослабевают, а восстановительные – усиливаются. | |||||||||
| № 2. Формулы высших оксидов элементов III периода: Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 оксид оксид оксид оксид оксид оксид оксид натрия магния алюминия кремния фосфора серы хлора (IV) (V) (VI) (VII) Формулы высших гидроксидов NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO5 H2SO4 HClO4 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид идроксид натрия магния алюминия кремния фосфора серы хлора (IV) (V) (VI) (VII) кремниевая фосфорная серная хлорная кислота кислота кислота кислота  кислотный характер оксидов и гидроксидов усиливается основный характер оксидов и гидроксидов ослабевает Это связано с увеличением степени окисления элементов, образующих оксиды и гидроксиды, и уменьшением их радиусов. Схема электронного строения атома Cl в невозбужденном и возбужденном состояниях Cl 1s22s22p63s23p5 Cl 1s22s22p63s23p43d1 Cl 1s22s22p63s23p3 3d2 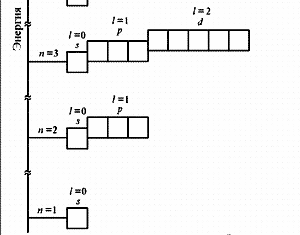   Cl 1s22s22p63s13p3 3d3  Высшая степень окисления хлора +7. Это связано с тем, что на внешнем уровне атома хлора находится 7 электронов: 2 спаренных s-электрона, 4 спаренных р-электрона и один неспаренный р-электрон. Так как в атоме хлора имеется d-подуровень, незаполненный электронами, то существует возможность для распаривания всех спаренных электронов. | |||||||||
| №3. Порядок заполнения электронами атомных орбиталей подчиняется трём основным принципам: Принцип Паули: в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковые. Принцип наименьшей энергии: сначала электронами заполняются те подуровни, которые обладают уменьшим запасом энергии. Согласно этому принципу формирование электронных оболочек атомов происходит в такой последовательности: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s … Правило Хунда: заполнение электронами атомных орбиталей одного подуровня происходит таким образом, Чтобы их суммарное спиновое число было минимальным. Схема электронного строения атома ванадия схема электронного строения атома мышьяка 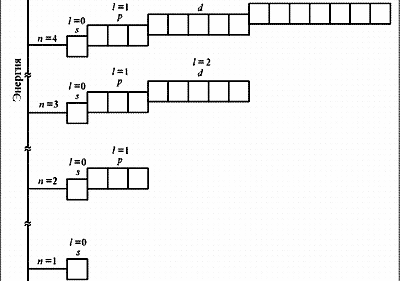  V 1s22s22p63s23p63d3 4s2 As 1s22s22p63s23p63d10 4s24p3 Ванадий – элементы побочной подгруппы Мышьяк – элемент главной подгруппы V группы, d - элемент V группы, p – элемент Наиболее выраженными металлическими свойствами обладает ванадий, он относится к металлам, а мышьяк к неметаллам У обоих атомов есть возможность для перехода в возбужденное состояние. Поэтому они имеют несколько возможных степеней окисления. Они не являются электронными аналогами, но их высшая степень окисления равна +5 (в атоме мышьяка на внешнем уровне 5 валентных электронов, для ванадия валентными являются не только 2 электрона на внешнем уровне, но и добавочные d-электроны предпоследнего третьего уровня.) Другой возможной степенью окисления у обоих элементов может быть +3. В отличие от ванадия, мышьяк может иметь и отрицательную степень окисления в соединениях с металлами. Низшая степень окисления мышьяка -3 (ему не хватает 3 электронов до завершения внешнего слоя). | |||||||||
| № 4. Олово и свинец – элементы IV главной подгруппы ПСХЭ Д.И. Менделеева. На внешнем уровне обоих атомов содержится по 4 электрона: 2 спаренных s-электрона и 2 неспаренных р-электрона. Их возможные степени окисления +2 и +4. Оксиды SnO и PbO –амфотерные оксиды с преобладанием основных свойств, причем, основные свойства PbO выражены сильнее, чем у SnO. Оксиды SnO2 и PbO2 обладают кислотными свойствами, причем кислотные свойства SnO2 выражены сильнее, чем у PbO2. Вывод: с увеличением радиуса атома основные свойства оксидов элементов одной подгруппы усиливаются, а кислотные ослабевают. Основный характер SnO и PbO можно подтвердить уравнениями реакций: SnO + 2HCl = SnCl2 + 2 H2O в сокращенном ионном виде: SnO + 2H+ = Sn 2+ + 2H2O PbO + 2 HCl = PbCl2 + 2 H2O в сокращенном ионном виде: PbO + 2H+ = Pb 2+ + 2H2O PbO2 - сильный окислитель. При растирании PbO2 с серой, последняя воспламеняется: PbO2 + S = PbS + SO2 | |||||||||
| № 5. Энергия ионизации атома – это та энергия, которую необходимо затратить для отрыва электрона от атома. Энергия ионизации обуславливает химические свойства элемента. Её величина характеризует прочность связи электрона с ядром и служит м е р о й м е т а л л и ч н о с т и элемента. Чем меньше значение энергии ионизации, тем активнее металл. Энергия, которая выделяется при присоединении одного электрона к атому, называется сродством к электрону. Наибольшим сродством к электрону обладают галогены (им до завершения внешнего слоя не хватает 1 электрона). Согласно Полингу электроотрицательность (ЭО) – способность атомов присоединять к себе электроны от других атомов или ионов. ЭО зависит от электронного строения атомов: чем меньше атомный радиус атома и чем больше электронов на внешнем уровне, тем более электроотрицательным будет элемент. Самым электроотрицательным элементом является фтор F. H2S, H2Se и H2Te – халькогеноводороды (летучие водородные соединения халькогенов). Все они обладают кислотными свойствами, при растворении в воде они диссоциируют на ионы водорода и анионы кислотных остатков. Например: H2S H+ + HS-. Все эти кислоты слабые и летучие. От сероводорода (H2S) к теллуроводороду (H2Te) кислотный характер усиливается, так как увеличивается радиус атома халькогена и степень диссоциации возрастает. В таком же порядке возрастают и восстановительные свойства. Сульфид-ион S-2 прочнее удерживает электроны, чем теллурид-ион Te-2 (у первого радиус меньше). | |||||||||
| № 6. Электроотрицательность (ЭО) – способность атомов присоединять к себе электроны от других атомов или ионов. ЭО зависит от электронного строения атомов: чем меньше атомный радиус атома и чем больше электронов на внешнем уровне, тем более электроотрицательным будет элемент. Самым электроотрицательным элементом является фтор F. В периодах слева направо ЭО увеличивается, так уменьшается атомный радиус элементов и увеличивается число электронов на внешнем слое. В подгруппах ЭО наоборот уменьшается, так как растут атомные радиусы элементов. Чем больше разница в значениях ЭО, тем полярнее связь между атомами, поэтому самой полярной молекулой среди HCl, HBr и HI является молекула хлороводорода HCl, а наименее полярной – молекула HI. | |||||||||
| № 7. Связь за счет общих электронных пар называется ковалентной связью (КС). Она обладает рядом свойств: длиной, энергией, поляризуемостью, насыщаемостью, направленностью. Направленность КС обуславливает пространственное строение молекул и зависит от типа гибридизации атомных орбиталей. Под насыщаемостью понимают способность атомов образовывать определенное число химических связей, что валентных возможностей атомов. В молекуле метана СН4 все связи атома углерода насыщены до предела: у атома углерода на внешнем уровне 4 электрона. При образовании связи с атомами водорода все 4 электроны атома углерода участвуют в образовании общих электронных пар с атомами водорода. 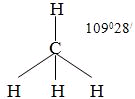 или или 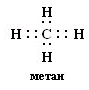 Атом углерода в молекуле метана находится в состоянии sp3-гибридизации. Атом углерода в молекуле метана находится в состоянии sp3-гибридизации. Атом В в молекуле ВF3 находится в состоянии sp2 - гибридизации. 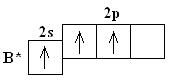 Здесь вместо исходных одной s- и двух р-орбиталей атома бора образуются три равноценные sр2-орбитали. Поэтому молекула ВF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах - атомы фтора. Все три связи В - F в молекуле ВF3 равноценны. Но не все валентные возможности атома бора использованы. Одна р-орбиталь атома бора выкантнаи может быть использована для образования ковалентной связи с другими атомами других молекул по донорно-акцепторному механизму, выступая в качестве акцептора.   | |||||||||
| № 8. Химическая связь, которая возникает за счет общих электронных пар, называется ковалентной. Она обладает рядом свойств: длиной, энергией, поляризуемостью, насыщаемостью, направленностью. Длиной связи называется расстояние между ядрами атомов, соединенных ковалентной связью. Выражается в нм. Энергией связи называется та энергия, которую нужно затратить для разрыва ковалентной связи. Выражается в Дж/моль (кДж/моль). Направленность КС обуславливает пространственное строение молекул и зависит от типа гибридизации атомных орбиталей. Под насыщаемостью понимают способность атомов образовывать определенное число химических связей, что валентных возможностей атомов. Из четырёх фторидов: LiF, ВеF2, ВF3 CF4 больше всего приближается к ковалентной связь между углеродом и фтором в молекуле CF4 фторида углерода. В соединениях LiF, ВеF2 связь ионная. Эти соединения относятся к классу солей. Соли, а также кислоты и щелочи, относятся к электролитам. | |||||||||
| № 9. Смешение электронных облаков и выравнивание их по форме и энергии называется гибридизацией. В результате гибридизации орбиталей происходит изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Существует несколько типов гибридизации электронных облаков. sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109028'.
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (метана CH4, аммиака NH3). sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 1200.
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется - связь. Три sp2- орбитали могут образовывать три - связи (BF3, AlCl3). Еще одна связь ( - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4). Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию. sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 1800.
Две sp- орбитали могут образовывать две - связи (BeH2, ZnCl2). Еще две - связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2). Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию. 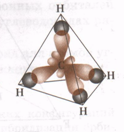  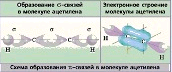 | |||||||||
| № 10. Ковалентная связь может быть образована несколькими механизмами: обменным, донорно-акцепторным и дативным. В каждом случае образуются общие электронные пары между атомами. Донорно-акцепторный механизм заключается в том, что при образовании общей электронной пары один элемент отдаёт в общее пользование свою неподелённую электронную пару (донор), другой элемент предоставляет свободную атомную орбиталь для размещения этой электронной пары (акцептор). По донорно-акцепторному механизму образованы ион аммония NH4+, ион гидроксония Н3О+, многие комплексные соединения. В соединении Zn(NH3)4Cl2 (хлорид тетрааммин цинка) центральным ионом является ион цинка Zn+2, лигандами – полярные молекулы аммиака NH3. Связь между ионом цинка и лигандами образуется по донорно-акцепторному механизму: у иона цинка свободны атомные орбитали внешнего 4 уровня (акцептор), в молекуле аммиака у атома азота в наличии неподелённая электронная пара, и он выступает в качестве донора.  NH3 NH3 Zn +2 NH3 NH3 Cl2 Все комплексные соли при растворении в воде диссоциируют на внутреннюю и внешнюю сферы: Zn(NH3)4Cl2 Zn(NH3)4+2 + 2Cl- | |||||||||
| № 11. В молекулах азота N2 и аммиака NH3 связь образуется за счет общих электронных пар, т.е. является ковалентной. В молекуле азота N2 связь ковалентная неполярная, так как образована атомами одного химического элемента с одинаковыми значениями электроотрицательности, а в молекуле аммиака NH3 связь ковалентная полярная, общие электронные пары смещены в сторону более электроотрицательно атома азота. Схема образования молекула азота :N· + ·N: ® :N:::N: Схема образования молекулы аммиака :N· + 3 H· 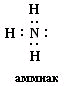
| |||||||||
| № 12. Упорядоченное расположение частиц в кристаллах называется кристаллической решеткой. Существует 4 типа кристаллических решеток: атомные, молекулярные, ионные и металлические. Если в узлах кристаллических решеток находятся атомы, то образуется атомная решетка. В таких решетках кристаллизуются алмаз, графит, кремнезем SiO2. Эти вещества очень прочные, нелетучие и тугоплавкие. Вещества, которые кристаллизуются в молекулярных решетках, наоборот, обладают легкоплавкостью и (или) летучестью. В молекулярных решетках кристаллизуются все газы (водород, кислород, углекислый газ), жидкости (вода) и твердые легкоплавкие вещества (сахар, парафин). В ионных решетках кристаллизуются вещества с ионной связью – соли, основания, основные оксиды. Прочность таких кристаллических решеток зависит от зарядов ионов и их радиусов: чем больше заряд иона, и чем меньше его радиус, тем прочнее ионная связь , а значит и кристаллическая решетка. В металлических решетках кристаллизуются все металлы. Особенность таких решеток в том, что в узл ах находятся не только атомы металлов, но в большинстве положительно-заряженные ионы металлов. Между узлами решетки свободно перемещаются валентные электроны всех атомов. Этим объясняются все общие физические свойства металлов: металлический блеск, тепло- и электропроводность, пластичность, ковкость. 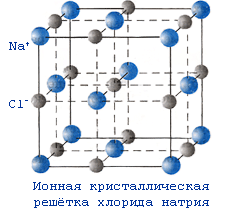  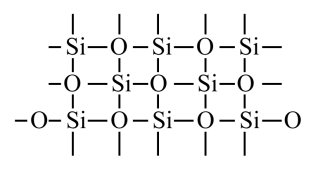  Кристаллическая решетка SiO2 | |||||||||
| № 13. Химическая связь между разноименно заряженными ионами за счет электростатического притяжения называется ионной. Ионы – заряженные частицы, которые образуются из атомов в результате отдачи или присоединения электронов. Атомы металлов при образовании ионной связи превращаются в положительно заряженные ионы ( отдают валентные электроны) - катионы, а атомы неметаллов присоединяют электроны и превращаются в отрицательно заряженные ионы (анионы). 1ē 2 ē Nao + Clo ® Na+ + Cl- ® Na+Cl- Mg0 + O0 Mg+2 O -2 Свойства ионной связи – длина и энергия. Длиной связи называется расстояние между ядрами ионов, соединенных ионной связью. Длина ионной связи определяется радиусами ионов. Измеряется в нм. Энергией связи называется та энергия, которую нужно затратить для разрыва ионной. Выражается в Дж/моль (кДж/моль). Ионной связь не обладает направленностью и насыщаемостью. Эти свойства присущи только ковалентной связи. Среди указанных фторидов NaF, CF4, SiF4,BF3 ионных характер в большей степени выражен во фториде натрия NaF. В этом случае мы видим самую большую разницу в значениях электроотрицательности элементов – у фтора ЭО равна 4,1, а у натрия 1,01. Во всех остальных случаях образуется ковалентная связь (разница в значениях ЭО меньше 1,7). | |||||||||
| № 14. Валентность – это свойство атомов образовывать определенное число химических связей. Зависит от числа неспаренных электронов, наличия неподеленных электронных пар и наличием свободных атомных орбиталей. Степень окисления – условный заряд, вычисленный из предположения, что молекула состоит из ионов. В соединениях СН4 (метан), С2Н6 (этан), С2Н4 (этилен) валентность углерода равна IV, а степень окисления разная – в метане -4, в этане -3, в этилене -2. Валентность и степень окисления водорода соответственно равны I и +1. В молекулах метана и этана образуются одинарные -связи. В молекуле этилена между атомами углерода возникает двойная связь: одна из которых (сигма), а другая (пи). 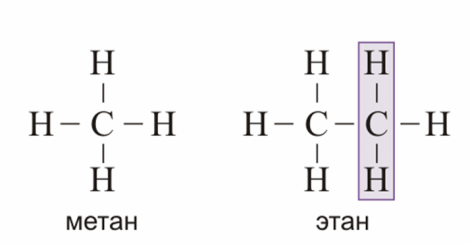 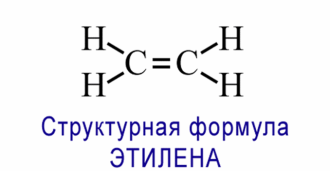  строение молекулы метана строение молекулы метана 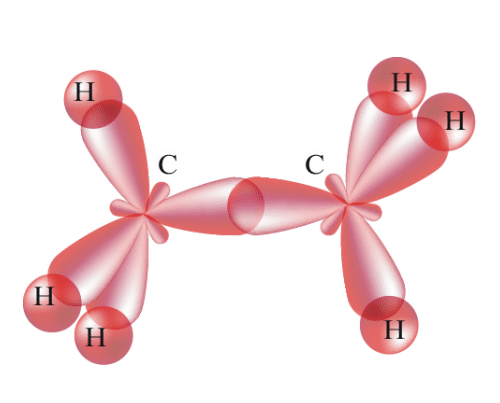 схема образования -связи в молекуле этана схема образования -связи в молекуле этана  | |||||||||
| № 15. Метод валентных связей, или локализованных пар электронов, достаточно хорошо объясняет образование и структуру очень многих молекул. Метод валентных схем (В.с.м.),является методом приближенного решения электронного уравнения Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами. Эти представления являются обобщением на многоатомные молекулы приближения Гайтлера - Лондона, позволившего впервые с помощью квантовомеханич-еских методов объяснить хим. связь в молекуле Н2. Основная физическая идея В. с. м. состоит в том, что волновая функция молекулы выражается через волновые функции составляющих ее атомов. Образование хим. связи рассматривается как результат спаривания спинов свободных электронов атомов. Тем самым В. с. м. дает обоснование одному из основных положений теории валентности: валентность нейтрального атома равна числу свободных электронов в его валентной оболочке. Каждому валентному штриху, соединяющему атомы А и В в структурной формуле молекулы, отвечает двухэлектронная функция валентной связи ХАВ(1,2), которая представляется в виде произведения двух волновых функций: пространственной Ф(1,2), симметричной относительно перестановки координат электронов, и спиновой Энергия молекулы где ЕH-энергия атома Н, Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. В молекуле CH4 имеется 4 связи C—H. Атомы углерода находятся в состоянии sp3- гибридизации. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра: 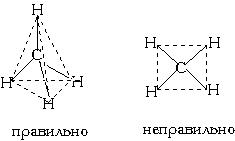 В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’. Однако, этот метод не является универсальным. Этому методу часто предпочитают более простые по своей структуре молекулярных орбиталей методы. В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’. Однако, этот метод не является универсальным. Этому методу часто предпочитают более простые по своей структуре молекулярных орбиталей методы. | |||||||||
| № 16. Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Натрий металлический кристаллизуется в металлической решетки. В узлах находятся в основном положительно заряженные ионы натрия Na+ . Между узлами свободно перемещаются валентные электроны всех атомов. Этим объясняются все общие физические свойства металлов: металлический блеск, тепло- и электропроводность, пластичность, ковкость. 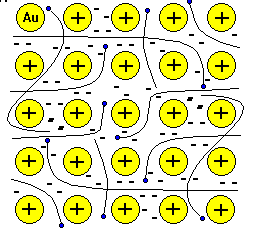 К  ристаллическая решетка хлорида натрия (поваренной соли) ионная. В узлах кристаллической решетки хлорида натрия находятся положительно заряженные ионы натрия Na+ и отрицательно заряженные ионы хлора Cl-. ристаллическая решетка хлорида натрия (поваренной соли) ионная. В узлах кристаллической решетки хлорида натрия находятся положительно заряженные ионы натрия Na+ и отрицательно заряженные ионы хлора Cl-. | |||||||||
| № 17. Мерой полярности связи и молекулы является дипольный момент р определяется произведением: р = l, где - эффективный заряд, l – длина диполя ( не смешивать с длиной связи). Для отдельной молекулы длина диполя всегда меньше длины связи из-за несовпадения центров тяжести зарядов с центрами ядер атомов. Электрический момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака. Электрические моменты диполя экспериментально определены для различных связей и большого числа молекул. Электрический дипольный момент, физическая величина, характеризующая электрические свойства системы заряженных частиц. Д. м. системы из N заряженных частиц равен
| |||||||||
| № 18. Хотя молекулы в целом нейтральны, между ними проявляется межмолекулярное взаимодействие. Как и силы связи между атомами, межмолекулярные силы имеют электрическую природу. Они обусловлены полярностью и поляризуемостью молекул. Различают 3 типа межмолекулярного взаимодействия. 1. Ориентационное взаимодействие двух полярных молекул. При сближении полярные молекулы ориентируются относительно друг друга противоположно заряженными концами диполей. Чем более полярными являются молекулы, тем прочнее между ними взаимодействие. С повышением температуры ориентационное взаимодействие ослабляется за счет усиления теплового движения молекул. 2. Индукционное взаимодействие между полярной и неполярной молекулой: первая деформирует электронное облако второй. В результате у неполярной молекулы возникает временный электрический момент диполя, а затем обе молекулы взаимодействуют как диполи. Этот вид взаимодействия не зависит от температуры, а зависит от напряженности электрического поля полярной молекулы. 3. Дисперсионное взаимодействие между двумя неполярными молекулами. Вследствие движения электронов внутри молекулы в одной из них происходит небольшая мгновенная деформация электронного облака, создающая асимметрию в распределении зарядов. Возникает также диполь, который существует очень короткое время. Но тем самым устанавливается связь между молекулами. Все названные 3 типа межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Все эти силы невелики и очень быстро уменьшаются при увеличении расстояния между молекулами. Особое значение имеет водородная связь. Это физико-химическая связь, которая возникает между протонизированным атомом водорода одной молекулы и атомом сильно электроотрицательным элементом (F, O, N) другой молекулы. Она бывает межмолекулярной и внутримолекулярной (в белках). На образование водородной связи оказывают влияние не только силы электростатического взаимодействия между атомами водорода и атомами фтора, кислорода или азота, но донорно-акцепторное взаимодействие. Для этой связи характерны направленность в пространстве и насыщаемость. Водородная связь намного слабее ковалентной, но она оказывает сильное влияние на свойства многих веществ: благодаря ей вода и фтороводород при обычных условиях - не газы, а жидкости.  на схеме водородную связь обозначают точками. на схеме водородную связь обозначают точками.Вода уксусная кислота Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединениях. | |||||||||
| № 19. Термодинамическая система - совокупность физических тел, которые могут: - энергетически взаимодействовать между собой и с другими телами; а также - обмениваться с ними веществом. Термодинамическая система: - состоит из большого количества частиц; и - подчиняется в своем поведении статистическим закономерностям, проявляющимся на всей совокупности частиц. Для термодинамических систем выполняются законы термодинамики.Термодинамические функции (термодинамические потенциалы) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе. Выделяют следующие термодинамические потенциалы: 1) внутренняя энергия; 2) энтропия; 3) энтальпия; 4) свободная энергия Гельмгольца; 5) потенциал Гиббса; 6) большой термодинамический потенциал Термодинамическими величинами называют физические величины, применяемые при описании состояний и процессов в термодинамических системах. Термодинамика рассматривает эти величины как некоторые макроскопические параметры и функции, присущие системе, но не связанные с её микроскопическим устройством. Вопросы микроскопического устройства изучает статистическая физика. Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние. Функции состояния в термодинамике включают: 1) температуру; 2) давление; 3) объём; 4) энтропию; 5) термодинамические потенциалы. Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние. Функции процесса в термодинамике включают: 1) количество теплоты; 2)термодинамическую работу. Эти величины, однако, могут быть «превращены» в функции состояния с помощью интегрирующего множителя: PdV = δA, где P (давление) и V (объём) — функции состояния. |
|||||||||
Первый закон термодинамики
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
-
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Следствия из закона Гесса
-
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
-
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
-
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т.н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.

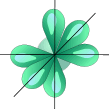


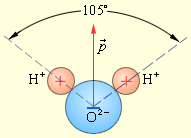 Дипольный момент молекулы воды
Дипольный момент молекулы воды