Файл: Цель работы изучение химических свойств металлов iia группы и их соединений формирование навыков выполнения химического эксперимента. Опыт Получение и свойства гидроксида бериллия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 33
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Максимальное значение растворенного вещества превышено – будет выпадать осадок.
Аналогичные вычисления можно провести в отношении гидроксида кальция и гидроксида стронция.
m2(Sr(OH)2) = 81 г. m1(Sr(OH)2) = 8 г. Δm = m2 – m1 = 73 г.
ε =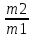 = 10,1.
= 10,1.
m2(Ca(OH)2) = 49 г. m1(Ca(OH)2) = 1,56 г. Δm = m2 – m1 = 47,44 г.
ε =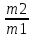 = 31,4.
= 31,4.
Данные расчеты позволяют сказать, что в ходе всех трех реакций будут выпадать осадки.
Ca2+ + 2Cl- + 2Na+ + 2OH- = Ca(OH)2 + 2Na+ + 2Cl-
Ca2+ + 2OH- = Ca(OH)2
Sr2+ + 2Cl- + 2Na+ + 2OH- = Sr(OH)2 + 2Na+ + 2Cl-
Sr2+ + 2OH- = Sr(OH)2
Ba2+ + 2Cl- + 2Na+ + 2OH- = Ba(OH)2 + 2Na+ + 2Cl-
Ba2+ + 2OH- = Ba(OH)2 (образование осадка происходит в незначительной мере).
Опыт 7. Получение и свойства солей щелочноземельных металлов.
А) Получение и свойства карбонатов щелочноземельных металлов.
 Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария.
Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария.
Ca2+ + 2NO-3 + 2Na+ + CO-3 = CaCO3 + 2Na+ + 2NO-3
 Ca2+ + CO-3 = CaCO3
Ca2+ + CO-3 = CaCO3
Sr2+ + 2NO-3 + 2Na+ + CO-3 = SrCO3 + 2Na+ + 2NO-3
 Sr2+ + CO-3 = SrCO3
Sr2+ + CO-3 = SrCO3
Ba2+ + 2NO-3 + 2Na+ + CO-3 = BaCO3
+ 2Na+ + 2NO-3
Ba2+ + CO-3 = BaCO3
В каждую пробирку прилили раствор соляной кислоты. Наблюдалось растворение полученных ранее осадков и выделение бесцветного газа.
CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + CO2 + H2O
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
SrCO3 + 2H+ + 2Cl- = Sr2+ + 2Cl- + CO2 + H2O
SrCO3 + 2H+ = Sr2+ + CO2 + H2O
BaCO3 + 2H+ + 2Cl- = Ba2+ + 2Cl- + CO2 + H2O
BaCO3 + 2H+ = Ba2+ + CO2 + H2O
Теоретически проанализировать растворимость карбонатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ.
П.Р. (CaCO3) = 3,8*10-9
П.Р. (SrCO3) = 1,1*10-10
П.Р. (BaCO3) = 4,0*10-10
На основании этих данных можно сделать вывод, что в ряду SrCO3 – BaCO3 – CaCO3 растворимость веществ в воде увеличивается.
Б) Получение и свойства сульфатов щелочноземельных металлов.
Взаимодействием нитратов кальция, стронция, бария с раствором сульфата натрия в трех пробирках были получены белые кристаллические осадки соответствующих сульфатов.

Ca2+ + 2NO-3 + 2Na+ + SO2-4 = CaSO4 + 2Na+ + 2NO-3
Ca2+ + SO2-4 = CaSO4

Sr2+ + 2NO-3 + 2Na+ + SO2-4 = SrSO4 + 2Na+ + 2NO-3
Sr2+ + SO2-4 = SrSO4

Ba2+ + 2NO-3 + 2Na+ + SO2-4 = BaSO4 + 2Na+ + 2NO-3
Ba2+ + SO2-4 = BaSO4
При этом образование осадка происходило быстрее всего мере в реакции с нитратом бария, медленнее всего – в реакции с сульфатом кальция.
Теоретически проанализировать растворимость сульфатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ.
П.Р. (CaSO4) = 2,5*10-5
П.Р. (SrSO4) = 3,2*10-7
П.Р. (BaSO4) = 1,1*10-10
На основании этих данных можно сделать вывод, что в ряду BaSO4 – SrSO4 – CaSO4 растворимость веществ в воде увеличивается.
Исследовали отношение полученных сульфатов к разбавленным растворам соляной и азотной кислот. Сульфаты бария, стронция и кальция в растворах указанных кислот нерастворимы. Объяснить это можно тем, что продукты такого взаимодействия хорошо растворимы в воде (намного лучше, чем сульфаты кальция, стронция и бария).
Опыт 8. Окрашивание пламени солями щелочноземельных металлов.
В бесцветное пламя спиртовой горелки внесли нихромовую проволоку, изменения цвета пламени при этом не наблюдалось.
Проволока была смочена раствором хлорида кальция и внесена в нижнюю часть пламени спиртовки. При этом пламя приобрело кирпично-красный цвет.
Аналогичные действия были проведены в отношении хлоридов стронция и бария. В случае хлорида стронция пламя приобрело карминово-красный цвет, а в случае хлорида бария – желто-зеленый цвет.
После каждого опыта проволока промывалась раствором соляной кислоты.
Аналогичные вычисления можно провести в отношении гидроксида кальция и гидроксида стронция.
m2(Sr(OH)2) = 81 г. m1(Sr(OH)2) = 8 г. Δm = m2 – m1 = 73 г.
ε =
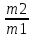 = 10,1.
= 10,1.m2(Ca(OH)2) = 49 г. m1(Ca(OH)2) = 1,56 г. Δm = m2 – m1 = 47,44 г.
ε =
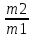 = 31,4.
= 31,4.Данные расчеты позволяют сказать, что в ходе всех трех реакций будут выпадать осадки.
-
CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl
Ca2+ + 2Cl- + 2Na+ + 2OH- = Ca(OH)2 + 2Na+ + 2Cl-
Ca2+ + 2OH- = Ca(OH)2
-
SrCl2 + 2NaOH = Sr(OH)2 + 2NaCl
Sr2+ + 2Cl- + 2Na+ + 2OH- = Sr(OH)2 + 2Na+ + 2Cl-
Sr2+ + 2OH- = Sr(OH)2
-
BaCl2 + 2NaOH = Ba(OH)2 + 2NaCl
Ba2+ + 2Cl- + 2Na+ + 2OH- = Ba(OH)2 + 2Na+ + 2Cl-
Ba2+ + 2OH- = Ba(OH)2 (образование осадка происходит в незначительной мере).
Опыт 7. Получение и свойства солей щелочноземельных металлов.
А) Получение и свойства карбонатов щелочноземельных металлов.
 Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария.
Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария. -
Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
Ca2+ + 2NO-3 + 2Na+ + CO-3 = CaCO3 + 2Na+ + 2NO-3
 Ca2+ + CO-3 = CaCO3
Ca2+ + CO-3 = CaCO3-
Sr(NO3)2 + Na2CO3 = SrCO3 + 2NaNO3
Sr2+ + 2NO-3 + 2Na+ + CO-3 = SrCO3 + 2Na+ + 2NO-3
 Sr2+ + CO-3 = SrCO3
Sr2+ + CO-3 = SrCO3-
Ba(NO3)2 + Na2CO3 = BaCO3 + 2NaNO3
Ba2+ + 2NO-3 + 2Na+ + CO-3 = BaCO3
+ 2Na+ + 2NO-3
Ba2+ + CO-3 = BaCO3
В каждую пробирку прилили раствор соляной кислоты. Наблюдалось растворение полученных ранее осадков и выделение бесцветного газа.
-
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + CO2 + H2O
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
-
SrCO3 + 2HCl = SrCl2 + CO2 + H2O
SrCO3 + 2H+ + 2Cl- = Sr2+ + 2Cl- + CO2 + H2O
SrCO3 + 2H+ = Sr2+ + CO2 + H2O
-
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCO3 + 2H+ + 2Cl- = Ba2+ + 2Cl- + CO2 + H2O
BaCO3 + 2H+ = Ba2+ + CO2 + H2O
Теоретически проанализировать растворимость карбонатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ.
П.Р. (CaCO3) = 3,8*10-9
П.Р. (SrCO3) = 1,1*10-10
П.Р. (BaCO3) = 4,0*10-10
На основании этих данных можно сделать вывод, что в ряду SrCO3 – BaCO3 – CaCO3 растворимость веществ в воде увеличивается.
Б) Получение и свойства сульфатов щелочноземельных металлов.
Взаимодействием нитратов кальция, стронция, бария с раствором сульфата натрия в трех пробирках были получены белые кристаллические осадки соответствующих сульфатов.

-
Ca(NO3)2 + Na2SO4 = CaSO4 + 2NaNO3
Ca2+ + 2NO-3 + 2Na+ + SO2-4 = CaSO4 + 2Na+ + 2NO-3
Ca2+ + SO2-4 = CaSO4

-
Sr(NO3)2 + Na2SO4 = SrSO4 + 2NaNO3
Sr2+ + 2NO-3 + 2Na+ + SO2-4 = SrSO4 + 2Na+ + 2NO-3
Sr2+ + SO2-4 = SrSO4

-
Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
Ba2+ + 2NO-3 + 2Na+ + SO2-4 = BaSO4 + 2Na+ + 2NO-3
Ba2+ + SO2-4 = BaSO4
При этом образование осадка происходило быстрее всего мере в реакции с нитратом бария, медленнее всего – в реакции с сульфатом кальция.
Теоретически проанализировать растворимость сульфатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ.
П.Р. (CaSO4) = 2,5*10-5
П.Р. (SrSO4) = 3,2*10-7
П.Р. (BaSO4) = 1,1*10-10
На основании этих данных можно сделать вывод, что в ряду BaSO4 – SrSO4 – CaSO4 растворимость веществ в воде увеличивается.
Исследовали отношение полученных сульфатов к разбавленным растворам соляной и азотной кислот. Сульфаты бария, стронция и кальция в растворах указанных кислот нерастворимы. Объяснить это можно тем, что продукты такого взаимодействия хорошо растворимы в воде (намного лучше, чем сульфаты кальция, стронция и бария).
Опыт 8. Окрашивание пламени солями щелочноземельных металлов.
В бесцветное пламя спиртовой горелки внесли нихромовую проволоку, изменения цвета пламени при этом не наблюдалось.
Проволока была смочена раствором хлорида кальция и внесена в нижнюю часть пламени спиртовки. При этом пламя приобрело кирпично-красный цвет.
Аналогичные действия были проведены в отношении хлоридов стронция и бария. В случае хлорида стронция пламя приобрело карминово-красный цвет, а в случае хлорида бария – желто-зеленый цвет.
После каждого опыта проволока промывалась раствором соляной кислоты.


