Файл: Термодинамика, фазалы тепетедіктер. ! Химиялы термодинамика зерттейді.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 62
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
. *1,44 с -1. *2,88 с -1.
V тарау. Химиялық кинетика.
! Химиялық кинетика зерттейді:
*+химиялық реакция жылдамдығын.
* химиялық энергияның жылулық эффектісін.
* химиялық реакциялардың өту мүмкіндігін.
* химиялық реакциялардың өту механизмін.
* реакция жылдамдығының түрлі факторларға тәуелділігін.
! Химиялық реакция жылдамдығы үшін теңдеу w = -dC/dt жазылса, онда реакция жылдамдығы
* газ тәріздес реакция өнімі қысымы бойынша.
*+газ тәріздес реакция өнімі концентрациясы бойынша.
* қатты реакция өнімі массасы бойынша.
* катализатор массасы бойынша.
* тек қана бастапқы зат концентрацияларының өзгерісі бойынша.
! аА + bB + cC = mM + nN реакциясы үшін тура реакциясы реті:
* 1-а. *+a+b+c. * m+n. * b. * n.
! 2-ші ретті кинетикалық теңдеулер:
* w = kCA* * w = kCACB * +w = k.
* w = kCA2CB * w = kCACDCC
! Реакцияның молекулярлығы бола алады
*кез-келген оң мәнде. * теріс мәнде.
* нөлге тең. *+тек қана 1, 2, 3.
* бөлшек сан.
! Келтірілген реакциялардың ішінен тримолекулярлыны таңдаңыз:*J2 = 2J.
* CH3COCH3 = C2H4 + H2 + CO.
*+ H + H + M == H2 + M.
* 2NO + O2 = 2NO2. * J2 + H2 = 2HJ.
! aA + bB ↔ cC + dD кері реакциясы үшін реттілік тең*a+b. * a*b. *+ c+d.
* c*d. * a+b+c+d.
! Нөлінші ретті реакция жылдамдығы анықталатын теңдеу: * w=kC. *+w=k.
* w=kC2. * w=kC3. * w=kC-2.
! Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:*Қарапайым. * Қайтымды.
*+Күрделі. * ферментативті.
* Биохимиялық.
! Бірдей зататрдың бір уақытта әрекеттесіп, бірақ түрлі өнімдер түзетін реакциялар аталады:*Тізбекті.
*+Параллельді. * Қайтымды.
* Қосарланған. * Кезектескен.
! Бірінен соң бірі кезектесіп жүретін реакциялар аталады:*Тізбекті.
* Параллельді. * Қайтымды.
* Қосарланған. *+Кезектескен.
! Бастапқы реакция өздігінен жүріп, екінші реакция бірінші реакцияның есебінен жүретін реакцияларды қалай атайды:*Тізбекті. * Параллельді.
* Қайтымды. *+Қосарланған.
* Кезектескен.
! Бір уақытта қарама-қарсы екі бағытта жүретін реакциялардың аталуы:*Тізбекті.
* Параллель. *+Қайтымды.
* Қосарланған. * Кезекті.
! «Температураны әрбір 10 градусқа көтерген сайын химиялық орташа 2-4 есе артады» Вант-Гофф ережесі қолданылмайтын реакция:
*+Ферментативті. * Бірінші ретті.
* Екінші ретті. * Үшінші ретті.
* Фотохимиялық.
! Өз бетінше катализатор емес, бірақ катализаторға қосқанда оның активтілігін арттыратын зат аталады: *+Промотор.
* Каталитикалық у. * Акцептор.
* Индуктор. * Актор.
! Реакция жылдамдығы азаяды:
* температураны арттырғанда.
*+каталитикалық удың әсерінен.
* промотор әсерінен.
* ингибитор әсерінен.
* реагент концентрациясын ұлғайтқанда.
! Субстрат:
*ферменттің бастапқы затпен аралық комплексі.
* ферментативті реакцияның өнімі.
* ферментативті реакцияның катализаторы.
*+берілген ферменттің әсер беретін қосылысы.
* ферментативті реакцияны тежейтін зат.
! Реакцияның молекулярлығы дегеніміз:
*+ Реакцияның стехиометриялық коэффициенттерінің қосындысы.
* Берілген химиялық реакцияға қатысатын молекулалар саны .
* Реакцияның ретіне тең шама, егер реакция реті бүтін сан болса.
* Қарапайым бір актісіне қатысатын молекула саны.
* Анықтамалардың ешқайсысы сәйкес келмейді.
! Бірнеше қатар кезекті стадиядан тұратын кез-келген күрделі химиялық реакцияның жылдамдығы анықталады:
*Барлық стадиялардың орташа жылдамдығымен.
* Ең жылдам стадияның жылдамдығымен.
*+ Ең баяу стадияның жылдамдығымен.
* Бірінші стадияның жылдамдығымен.
* Соңғы стадияның жылдамдығымен.
! Химиялық реакцияның молекулярлығы бола алады:*Тек бөлшек сан.
*+ Тек 1,2,3. * Теріс мәнде.
* Кез-келген (бөлшек сан, бүтін сан,оң және теріс мәндерде). * 1,2,3,4.
! Бимолекулярлы реакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): *J2→2J. * H2→2H.
* NH4Cl→NH3 +HCl. *+ H2 + J2→ 2HJ.
* NH4CNS→ (NH*2CS.
! Тримолекулярлыреакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): *CO + Cl2 = COCl2.
* H2→2H. * NH4Cl→NH3 +HCl.
* Ca(HCO*2 →H2O+CO2+CaO.
*+ 2NO+O2=2NO2.
! aA+bB=mM+nN тура реакциясының ретін анықтайтын теңдеуді көрсетіңіз:
*n=a*b. * n=m*n. *+ n=a+b.
* n=a+b+m+n. * n=m+n.
! Егер реакцияның кинетикалық теңдеуі w=CAaCBbCDd
түрінде жазылса, онда реакцияның жалпы реті:
*+берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* 1,2 немесе 3 тең.
* Анықтау мүмкін емес.
* К=a+b-d формуласы бойынша табылады.
! Тура 4NH3+5O2→4NO+6H2O реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
*w=k[NH3]4+[O2]5. * w=k[NH3]*[O2]5.
* w=k[NH3]*[O2]. * w=k[NH3]4*5[O2].
* +w=k[NH3]4*[O2]5.
! 2NO(г)+Cl2(г)→2 NOCl(г) кері реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
*k= [NOCl] .
[NO]2 [Cl2]
*+ k= [NOCl]2 .
[NO]2 [Cl2]
* k= [NOCl]2 .
[NO]2 + [Cl2]
* k= 2[NOCl] .
2[NO] [Cl2]
*k= [NO] [Cl] .
[NOCl]2
! Қысымның өзгерісі реакцияның тепе-теңдігін ығыстырмайды:
*C(к)+CO2(г)=2CO(г)+Q.
* 2NO(г)+Cl2(г)→2NOCl(г)+Q.
* 2SO2(г)+O2(г)→2SO 3(г)+Q.
*+ N2(г)+O2→2NO(г)+Q.
* 2NO2(г)→N2O4(ж)+Q.
! Егер жүйедегі қысымды 5 есе ұлғайса, N2(г)+O2↔2NO(г) тура реакция жылдамдығы:*5 есе артады.
* 5 есе кемиді. * Өзгермейді.
*+ 25 есе артады. * 25 есе кемиді
! Реакцияның температуралық коэффициенті γ=3. Егер температураны 25˚С-тен 55˚С-ке өзгертсе, реакция жылдамдығы:*27 есе кемиді.
*+27 есе артады. * 9 есе артады.
* 9 есе кемиді. * Өзгермейді.
! Реакцияның температуралық коэффициенті γ=2. Егер температураны 373К-нен 323К-ге дейін өзгертсе, реакция жылдамдығы:*10 есе артады.
* 10 есе кемиді. * 32 есе артады.
*+32 есе кемиді. * Өзгермейді.
! 3 ретті реакцияның кинетикалық теңдеуі:*w=k. *+w=kCACB2.
* w=kCA. * w=k CB2. * w=k CACB.
! 1 ретті реакция үшін жартылай ыдырау уақыты:
* t1/2=C.
2k
* t1/2=ln2.
k
*+ t1/2=0.69.
k
*t1/2=1 .
kCn
*t1/2=1 3 .
k 2Cn2
! Химиялық реакция жылдамдығының өлшем бірліктері:*молек. *см-3*с-1.
*+ моль*л-1*с-1. * молек.*см3*с-1
.
* моль/л. * моль*л-1*с1.
! Ферментативті процестер жылдамдығын сипаттайтын теңдеу:*Смолуховский.
*+ Михаэлис-Ментен. * Аррениус.
* Вант-Гофф. * Гиббс.
! Реакция реті дегеніміз
* Бастапқы заттар бөлшектерінің әртүрлі сандық мөлшері
* Бастапқы заттар мен өнімдердің бөлшектерінің әртүрлі сандық мөлшері
* Бірінші элементарлық актіге қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
* Бірінші элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
*+Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
! Реакцияның молекулярлығы деп
* Бастапқы заттардың әртүрлі бөлшектерінің сандық мөлшері
* Бастапқы заттар мен өнімдердің әртүрлі бөлшектерінің сандық мөлшері
*+Біріншілік элементарлық ауысу актіне қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
*Біріншілік элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
*Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
! Бір бағытты гомогенді екінші ретті реакцияның «2A =ӨНІМДЕР» түріндегі гомогендік реакциясының бірінші тәжірибедегі бастапқы заттарының жартылай айналу периоды 30 минутты құрады. Екінші тәжірибедегі сол температурада және біріншіге қарағанда А затының концетрациясы 2 есе көбейтілген болса жартылай өзгеру периодын (минутпен алғанда) табыңыз* 11 * 12
* 13 * 14 *+15
! Химиялық реакцияның жылдамдығының константасы
*кез келген уақыттағы реакцияның жылдамдығына тең
*+егер реагенттер концентрациясы бірге тең болса, ол реакция жылдамдығына тең
* әсерлесуші заттардың концентрациясына байланысты
* әсерлесуші заттардың концентрациясына байланысты емес
* элементарлық актіге қатысатын молекула санына тең
! Температураны 25°тан 45°С арттырғанда жылдамдық реакциясы қалай өзгереді. Егер реакцияның температура коэффициентіγ = 3 тең болса? *6 есе өседі
* 6 есе азаяды *+ 9 есеөседі
* 9 есе азаяды * өзгермейді
! Температураны 50 градусқа арттырғанда реакция жылдамдығы қалай өзгереді. Егер реакцияның температура коэффициенті γ = 2 тең болса?*+32 есеөседі *32 есеазаяды
* 8 есеөседі * 8 есеазаяды * өзгермейді
! Егер реакцияның температура коэффициенті γ = 3, онда температураны 40 градусқа азайтқанда реакция жылдамдығы ...* 12 есеөседі
* 12 есеазаяды * 81 есеөседі
*+81 есе азаяды * өзгермейді
! 2СО +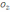
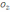 =2С
=2С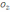
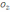 реакцияның молекулярлығын анықтаңыз* 0
реакцияның молекулярлығын анықтаңыз* 0
* 1 * -3 * 2 *+3
! Егер берілген реакцияның стехиометриялық теңдеуі оның механизміне жауап берсе, онда оның молекулярлық реакциясы 2NO+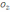
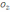 = 2N
= 2N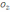
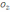 тең* 0 * 1 *2 *+3 *4
тең* 0 * 1 *2 *+3 *4
! Әсерлесуші заттардың концентрациясының уақыт бойындағы графикалық тәуелділігінің өзгерісі аталады
* беттік керілу изотермасы
*+ кинетикалық қисық
* реакцияның энергетикалық профилі
* қисық * адсорбция изотермасы
! химиялық реакция жылдамдығына реагенттер концентрациясының әсерін сандық сипаттайтын* Рауль заңы
* Гесс заңы * Аррениус теңдеуі
* Вант-Гофф ережесі
*+ әрекеттесуші массалар заңы
!. әрекеттесуші массалар заңының авторлары кім:*+Гульдберг и Вааге
* Клапейрони Клаузиус
* Менделеев и Клапейрон
* Шульц и Гарди *Гендерсон Гассельбах
! Химиялық реакцияның жылдамдығының температураға тәуелділігінің теңдеуі:
*Гесстің *Михаэлис-Ментеннің
*+Аррениустың
* Шульце-Гарди ережесімен
* әрекеттесуші массалар заңы
! Ле-Шателье принципі бойынша H2+J2→2HJ реакцияның тепе-теңдігі оңға қарай ығысады, егер
* +Йод пен сутектің концентрациясын көбейтсе
* Сутектің концентрациясын азайтса
* йодсутектің концентрациясын көбейтсе
* Йодтың концентрациясын азайтса
* H2 және
V тарау. Химиялық кинетика.
! Химиялық кинетика зерттейді:
*+химиялық реакция жылдамдығын.
* химиялық энергияның жылулық эффектісін.
* химиялық реакциялардың өту мүмкіндігін.
* химиялық реакциялардың өту механизмін.
* реакция жылдамдығының түрлі факторларға тәуелділігін.
! Химиялық реакция жылдамдығы үшін теңдеу w = -dC/dt жазылса, онда реакция жылдамдығы
* газ тәріздес реакция өнімі қысымы бойынша.
*+газ тәріздес реакция өнімі концентрациясы бойынша.
* қатты реакция өнімі массасы бойынша.
* катализатор массасы бойынша.
* тек қана бастапқы зат концентрацияларының өзгерісі бойынша.
! аА + bB + cC = mM + nN реакциясы үшін тура реакциясы реті:
* 1-а. *+a+b+c. * m+n. * b. * n.
! 2-ші ретті кинетикалық теңдеулер:
* w = kCA* * w = kCACB * +w = k.
* w = kCA2CB * w = kCACDCC
! Реакцияның молекулярлығы бола алады
*кез-келген оң мәнде. * теріс мәнде.
* нөлге тең. *+тек қана 1, 2, 3.
* бөлшек сан.
! Келтірілген реакциялардың ішінен тримолекулярлыны таңдаңыз:*J2 = 2J.
* CH3COCH3 = C2H4 + H2 + CO.
*+ H + H + M == H2 + M.
* 2NO + O2 = 2NO2. * J2 + H2 = 2HJ.
! aA + bB ↔ cC + dD кері реакциясы үшін реттілік тең*a+b. * a*b. *+ c+d.
* c*d. * a+b+c+d.
! Нөлінші ретті реакция жылдамдығы анықталатын теңдеу: * w=kC. *+w=k.
* w=kC2. * w=kC3. * w=kC-2.
! Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:*Қарапайым. * Қайтымды.
*+Күрделі. * ферментативті.
* Биохимиялық.
! Бірдей зататрдың бір уақытта әрекеттесіп, бірақ түрлі өнімдер түзетін реакциялар аталады:*Тізбекті.
*+Параллельді. * Қайтымды.
* Қосарланған. * Кезектескен.
! Бірінен соң бірі кезектесіп жүретін реакциялар аталады:*Тізбекті.
* Параллельді. * Қайтымды.
* Қосарланған. *+Кезектескен.
! Бастапқы реакция өздігінен жүріп, екінші реакция бірінші реакцияның есебінен жүретін реакцияларды қалай атайды:*Тізбекті. * Параллельді.
* Қайтымды. *+Қосарланған.
* Кезектескен.
! Бір уақытта қарама-қарсы екі бағытта жүретін реакциялардың аталуы:*Тізбекті.
* Параллель. *+Қайтымды.
* Қосарланған. * Кезекті.
! «Температураны әрбір 10 градусқа көтерген сайын химиялық орташа 2-4 есе артады» Вант-Гофф ережесі қолданылмайтын реакция:
*+Ферментативті. * Бірінші ретті.
* Екінші ретті. * Үшінші ретті.
* Фотохимиялық.
! Өз бетінше катализатор емес, бірақ катализаторға қосқанда оның активтілігін арттыратын зат аталады: *+Промотор.
* Каталитикалық у. * Акцептор.
* Индуктор. * Актор.
! Реакция жылдамдығы азаяды:
* температураны арттырғанда.
*+каталитикалық удың әсерінен.
* промотор әсерінен.
* ингибитор әсерінен.
* реагент концентрациясын ұлғайтқанда.
! Субстрат:
*ферменттің бастапқы затпен аралық комплексі.
* ферментативті реакцияның өнімі.
* ферментативті реакцияның катализаторы.
*+берілген ферменттің әсер беретін қосылысы.
* ферментативті реакцияны тежейтін зат.
! Реакцияның молекулярлығы дегеніміз:
*+ Реакцияның стехиометриялық коэффициенттерінің қосындысы.
* Берілген химиялық реакцияға қатысатын молекулалар саны .
* Реакцияның ретіне тең шама, егер реакция реті бүтін сан болса.
* Қарапайым бір актісіне қатысатын молекула саны.
* Анықтамалардың ешқайсысы сәйкес келмейді.
! Бірнеше қатар кезекті стадиядан тұратын кез-келген күрделі химиялық реакцияның жылдамдығы анықталады:
*Барлық стадиялардың орташа жылдамдығымен.
* Ең жылдам стадияның жылдамдығымен.
*+ Ең баяу стадияның жылдамдығымен.
* Бірінші стадияның жылдамдығымен.
* Соңғы стадияның жылдамдығымен.
! Химиялық реакцияның молекулярлығы бола алады:*Тек бөлшек сан.
*+ Тек 1,2,3. * Теріс мәнде.
* Кез-келген (бөлшек сан, бүтін сан,оң және теріс мәндерде). * 1,2,3,4.
! Бимолекулярлы реакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): *J2→2J. * H2→2H.
* NH4Cl→NH3 +HCl. *+ H2 + J2→ 2HJ.
* NH4CNS→ (NH*2CS.
! Тримолекулярлыреакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): *CO + Cl2 = COCl2.
* H2→2H. * NH4Cl→NH3 +HCl.
* Ca(HCO*2 →H2O+CO2+CaO.
*+ 2NO+O2=2NO2.
! aA+bB=mM+nN тура реакциясының ретін анықтайтын теңдеуді көрсетіңіз:
*n=a*b. * n=m*n. *+ n=a+b.
* n=a+b+m+n. * n=m+n.
! Егер реакцияның кинетикалық теңдеуі w=CAaCBbCDd
түрінде жазылса, онда реакцияның жалпы реті:
*+берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* 1,2 немесе 3 тең.
* Анықтау мүмкін емес.
* К=a+b-d формуласы бойынша табылады.
! Тура 4NH3+5O2→4NO+6H2O реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
*w=k[NH3]4+[O2]5. * w=k[NH3]*[O2]5.
* w=k[NH3]*[O2]. * w=k[NH3]4*5[O2].
* +w=k[NH3]4*[O2]5.
! 2NO(г)+Cl2(г)→2 NOCl(г) кері реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
*k= [NOCl] .
[NO]2 [Cl2]
*+ k= [NOCl]2 .
[NO]2 [Cl2]
* k= [NOCl]2 .
[NO]2 + [Cl2]
* k= 2[NOCl] .
2[NO] [Cl2]
*k= [NO] [Cl] .
[NOCl]2
! Қысымның өзгерісі реакцияның тепе-теңдігін ығыстырмайды:
*C(к)+CO2(г)=2CO(г)+Q.
* 2NO(г)+Cl2(г)→2NOCl(г)+Q.
* 2SO2(г)+O2(г)→2SO 3(г)+Q.
*+ N2(г)+O2→2NO(г)+Q.
* 2NO2(г)→N2O4(ж)+Q.
! Егер жүйедегі қысымды 5 есе ұлғайса, N2(г)+O2↔2NO(г) тура реакция жылдамдығы:*5 есе артады.
* 5 есе кемиді. * Өзгермейді.
*+ 25 есе артады. * 25 есе кемиді
! Реакцияның температуралық коэффициенті γ=3. Егер температураны 25˚С-тен 55˚С-ке өзгертсе, реакция жылдамдығы:*27 есе кемиді.
*+27 есе артады. * 9 есе артады.
* 9 есе кемиді. * Өзгермейді.
! Реакцияның температуралық коэффициенті γ=2. Егер температураны 373К-нен 323К-ге дейін өзгертсе, реакция жылдамдығы:*10 есе артады.
* 10 есе кемиді. * 32 есе артады.
*+32 есе кемиді. * Өзгермейді.
! 3 ретті реакцияның кинетикалық теңдеуі:*w=k. *+w=kCACB2.
* w=kCA. * w=k CB2. * w=k CACB.
! 1 ретті реакция үшін жартылай ыдырау уақыты:
* t1/2=C.
2k
* t1/2=ln2.
k
*+ t1/2=0.69.
k
*t1/2=1 .
kCn
*t1/2=1 3 .
k 2Cn2
! Химиялық реакция жылдамдығының өлшем бірліктері:*молек. *см-3*с-1.
*+ моль*л-1*с-1. * молек.*см3*с-1
.
* моль/л. * моль*л-1*с1.
! Ферментативті процестер жылдамдығын сипаттайтын теңдеу:*Смолуховский.
*+ Михаэлис-Ментен. * Аррениус.
* Вант-Гофф. * Гиббс.
! Реакция реті дегеніміз
* Бастапқы заттар бөлшектерінің әртүрлі сандық мөлшері
* Бастапқы заттар мен өнімдердің бөлшектерінің әртүрлі сандық мөлшері
* Бірінші элементарлық актіге қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
* Бірінші элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
*+Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
! Реакцияның молекулярлығы деп
* Бастапқы заттардың әртүрлі бөлшектерінің сандық мөлшері
* Бастапқы заттар мен өнімдердің әртүрлі бөлшектерінің сандық мөлшері
*+Біріншілік элементарлық ауысу актіне қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
*Біріншілік элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
*Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
! Бір бағытты гомогенді екінші ретті реакцияның «2A =ӨНІМДЕР» түріндегі гомогендік реакциясының бірінші тәжірибедегі бастапқы заттарының жартылай айналу периоды 30 минутты құрады. Екінші тәжірибедегі сол температурада және біріншіге қарағанда А затының концетрациясы 2 есе көбейтілген болса жартылай өзгеру периодын (минутпен алғанда) табыңыз* 11 * 12
* 13 * 14 *+15
! Химиялық реакцияның жылдамдығының константасы
*кез келген уақыттағы реакцияның жылдамдығына тең
*+егер реагенттер концентрациясы бірге тең болса, ол реакция жылдамдығына тең
* әсерлесуші заттардың концентрациясына байланысты
* әсерлесуші заттардың концентрациясына байланысты емес
* элементарлық актіге қатысатын молекула санына тең
! Температураны 25°тан 45°С арттырғанда жылдамдық реакциясы қалай өзгереді. Егер реакцияның температура коэффициентіγ = 3 тең болса? *6 есе өседі
* 6 есе азаяды *+ 9 есеөседі
* 9 есе азаяды * өзгермейді
! Температураны 50 градусқа арттырғанда реакция жылдамдығы қалай өзгереді. Егер реакцияның температура коэффициенті γ = 2 тең болса?*+32 есеөседі *32 есеазаяды
* 8 есеөседі * 8 есеазаяды * өзгермейді
! Егер реакцияның температура коэффициенті γ = 3, онда температураны 40 градусқа азайтқанда реакция жылдамдығы ...* 12 есеөседі
* 12 есеазаяды * 81 есеөседі
*+81 есе азаяды * өзгермейді
! 2СО +
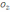
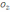 =2С
=2С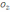
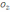 реакцияның молекулярлығын анықтаңыз* 0
реакцияның молекулярлығын анықтаңыз* 0* 1 * -3 * 2 *+3
! Егер берілген реакцияның стехиометриялық теңдеуі оның механизміне жауап берсе, онда оның молекулярлық реакциясы 2NO+
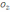
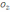 = 2N
= 2N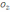
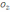 тең* 0 * 1 *2 *+3 *4
тең* 0 * 1 *2 *+3 *4! Әсерлесуші заттардың концентрациясының уақыт бойындағы графикалық тәуелділігінің өзгерісі аталады
* беттік керілу изотермасы
*+ кинетикалық қисық
* реакцияның энергетикалық профилі
* қисық * адсорбция изотермасы
! химиялық реакция жылдамдығына реагенттер концентрациясының әсерін сандық сипаттайтын* Рауль заңы
* Гесс заңы * Аррениус теңдеуі
* Вант-Гофф ережесі
*+ әрекеттесуші массалар заңы
!. әрекеттесуші массалар заңының авторлары кім:*+Гульдберг и Вааге
* Клапейрони Клаузиус
* Менделеев и Клапейрон
* Шульц и Гарди *Гендерсон Гассельбах
! Химиялық реакцияның жылдамдығының температураға тәуелділігінің теңдеуі:
*Гесстің *Михаэлис-Ментеннің
*+Аррениустың
* Шульце-Гарди ережесімен
* әрекеттесуші массалар заңы
! Ле-Шателье принципі бойынша H2+J2→2HJ реакцияның тепе-теңдігі оңға қарай ығысады, егер
* +Йод пен сутектің концентрациясын көбейтсе
* Сутектің концентрациясын азайтса
* йодсутектің концентрациясын көбейтсе
* Йодтың концентрациясын азайтса
* H2 және
