Файл: Непредельные углеводороды. Алкены алкены это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 9
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. АЛКЕНЫ
Алкены — это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле.
Простейший представитель алкенов имеет строение CH2=CH2. Это этилен (этен).
Этилен — бесцветный газ, немного легче воздуха. У него малозаметный сладковатый запах.
Алкены (этиленовые углеводороды) — это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле.
Общая формула алкенов — CnH2n. Начинается гомологический ряд с этилена. Его состав — C2H4. В молекуле каждого алкена есть одна двойная связь, а состав каждого следующего гомолога отличается от предыдущего на группу CH2. Наличие двойной связи в названиях веществ обозначается суффиксом -ен (вместо -ан у алканов).
Формулы и названия некоторых алкенов приведены в таблице.
| Название алкена | Молекулярная формула | Структурная формула |
| Этен (этилен) | C2H4 | CH2=CH2 |
| Пропен (пропилен) | C3H6 | CH2=CH−CH3 |
| Бутен-1 (бутилен-1) | C4H8 | CH2=CH−CH2−CH3 |
| | … | |
| Децен-1 | C10H20 | CH2=CH(CH2)7CH3 |
| | … | |
| Пентадецен-1 | C15H30 | CH2=CH(CH2)12CH3 |
НОМЕНКЛАТУРА АЛКЕНОВ
Согласно правилам международной номенклатуры ИЮПАК, алкен называют, заменяя в названии соответствующего алкана суффикс «ан» на «ен»: C2H4 — этен, C3H6 — пропен и т. д. Положение двойной связи указывают цифрой: CH2=CH−CH2−CH3 —
бутен-1, CH2−CH=CH−CH3 — бутен-2.
Используются также тривиальные названия алкенов: этилен, пропилени др.
Чтобы назвать вещества с разветвлённой углеродной цепью или с заместителями, выбирают самую длинную цепь углеродных атомов и её нумеруют.
Атомы нумеруются с того конца, к которому ближе двойная связь.
Пример 1. Назовём алкен такого строения.
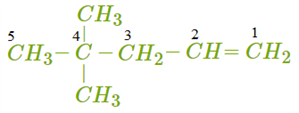
Самая длинная цепь в этой молекуле содержит пять атомов углерода. Нумерацию начинаем справа, так как между первым и вторым атомами углерода расположена двойная связь.
В молекуле два радикала CH3. Указываем цифрами через запятую положение каждого радикала 4, 4, ставим дефис (-), указываем число и название радикалов (диметил), добавляем название главной цепи (пентен) и указываем положение двойной связи: 4, 4-диметилпентен-1.
Если в молекуле содержатся разные радикалы или заместители, то их называют в алфавитном порядке.
Пример 2. Назовём галогенпроизводное следующего алкена.
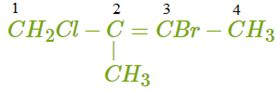
Выбираем и нумеруем самую длинную цепь. Здесь двойная связь находится посередине углеродной цепи, поэтому начало нумерации определяем по заместителю. Записываем «адрес» и название каждого заместителя в алфавитном порядке: 3-бром-2-метил-1-хлорбутен-2.
ИЗОМЕРИЯ АЛКЕНОВ
Алкенам характерна как структурная,так и пространственная изомерия.
Виды структурной изомерии алкенов:
-
изомерия углеродной цепи; -
изомерия положения двойной связи; -
межклассовая изомерия с циклоалканами.
Обрати внимание!
Изомерия углеродной цепи и положения двойной связи возможна при числе атомов углерода не меньше 4.
В молекулах структурных изомеров атомы углерода соединяются в разном порядке. Молекулы могут иметь линейное или разветвлённое строение. Двойная связь в них может располагаться в разных местах.
Межклассовые изомеры существуют у всех алкенов, кроме этилена. Например, пропену CH2=CH−CH3 изомерен циклопропан, структурная формула которого выглядит следующим образом:
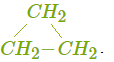
Для некоторых алкенов и их производных возможна пространственная изомерия. Она обусловлена невозможностью вращения частей молекулы вокруг двойной связи.
У веществ, в молекулах которых оба атома углерода при двойной связи соединены с разными группами, существуют геометрические изомеры (цис-транс-изомеры). В молекулах этих веществ порядок соединения атомов одинаковый, но их пространственное расположение различается. Приведём пример пространственных изомеров для галогенпроизводного — 1, 2-дихлорбутена.
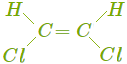 | 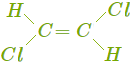 |
| Цис-1, 2-дихлорбутен-2 | Транс-1, 2-дихлорбутен-2 |
Составим структурные формулы изомеров, имеющих состав C4H8.
| Структурная формула изомера | Название | Вид изомерии |
| | бутен-1 | структурная, положения двойной связи |
| | бутен-2 | структурная, положения двойной связи |
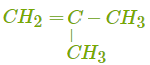 | метилпропен | структурная, углеродной цепи |
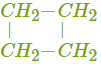 | циклобутан | структурная, межклассовая |
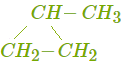 | метилциклопропан | структурная, межклассовая |
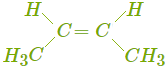 | цис-бутен-2 | пространственная, цис-транс-изомерия |
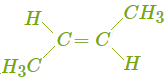 | транс-бутен-2 | пространственная, цис-транс-изомерия |
Значит, всего существует шесть веществ, имеющих состав C4H8, — пять структурных изомеров, один из которых (бутен-2) представлен двумя цис-транс-изомерами.
Число изомеров увеличивается с ростом числа атомов углерода в молекуле алкена. Так, составу C5H10 соответствует шесть нециклических изомеров и пять циклических, а C6H12 — семнадцать нециклических и восемь циклических изомеров.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Алкены, как и все углеводороды, имеют молекулярное строение. При обычных условиях они представляют собой бесцветные газы, летучие бесцветные жидкости или твёрдые легкоплавкие вещества.
Молекулы алкенов неполярные, поэтому они практически не растворяются в воде, но могут растворяться в органических растворителях.
Сравним температуры плавления и кипения неразветвлённых алкенов.
| Алкен | Температура плавления,°C | Температура кипения, °C |
| Этилен | −169,1 | −103,5 |
| Пропилен | −187,6 | −47,7 |
| Бутен-1 | −185,3 | −6,3 |
| Пентен-1 | −165,2 | 30,1 |
| Гексен-1 | −139,8 | 63,5 |
| Гептен-1 | −119,0 | 93,6 |
| ... | ... | ... |
| Гептадецен | 4,1 | 284,4 |
В ряду алкенов с увеличением числа атомов температуры кипения и плавления возрастают.
При нормальных условиях (0 °C и атмосферном давлении) алкены с C2H4 до C4H8 — газы, с C5H10 до C17H34 — жидкости, а начиная с C18H36 — твёрдые вещества.
Температуры плавления и кипения зависят не только от состава, но и от строения молекул. У разветвлённых алкенов их значения ниже по сравнению с неразветвлёнными.
| | Транс-бутен-2 | Цис-бутен-2 | Метилпропен |
| Температура плавления | −105,5 °C | −138,9 °C | −140,4 °C |
| Температура кипения | 0,9 °C | 3,7 °C | −7,73 °C |
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Алкены, в отличие от алканов, являются химически активными веществами. Им характерны реакции присоединения, полимеризации, окисления.
Горение (полное окисление).
Алкены сгорают на воздухе с образованием углекислого газа и воды:
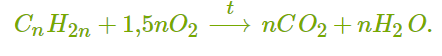
Реакции присоединения
1. Гидрирование.
В присутствии катализатора алкены присоединяют водород и превращаются в алканы. В общем виде уравнение реакции гидрирования выглядит так:

В ходе реакции в молекуле алкена разрывается π-связь и по её месту присоединяются атомы водорода. Например, при гидрировании этилена получается этан:
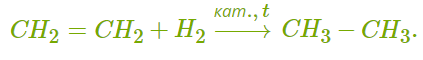
2. Галогенирование.
При обычных условиях алкены вступают в реакцию присоединения с галогенами (кроме фтора). В ходе реакции в молекуле алкена разрывается π-связь и по её месту присоединяются атомы галогена. В общем виде реакцию присоединения хлора можно записать так:

Если для реакции использовать бромную воду (раствор брома в воде), то наблюдается её обесцвечивание. Пример такой реакции — присоединение брома к этилену с образованием 1,2-дибромэтана:
Реакцию с бромной водой используют для обнаружения алкенов и других ненасыщенных соединений.
