Файл: Синтез, очистка и идентификация карбоната лития Li 2 co 3.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.04.2024
Просмотров: 33
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
БУ ВО «Сургутский государственный университет»
Институт естественных и технических наук
Кафедра химии
КУРСОВОЙ ПРОЕКТ
По дисциплине «Неорганическая химия»
На тему «Синтез, очистка и идентификация карбоната лития Li2CO3»
Выполнил:
студент 302-91 гр. 2-го курса
института естественных и технических наук
Попов
Артем
Вадимович
Научный руководитель:
Ст. пр.
Крайник
Виктория
Викторовна
Сургут 2020
СОДЕРЖАНИЕ
ВВЕДЕНИЕ………………………………………………………………............3
ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ……………………...………................5
1.1. Историческая справка………………………...………………...……5
1.2. Области применения…………………………………………………6
1.3. Методы получения………………………………………………..….8
1.4. Физико-химические свойства……………………………………….9
1.5. Биологическая роль………………………………………………....12
ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ……................................….....14
2.1. Методика синтеза и исходные вещества……………………..….14
2.2. Техника безопасности при выполнении синтеза…………..……14
2.3. Синтез…………………………………………………………..….16
ГЛАВА 3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ……..17
3.1. Расчет выхода продукта и его идентификация …….…………..…17
3.2. Испытание на чистоту полученного вещества…………….…...…18
3.2. Исследование свойств соединения……..........................................18
ВЫВОДЫ………………………………………………………………….…....20
СПИСОК ЛИТЕРАТУРЫ……………………………………………………...21
ВВЕДЕНИЕ
За последние несколько лет мировой уровень потребления литиевой продукции увеличился более чем в 2,5 за счет появления новых бурно развивающихся отраслей (фармацевтики, производства синтетических каучуков, термоэластопластов, высокочистых литиевых солей, различных химических источников тока).
Современное мировое производство литиевой продукции, в целом, отличается высокой стабильностью и имеет неплохую перспективу развития, поскольку открытие и разработка богатейших месторождений литиеносного гидроминерального сырья (ЛГМС) в Южной Америке произвели коренной переворот на рынке литиевой продукции за счет резкого снижения себестоимости переработки данного вида сырья в товарные литиевые соли, вообще, и в карбонат лития, в частности [1].
В качестве основных областей применения карбоната лития можно выделить: аккумуляторную промышленность (карбонат лития используются для производства катодного материала), строительную промышленность (все более важным становится применение карбоната лития в качестве добавки к быстросхватывающимся цементам, которые влияют на время схватывания и упрочнение цементов и строительных растворов с высоким и средним содержанием алюминия), а также примеси лития очень эффективны для процесса плавления стекла. Применение карбоната лития в качестве добавки стало важным при производстве стекла, эмали и также в керамической промышленности [1].
Целью данной работы является изучение процессов синтеза, очистки и идентификации такого вещества, как карбонат лития.
Задачами работы будут являться:
-
изучение методов получения, -
исследование физико-химический свойств, -
изучение применения вещества -
вычисление масс реагирующих веществ для получения 5 г карбоната лития.
ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Историческая справка
В отличие от карбонатов других щелочных металлов (соды – карбоната натрия и поташа – карбоната калия) карбонат лития плохо растворим в воде, и поэтому теоретически может накапливаться в природе в виде минерала. Минерал, основным компонентом которого является карбонат лития – забуелит был обнаружен в 1987 у озера Забуйе в Тибете, однако это скорее исключение – карбонат лития практически не встречается в природе [1].
Низкая растворимость карбоната лития облегчает его получение из растворимых солей лития, обычно того самого хлорида лития, который, в свою очередь, можно выделить из месторождений поваренной соли. Особенно богаты хлоридом лития некоторые минеральные источники Южной Америки – Чили и Аргентины. Карбонат лития был впервые получен шведским химиком Йоханом Августом Арфведсоном (Johan August Arfwedson) в 1817 году вместе с другими полученными им соединениями лития [1].
Карбонат лития оказался в арсенале врачей не более, чем через 25 лет после открытия – первоначально его применяли для растворения камней в мочевом пузыре, затем в XIX веке его назначали для лечения головной боли, ревматизма и подагры. Помогал ли карбонат лития от этих хворей или нет – непонятно. В XIX веке врачи часто использовали новые соединения «от всего» – псевдонародная медицина под маской научности, при этом не забываем, что эффект плацебо работал и тогда [2].
Эффект плацебо или реальная польза от карбоната лития привели к тому, что он был запатентован как лекарство, а затем как компонент популярных напитков. Так, в 1929 был создан новый литийсодержащий напиток «Литиированная содовая с лимоном и лаймом». В этом напитке литий содержался до 1940 года, сейчас же этот напиток (уже без лития) известен нам как 7 Up [2].
Значительное расширение областей применения лития и его соединений и усовершенствование технологии их получения за последние 30 лет привели к возникновению самостоятельной крупной литиевой промышленности в ряде стран, многократному увеличению производственных мощностей и номенклатуры выпускаемых промышленностью соединений лития и его лигатур. Здесь можно ограничиться указанием на то, что мощность действующих литиевых заводов в США составляет в настоящее время 25 тыс. т (в пересчете на карбонат лития); это превышает уровень предвоенного 1940 г. более чем в 40 раз и обеспечивает создание больших резервов для дальнейшего увеличения производства как металлического лития, так и его многочисленных производных. [7].
Области применения
1. Карбонат лития используется в промышленном производстве батарей и комплексов сохранения энергии, включая использование литиевых батарей в аэрокосмической индустрии благодаря развитию новых технологических процессов по обработке продукта.
2. Используется в фармацевтической индустрии для производства широкого спектра лекарственных препаратов. В частности для лечения биполярных расстройств, депрессий различного генезиса вплоть до длительных депрессионных эпизодов с шизопатическими отклонениями. Карбонат лития включен в список одних и самых необходимых препаратов для психиатрии и фармакалогии, используемых для лечения психических расстройств.
3. Используется для производства смазочных материалов, используемых во множестве промышленных и технологических производства для увеличения параметров долговечности обрабатываемых материалов и инструментов.
4. Используется для производства веществ, используемых в производстве промышленных и домашних средств для фильтрации и очищения воздуха.
5. Является сырьевым продуктом в промышленном производстве аллюминия, используемый на этапе плавки аллюминиевого сырья.
6. Используется как сырье для изготовления продукции из стекла, отличающиеся повышенной плотностью и легкостью обработки продукции. В стеклоделии карбонат лития применяется как в чистом виде (в том числе и оксид лития), так и в составе различных минералов, таких как: петалит Li
2O·Al2O3·8SiO2 (4,3-5,7 % Li2O), сподумен Li2O·Al2O3·4SiO2 (7,3-8 % Li2O), лепидолит (3,9-6 % Li2O), амблигонит (7-10 % Li2O). Оксид лития сильно повышает химическую стойкость стекла, при его применении вместе с оксидом натрия. В состав стекла как правило вносят (0,1-0,4 %Li2O). Свыше 0,15 % Li2O в составе стекла приводит к:
-
понижению температуры плавления (выступает в роли флюса), что в свою очередь снижает энергозатраты и продлевает кампанию печи. -
снижению вязкости стекломассы. -
повышению качества и блеска готовой продукции, улучшает колер стекла
7. Используется в керамической промышленности на всех этапам обжига продукции для придания не только дополнительных цветовых гамм, но и для увеличения плотности и изностойкости конечного продукта.
8. Используется в аэрокосмической промышленности для изготовления обшивок для кораблей, нуждающихся в выходе в космос. Благодаря своим свойствам обшивка из карбоната натрия позволяет многократное использование после перезахода космического корабля в атмосферу.
9. Используется в автомобильной индустрии в промышленном производстве автомобилей нового поколения, называемых умными автомобилями.
10. Используется в строительной промышленности для добавки в растворы цемента, давая конечному продукту свойства быстрого схватывания.
11. Используется в производстве стяжек и плитки, как вещество, способствующее добавлению конечному продукту свойств дополнительной устойчивости к механическому воздействию, а так же повышенным параметрам прочности и долговечности [4].
Методы получения
В промышленности Li2CO3 получают действием поташа или воды (в виде сухих солей или растворов) на растворы солей лития вблизи их температуры кипения, например при 90оС. Так как Li2CO3 растворим в растворах LiCl или LiNO3 значительно меньше, чем в растворе Li2SO4, то наиболее выделение карбоната лития может быть осуществлено из раствора LiCl или LiNO3; однако обычно осаждение проводят из технических растворов Li2SO4, так как они непосредственно получаются после разложений рудных концентратов лития [7].
Также существует способ получения карбоната лития из литийсодержащих природных рассолов (рис 1.):
Можно привести следующие используемые лабораторные методы получения [3]:
1. Карбонат лития можно получить путем взаимодействия оксида лития и углекислого газа:
Li2O + CO2 = Li2CO3
2. При комнатной температуре, в результате взаимодействия гидроксида лития и углекислого газа образуется карбонат лития и вода:
2LiOH + CO2 = Li2CO3↓ + H2O
3. В результате обменной реакции между хлоридом лития и, например, карбонатом калия, происходит образование карбоната лития:
2LiCl + K2CO3 = Li2CO3↓ + 2KCl
Именно этот метод выбран в качестве проводимого синтеза в данной работе.
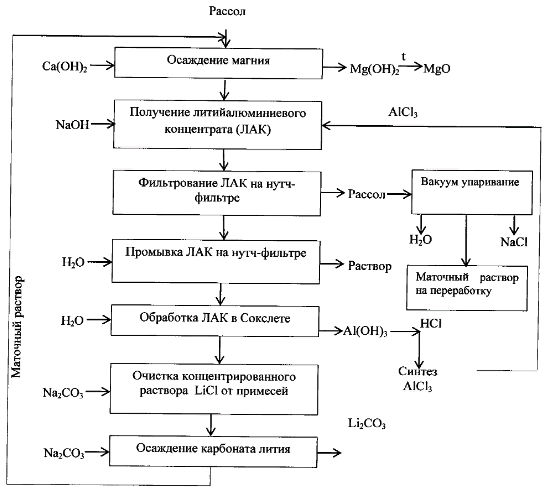
Рис.1 Технологическая схема получения карбоната лития из литийсодержащего природного рассола
Физико-химические свойства
Карбонат лития представляет собой вещество, являющееся порошком в своем изначальном агрегатном состоянии. Не имеет ярковыраженного запаха. Растворим в водных средах.
Выше температуры плавления начинает разлагаться до оксида лития и углекислого газа. Давление разложение достигает атмосферного при 1310 оС.
В термическом отношении Li2CO3 наименее устойчив среди карбонатов других щелочных металлов, что объясняется высокой поляризующей способностью иона лития и отчетливо видно из рис 2.
На основании приведенной на рис. 3 политермы растворимости в системе Li2CO3 – H2О следует, что растворимость карбоната лития в воде с повышением температуры непрерывно уменьшается и при приближении к критической температуре воды выражается всего лишь сотыми долям процента.
Таблица 1. Показатели вещества карбоната лития
| № | Показатели | Значение |
| 1 | Уровень рН Карбоната лития | 11.2 единицы |
| 2 | Температура разложения Карбоната лития | 1310 ° C |
| 3 | Точка плавления Карбоната лития | 1310 ° C |
| 4 | Удельный вес карбоната лития | 2.11 |
| 5 | Молекулярный вес Карбоната лития | 73,89 г/моль |
| 6 | Растворимость Карбоната лития в воде | 1,54 |
