Файл: Синтез, очистка и идентификация карбоната лития Li 2 co 3.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.04.2024
Просмотров: 34
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
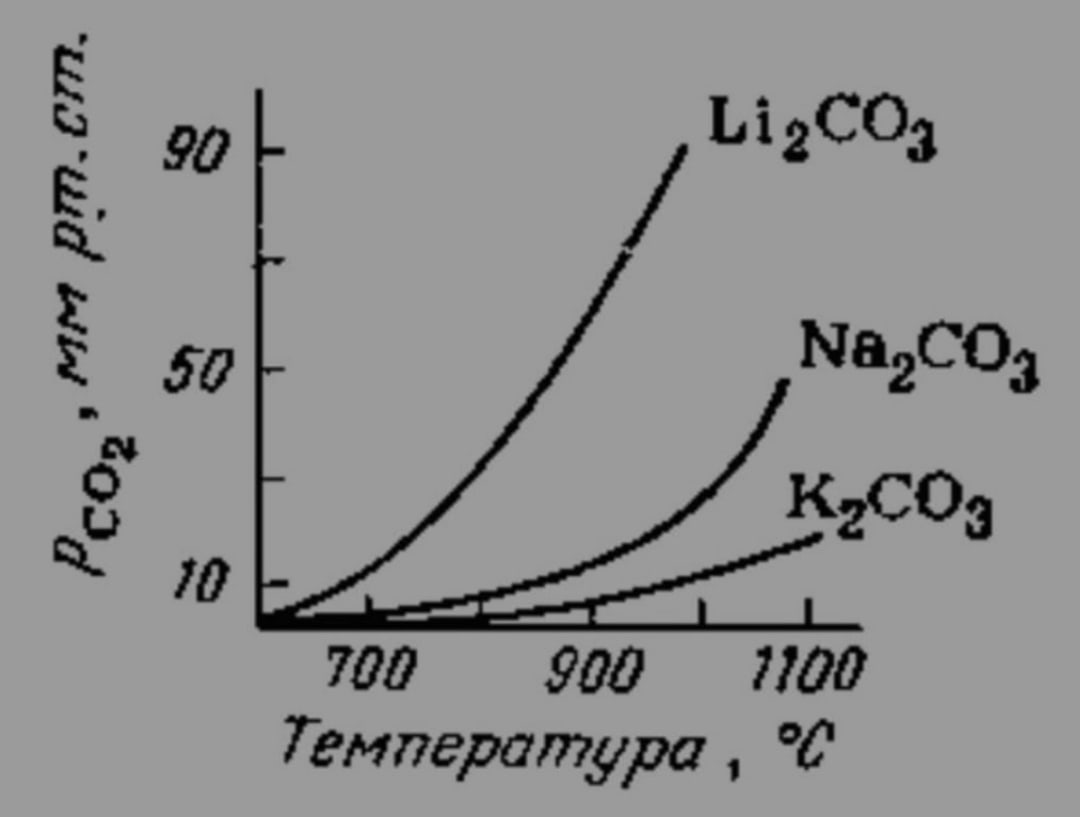
Рис. 2. Зависимость давления СО2 при диссоциации карбонатов щелочных металлов от температуры
Кристаллогидратов Li2CО3 не образует. В водном растворе карбонат лития постепенно гидролизуется, рН насыщенного раствора равен 11; при кипячении гидролиз усиливается [7].

Рис.3. Политерма растворимости карбоната лития в воде.
Химические свойства:
1. Карбонат лития разлагается при температуре от 730º до 1270º с образованием оксида лития и углекислого газа:
Li2CO3 = Li2O + CO2
2. Карбонат лития может реагировать с простыми веществами:
-
Карбонат лития реагирует с углеродом. При этом образуется оксид лития и угарный газ:
Li2CO3 + C(кокс) = Li2O + 2CO
-
С магнием карбонат лития реагирует с образованием лития, оксида магния и углекислого газа:
Li2CO3 + Mg = 2Li + MgO + CO2
3. Карбонат лития вступает в реакцию со многими сложными веществами:
-
Карбонат лития реагирует с водой и углекислым газом, образуя гидрокарбонат лития:
Li2CO3 + H2O + CO2 ↔ 2LiHCO3
-
Карбонат лития может реагировать с гидроксидом кальция с образованием гидроксида лития и карбоната кальция: -
Li2CO3 + Ca(OH)2 = 2LiOH + CaCO3 -
При взаимодействии с хлороводородной кислотой карбонат лития образует хлорид лития, углекислый газ и воду:
Li2CO3 + 2HCl = 2LiCl + CO2↑ +H2O
4. Карбонат лития способен реагировать
с некоторыми оксидами:
-
Карбонат лития при сплавлении реагирует с оксидом кремния. Взаимодействие карбоната лития с оксидом кремния приводит к образованию силиката лития и углекислого газа:
Li2CO3 + SiO2 = Li2SiO3 + 2CO2
-
Карбонат лития взаимодействует с оксидом алюминия. При этом образуются алюминат лития и углекислый газ:
Li2CO3 + Al2O3 = 2LiAlO2 + CO2
-
При взаимодействии карбоната лития с оксидом хрома и кислородом выделяется хромат лития и углекислый газ:
4Li2CO3 + 2Cr2O3 + 3O2 = 4Li2CrO4 + 4CO2 [4].
Биологическая роль
Нормотимическое средство (нормализует психическое состояние, не вызывая общей заторможенности). Оказывает также антидепрессивное, седативное и антиманиакальное действие. Эффект обусловлен ионами лития, которые, являясь антагонистами ионов натрия, вытесняют их из клеток и тем самым снижают биоэлектрическую активность нейронов мозга. Ускоряет распад биогенных аминов (снижается концентрация норэпинефрина и серотонина в тканях мозга). Повышает чувствительность нейронов гиппокампа и других областей мозга к действию допамина. Взаимодействует с липидами, образующимися при метаболизме инозита. В терапевтических концентрациях блокирует активность инозил1-фосфатазы и снижает концентрацию нейронального инозита, который участвует в регуляции чувствительности нейронов.
Благоприятное действие лития при мигрени может быть связано с изменением концентраций серотонина и гистамина в тромбоцитах. Антидепрессивное действие может быть связано с усилением серотонинергической активности и снижением регуляции функции β-адренорецепторов [5].
Токсическое действие. Клиническая картина острого отравления проявляется общей заторможенностью, угнетением реакции на внешние раздражители, судорогами в первые часы после отравления и параличами в последующий период. Смерть наступает в течение первых суток. У человека симптоматика острого отравления наблюдалась при криминальных случаях и при передозировке препаратов в курсе лекарственной терапии психических расстройств. Острая токсичность на мышах ЛД
50 (средняя доза вещества, вызывающая гибель половины членов испытуемой группы) (мг/кг) при введении в кожу – 413, в желудок – 531, внутрибрюшинно – 360 [6].
ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Методика синтеза и исходные вещества.
Исходные вещества:
LiCl – хлорид лития
K2CO3 – карбонат калия.
Методика синтеза:
К насыщенному раствору хлорида лития прибавляют равный объем воды, а затем горячий раствор, содержащий теоретически рассчитанное количество соды или поташа.
Благодаря низкой растворимости (1,33 г при температуре 20°C в 100 г воды) карбонат выпадает в осадок. Его отфильтровывают, 2-3 раза промывают небольшими порциями горячей воды и высушивают при 60-80°C.
Для очистки карбонат можно перекристаллизовать. Приготовляют на холоде насыщенный раствор соли, профильтровывают его и нагревают до кипения. Растворимость при нагревании уменьшается (при 100°C растворяется в 100 г воды 0,72 г карбоната), часть карбоната выпадает в осадок. Горячий раствор отфильтровывают, осадок промывают один раз горячей водой и высушивают при 60-80°C. На воздухе карбонат лития устойчив [4].
Техника безопасности при выполнении синтеза
Хлорид лития — белый мелкокристаллический порошок, на воздухе, притягивая влагу, расплывается. Хранить только в хорошо закрытой склянке или в запаянной ампуле. В виде пыли вызывает раздражение слизистых оболочек дыхательных путей. Краткая характеристика опасности: вредно при проглатывании, при попадании на кожу вызывает раздражение, при попадании в глаза вызывает выраженное раздражение. Меры предосторожности: использовать перчатки/спецодежду/средства защиты глаз/лица. При попадании: промыть большим количеством воды с мылом. При попадании в глаза: Осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если Вы ими пользуетесь, и если это легко сделать. Продолжить промывание глаз. Специальные меры первой помощи: если раздражение глаз продолжается, то необходимо обратиться к врачу.
Карбонат калия:
Краткая характеристика опасности: может причинить вред при проглатывании или при попадании на кожу, вызывает раздражение кожи, вызывает серьезное раздражение глаз. Меры предосторожности: после работы тщательно вымыть руки, а также необходимо пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица. При попадании на кожу: осторожно промыть большим количеством воды. При попадании в глаза: осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если вы пользуетесь ими и если это легко сделать. Продолжить промывание глаз. Обратиться в токсикологический центр или к врачу/специалисту в случае плохого самочувствия.
Карбонат лития:
Краткая характеристика опасности: вредно при попадании внутрь, может причинить вред при попадании на кожу, вызывает серьезное раздражение глаз, вызывает повреждение органов при длительном или неоднократном воздействии, токсично для водной флоры и фауны с долговременными последствиями. Меры предосторожности: перед использованием получить специальные инструкции. Избегать вдыхания пыли/дыма/газа/тумана/паров/распылителей жидкости. При оказании воздействия или обеспокоенности: обратиться в токсикологический центр/к врачу/специалисту.
Хлорид калия:
Краткая характеристика опасности: может причинить вред при проглатывании. Меры предосторожности: обратиться за медицинской помощью при плохом самочувствии [4].
Синтез
Производственный расчёт исходных количеств веществ для получения 5 г карбоната лития:
По уравнению:
2LiCl + K2CO3 = 2KCl + Li2CO3
Рассчитаем молярные массы веществ:
М(LiCl) = 42 г/моль
М(K2CO3) = 138 г/моль
М(KCl) = 75 г/моль
М(Li2CO3) = 74 г/моль
Рассчитаем количество вещества:
n(Li2CO3) = 5/74 = 0,068 моль
n(LiCl) = 2n(Li2CO3) = 0,136 моль
n(K2CO3) = n(Li2CO3) = 0,068 моль
Найдем массы веществ, необходимых для синтеза:
m(LiCl) = 0,136 * 42 = 5,712 г
m(K2CO3) = 0,068 * 138 = 9,384 г
ГЛАВА 3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ.
Расчет выхода продукта и его идентификация.
Расчет выхода продукта:
Выход (%) = (практический выход (г) / теоретический выход (г)) . 100%
mтеор(Li2CO3) = 5 г
В соответствии с литературными данными [3] обычно получается 3,821 г вещества, следовательно, выход составит:
ɳ = 3,821/5 * 100% = 76,42%
Идентификация:
1) определение катионов лития Li+:
а) после растворения лития карбоната в соляной кислоте – пламя горелки окрашивается в карминово-красный цвет ионами лития;
б) с гидрофосфатом натрия в нейтральной или слабощелочной среде растворимые соли дают белый осадок лития фосфата:
3Li+ + НPO42-+ OH- = Li2PO4 + H2O
Для более полного осаждения лития фосфата в реакционную смесь добавляют этанол;
в) ионы лития с оксихинолином образуют красный оксихинолинат лития C9H6NOLi, при УФ-облучении которого наблюдается голубая флуоресценция.
2) реакция на карбонат-ион CO32-
:
Карбонат-ион даёт реакцию с хлористоводородной кислотой, которая сопровождается выделением углекислого газа. Эта реакция основана на вытеснении сильной минеральной кислотой кислоты угольной из её солей. Кислота угольная нестойкая и выделяет CO2 в виде пузырьков газа, который даёт белый осадок при пропускании через известковую воду:
Li2CO3 + 2HCl = 2LiCl + CO2 + H2O [7].
Испытание на чистоту полученного вещества
Чистоту препарата проверяют по отсутствию железа, тяжёлых металлов, хлоридов, сульфатов, кальция. Содержание влаги должно составлять не более 1%. Наличие щелочных металлов проверяют по следующей методике – 0,2 г препарата растворяют в 1 мл соляной кислоты и раствор выпаривают досуха; остаток должен полностью раствориться в 3 мл 96% спирта.
Прозрачность (мутность) и цветность оценивают, действуя азотной кислотой на суспензию, приготовленную смешиванием 10 г препарата в 30 мл воды. Раствор нейтрализуют раствором натрия гидроксида концентрацией 2 моль/л и разбавляют дистиллированной водой до объёма 100 мл. Раствор должен быть прозрачным и бесцветным [8].
Исследование свойств соединения.
Образует бесцветные кристаллы. Кристаллизуется в моноклинной сингонии (а = 0,839 нм, b = 0.500 нм, с = 0,621 нм, b = 114,5°, z = 2, пространств. Группа С2/с), умерено растворяется в холодной воде и плохо в горячей. Температура плавления 732 °C.
Неустойчив и при температуре плавления начинает разлагаться:
Li2CO3 → Li2O + CO2↑ (730 ° C)
Разлагается разбавленными кислотами:
Li2CO3 + 2HCl → 2LiCl + CO2↑ + H2O
Вытесняется из соли более активными металлами:
Li2CO3 + Mg → 2Li + MgO + CO2↑ (500 ° C)
В холодных водных растворах обратимо взаимодействует с углекислым газом с образованием кислой соли:
Li2CO3 + H2O + CO2 ⇄ 2LiHCO3 [9].
Реакции вещества:
-
Выше температуры плавления начинает разлагаться до оксида лития и углекислого газа. Давление разложения достигает атмосферного при 1270 -
Реагирует в водном растворе с углекислым газом образуя, устойчивый только в водном растворе, более растворимый гидрокарбонат лития. -
Разлагается углем с образованием оксида лития. -
При нагревании с алюминием воспламеняется с образованием лития. -
При нагревании с магнием бурно реагирует (со взрывом) с образованием лития [9].
