ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.04.2024
Просмотров: 15
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Д
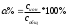 анная величина зависит от:
анная величина зависит от:-
- природы вещества -
- концентрации в растворе
0 << α < 1 – для сильных электролитов Сион ≈ С
0 < α << 1 для слабых электролитов Сион << С
α > 30% сильные электролиты
α < 5% слабые электролиты.
Третий постулат:
силы взаимодействия между ионами отсутствуют.
Теория Аррениуса возникла на основе теории растворов
Вант-Гоффа,
который рассматривал растворы как идеальные газы, и явилась развитием последней
отталкиваются
 притягиваются
притягиваются
10. Константа диссоциации(ионизации). Факторы влияющие на диссоциацию.
В
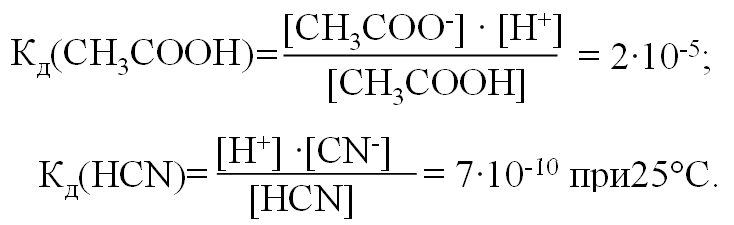
еличина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит.
-
Факторы, влияющие на диссоциацию
-
Степень ионизации электролита зависит от его концентрации в растворе.
Разбавление раствора ведет к повышению степени диссоциации электролита, потому что с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе.
Повышение концентрации электролита в растворе понижает степень его ионизации.
Степень диссоциации зависит и от изменения температуры раствора электролита.
При повышении температуры степень диссоциации слабого электролита увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов, то есть их распад на ионы. И наоборот, понижение температуры уменьшает степень ионизации слабого электролита.
На степень диссоциации влияет добавление одноименных ионов к раствору слабого электролита.
Например, если к раствору уксусной кислоты СН3СО-ОН прилить раствор ацетата натрия CH3COONa, то равновесие обратимого процесса диссоциации уксусной кислоты
СН3СООН -> СН3СОО- + Н+
согласно принципу Ле-Шателье смещается влево.
Поэтому степень диссоциации уксусной кислоты уменьшается.
11. Активность. Коэффициент активности. Ионная сила активности.
активная концентрация или активность
– эффективной или кажущей концентрации вещества, соответственно которой ионы проявляют себя в химических процессах в качестве реальной действующей массы. Активность связана с равновесной концентрацией простым соотношением.
Коэффициент пропорциональности f, называемый коэффициентом активности, характеризует степень отклонения системы от идеальности за счёт электростатических взаимодействий ионов. В идеальной системе аА=[А], так как коэффициент активности равен единице fA=1. Это означает, что электростатические взаимодействия отсутствуют.
Для расчёта коэффициентов активности ионов используют теорию Дебая-Хюккеля. Согласно этой теории ион в растворе рассматривается как заряженная частица, окружённая ионной атмосферой. Которая состоит преимущественно из противоположно заряженных ионов, а взаимодействие иона с ионной атмосферой имеет электростатический характер. Величина коэффициента активности зависит от заряда иона и параметров ионной атмосферы: её размеров и плотности. Параметры ионной атмосферы определяются ионной силой раствора I:
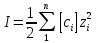
12. Теория Дебая-Хюккеля. Приближения.
Теория Дебая-Хюккеля
и

он в растворе рассматривается как заряженная частица, окружённая ионной атмосферой, которая состоит преимущественно из противоположно заряженных ионов, а взаимодействие иона с ионной атмосферой имеет электростатический характер. Величина коэффициента активности зависит от заряда иона и параметров ионной атмосферы: её размеров и плотности.
13. Теории кислот и оснований, их сопоставительный анализ.
В настоящее время наиболее широко используются две теории кислот и оснований: электронная и протонная. В 1923 г. были предложены две, доминирующие по сей день, теории кислот и оснований: протонная теория И. Брёнстеда и Т. Лоури и электронная теория Г. Льюиса.
Согласно электронной теории кислот и оснований Льюиса, отличительным признаком кислот и оснований является то, что они взаимодействуют друг с другом с образованием донорно-акцепторной (координационной) связи: А+В → [А:В],
По Льюису
Определение
Кислота - вещество, которое может использовать неподеленную пару электронов атома другой молекулы для образования устойчивой электронной группировки одного из своих атомов,
Основание - вещество, обладающее неподеленной парой электронов, которая может быть. использована для образования устойчивой электронной группировки другого атома.
По Брёнстеду: Кислота - донор протона водорода, а основание - его акцептор.
Протолитическая теория Бренстеда – Лоури.
По протолитической, или протонной теории кислота – это соединение, частица которого может отдать протон (Н+) другой частице – основанию. Согласно этой теории кислоты и основания - это вещества, теряющие и приобретающие протоны и называемые протолитами. Передача протона от кислоты к основанию называется протолизом. Кислота–донор протонов,а основание–акцептор Н+.
В результате отдачи протона сама кислота превращается в сопряженное ей основание. Основание – акцептор Н+ - превращается в сопряженную ему кислоту.
14. Протолитическая теория Бренстеда–Лоури. Протолитические пары
В 1923 году Йоханнес Николаус Бренстед и Томас Мартин Лоури выдвинули положения
теории, получившей название протолитической теории кислот и оснований.
-
к кислотам относят те вещества, которые способны отщеплять протоны.
-
основаниями называются вещества, способные присоединять протоны
Кислоты и основания – протолиты.
Примеры протолитических пар:
кислота основание
HCl « H+ + Cl-
Н2CO3 « H+ + HCO3-
HCO3- « H+ + CO3-
H2O « H+ + OH-
H3O+ « H+ + H2O
NH4+ « H+ + NH3
[Zn(OH2)n]2+ « H+ + [Zn(OH)(OH2)n-1]+
[Zn(OH)(H2O)n-1]+ « H+ + [Zn(OH)2(OH2)n-2]
Амфипротонные протолиты обладают как протонодонорными, так и протоноакцепторными свойствами.
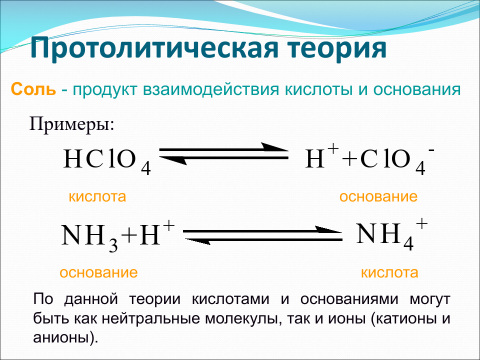
15. Вывод константа кислотности
16. Вывод константа основности. Т

еория Бренстеда-Лоури учитывает влияние растворителя при диссоциации веществ. То есть процесс диссоциации рассматривается как химическое взаимодействие между растворяемым (диссоциирующим) веществом и растворителем

17.Реакции автопротолиза. Водородный показатель.
Большинство растворителей способно проявлять и кислотные, и основные свойства, то есть являются амфотерными (амфипротными). К ним относятся вода, низшие спирты, жидкий аммиак, безводные муравьиная и уксусная кислоты и т.п. Если при столкновении двух молекул амфипротонного растворителя SH одна из них проявляет протонодонорные свойства (кислота), а другая – протоноакцепторные (основание), то между ними протекает протолитическая реакция, называемая реакцией автопротолиза:
S
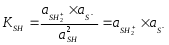 H + SH↔ SH2+ + S-
H + SH↔ SH2+ + S- 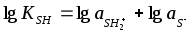
Вода - слабый электролит
Н2О = Н+ + ОН–
Ионное произведение воды:
Kw = [H+].[OH–] = 10–14 при t=250С
Кw не зависит от концентраций ионов
Растворы в которых [OH-]=[H+]=10-7
[OH-] > [H+] щелочная среда
[OH-] < [H+] кислая среда
Характеризовать кислотность и основность растворов концентрацией ионов водорода, выражаемых числами с отрицательными показателями степени, оказалось практически неудобным. Поэтому С.П.Зеренсен предложил реакцию водных растворов характеризовать водородным показателем рН, который равен отрицательному логарифму концентрации [H+]. Т.е. рН = -lg[H+]. Чем меньше величина рН, тем больше концентрация водородных ионов, тем больше кислотность раствора. Наряду с водородным показателем рН применяют гидроксидный показатель рОН.
18.Влияние природы растворителя на силу кислот и оснований.
Все вещества лишь потенциально могут быть кислотами или основаниями. Проявить свои кислотные или основные свойства они могут лишь в протолитической реакции. Одним из компонентов такой реакции может быть растворитель. Поэтому существенным достоинством протолитической теории является учет влияния растворителя на процесс кислотно – основного взаимодействия. В зависимости от природы растворителя одно и то же вещество может проявлять как кислотные, так и основные свойства. Например, СН3СООН в воде ведет себя как кислота, отщепляя протон по реакции:
СН3СООН + Н2О ->Н3О+ + СН3СОО-,
а в безводной серной кислоте - как основание, присоединяя его по реакции:
СН3СООН + Н2SO4 -> CH3COOH2+ + HSO4-.
Согласно протолитической теории все растворители подразделяются на протолитические и апротонные.
19. Расчет рН растворов сильных кислот.




2
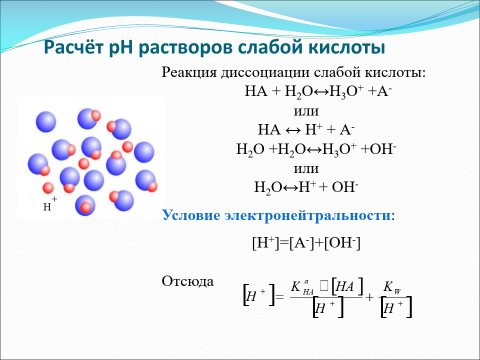

0.Расчет рН растворов слабых кислот.
21.Расчет рН растворов сильных оснований.


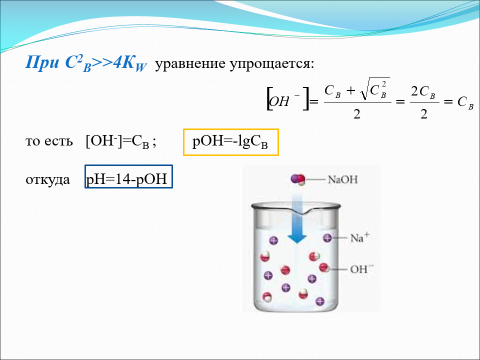
22.Расчет рН растворов слабых оснований.


21.Буферные растворы. Механизм буферного действия


Буферные растворы — растворы, сохраняющие постоянное значение pH при добавлении к ним растворов кислот и оснований.

2
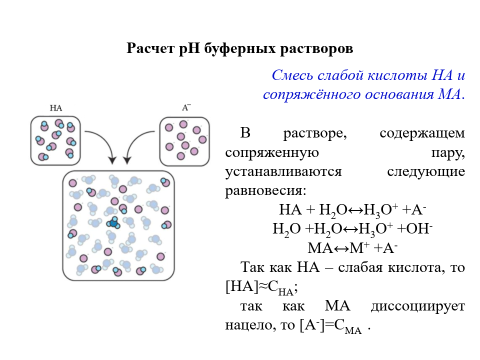
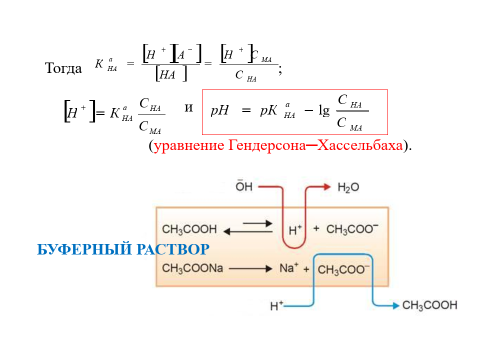
3.Определение рН буферных растворов


