ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.04.2024
Просмотров: 14
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
.

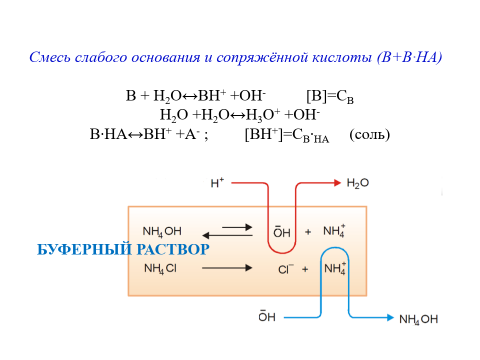
24.Вывод константы гидролиза.
Гидро́лиз — это химическая реакция взаимодействия вещества с водой, в результате которой происходит разложение этого вещества и воды с образованием новых соединений.
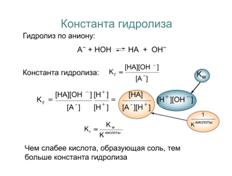
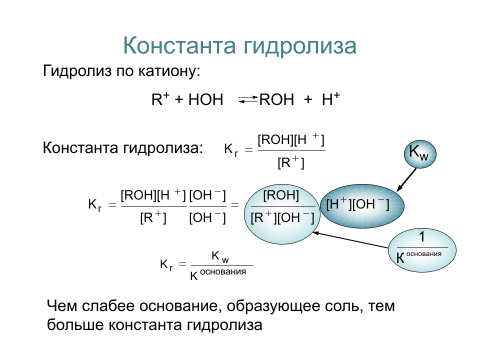
26. Степень гидролиза. Взаимосвязь степени и константы гидролиза.
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
В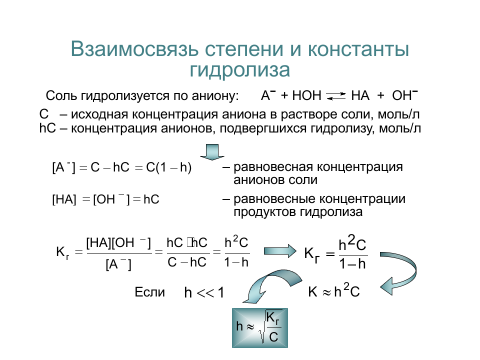
еличина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
27. Равновесия в системе осадок-раствор. Произведение растворимости и растворимость осадков.


28.Условие выпадения осадка. Влияние различных факторов на растворимость малорастворимых соединений.
Условие выпадения осадка
Произведение растворимости - важнейшая аналитическая константа, характеризующая основную закономерность равновесного состояния в системе осадок - раствор: в растворе над осадком произведение концентраций ионов является величиной постоянной при данных условиях (температура, растворитель).
1. Если в растворе произведение концентраций ионов или ионное произведение ИП, образующих осадок, меньше произведения растворимости (ИП ПР), раствор насыщен, и осадок не образуется. Молекулы осадка сразу же распадаются на ионы, т.к. их концентрация ниже равновесной. Система стремится к равновесию, и осадок не выпадает.
2. Если ИП ПР, раствор пересыщен, и осадок образуется. Образование осадка будет продолжаться до наступления равенства ИП = ПР и превращения раствора из пересыщенного в насыщенный. Тогда наступает равновесие, и дальнейшее образование осадка прекращается.
3. При равенстве ИП = ПР раствор насыщен, в нем наступает подвижное равновесие, и осадок не выпадает.
Влияние факторов


24.Вывод константы гидролиза.
Гидро́лиз — это химическая реакция взаимодействия вещества с водой, в результате которой происходит разложение этого вещества и воды с образованием новых соединений.


26. Степень гидролиза. Взаимосвязь степени и константы гидролиза.
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
В

еличина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
27. Равновесия в системе осадок-раствор. Произведение растворимости и растворимость осадков.


28.Условие выпадения осадка. Влияние различных факторов на растворимость малорастворимых соединений.
Условие выпадения осадка
Произведение растворимости - важнейшая аналитическая константа, характеризующая основную закономерность равновесного состояния в системе осадок - раствор: в растворе над осадком произведение концентраций ионов является величиной постоянной при данных условиях (температура, растворитель).
1. Если в растворе произведение концентраций ионов или ионное произведение ИП, образующих осадок, меньше произведения растворимости (ИП ПР), раствор насыщен, и осадок не образуется. Молекулы осадка сразу же распадаются на ионы, т.к. их концентрация ниже равновесной. Система стремится к равновесию, и осадок не выпадает.
2. Если ИП ПР, раствор пересыщен, и осадок образуется. Образование осадка будет продолжаться до наступления равенства ИП = ПР и превращения раствора из пересыщенного в насыщенный. Тогда наступает равновесие, и дальнейшее образование осадка прекращается.
3. При равенстве ИП = ПР раствор насыщен, в нем наступает подвижное равновесие, и осадок не выпадает.
Влияние факторов
-
При добавлении к насыщенному раствору малорастворимого электролита раствора сильного электролита, не имеющего с ним общих (одноименных) ионов, растворимость малорастворимого электролита увеличивается. Это явление называется солевым эффектом. -
Влияние растворителя. Растворимость вещества при постоянных температуре и давлении определяется не только свойствами самого вещества, но также свойствами и природой растворителя.


